包载马钱子碱聚乳酸-羟基乙酸共聚物纳米粒处方工艺优化及其特性研究
管庆霞,夏昭睿,王艳宏,张 雪,李伟男,杨志欣,王 锐,李秀岩,冯宇飞
·药剂与工艺·
包载马钱子碱聚乳酸-羟基乙酸共聚物纳米粒处方工艺优化及其特性研究
管庆霞,夏昭睿,王艳宏,张 雪,李伟男,杨志欣,王 锐,李秀岩,冯宇飞*
黑龙江中医药大学,黑龙江 哈尔滨 150040
对包载马钱子碱(brucine)聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA](B-PLGA)纳米粒进行处方与工艺优化。采用沉淀法制备B-PLGA纳米粒,以平均粒径、多分散系数(PDI)、Zeta电位、包封率和载药量为评价指标,采用单因素考察法结合星点设计-效应面法(CCD-RSM)筛选B-PLGA纳米粒的最优处方,并将最优处方进行表征及体外释放实验。最优处方选择丙酮作为有机溶剂,泊洛沙姆188(F68)作为稳定剂,超声时间为1 min,磁力搅拌速度为900 r/min,磁力搅拌时间为30 min,F68用量为0.35%,载体用量为25 mg,药物用量为1.0 mg,有机相与水相的比为0.54。所制得的B-PLGA纳米粒为淡蓝色乳光透明液体,粒径为(97.12±4.23)nm,PDI为0.098±0.035,Zeta电位为(−27.30±0.31)mV,包封率为(69.24±1.42)%,载药量为(2.65±0.03)%。通过表征,纳米粒形态完整,通过体外释放实验得知,纳米粒体外释放拟合符合Higuchi方程。星点设计-效应面法可用于包载马钱子碱PLGA纳米粒处方与工艺优化,且优化后的纳米粒具有缓释作用。
马钱子碱;聚乳酸-羟基乙酸共聚物;纳米粒;沉淀法;单因素考察法;星点设计-效应面法;体外释放;Higuchi方程;缓释作用
马钱子碱(brucine)是马钱科马钱属植物马钱子L.种子的主要活性物质[1],具有显著性镇痛、抗炎作用[2],还具有抗肿瘤、中枢神经系统兴奋等作用[3-4],是一种高效的抗肿瘤单体,可用于胃癌、肠癌、肺癌、肝癌、白血病等疾病的治疗,但是由于马钱子碱毒性大、水溶性差、体内代谢迅速,且马钱子碱的治疗剂量与中毒剂量较接近[5],故传统制剂不利于马钱子碱发挥药效,从而使其在临床上的应用受到了极大限制。
纳米技术在医学方面的应用研究一直备受瞩目,是近年正在发展的一种新型毫微粒类给药系统,可以降低药物的不良反应、延缓体内释放及具有良好的靶向性,纳米药物在改善药物活性及降低药物毒性方面具有独特优势,具有推动药学发展的巨大潜力[6-8]。
目前,聚乳酸-羟基乙酸共聚物[poly(lactic- co-glycolic acid),PLGA]载体作为制剂辅料已被美国食品药品监督管理局和欧盟药品局批准用于临床,是制备纳米粒应用最广泛的生物可降解高分子材料,其对脂溶性药物具有较强的包裹能力,同时降解速率规律,可以实现药物的可控释放,在药物制剂领域中具有巨大的开发价值和市场[9-11]。
星点设计-效应面法是近年来常用的一种设计方法,可以很好地完成二次项拟合工作,具有实验次数相对较少、精确度高、操作简单、优选条件预测性好等优点[12-13]。因此,本实验采用该方法结合单因素考察法进行包载马钱子碱PLGA(B-PLGA)纳米粒的处方与工艺优化,为马钱子碱进一步临床研究奠定了基础。
1 仪器与材料
1.1 仪器
Waters e2695-2698高效液相色谱仪系统,美国Waters公司;FA1204B分析电子天平,济南鑫贝西生物技术有限公司;HJ-3恒温磁力搅拌器,常州仪器制造有限公司;Zetasizer Nano-ZS90激光粒度分析仪,英国马尔文仪器有限公司;KQ-250DE型数控超声波清洗机,昆山市超声仪器有限公司;LVEM5低电压台式透射电子显微镜(TEM),QUANTUM量子科学仪器贸易有限公司。
1.2 试剂
马钱子碱对照品,批号110706-200505,质量分数98%,中国食品药品检定研究院;泊洛沙姆188(F68),德国BASF公司;司盘40,江苏四新界面剂科技有限公司;甲醇,色谱纯,北京Dikma公司;无水乙醇,分析纯,天津市富宇精细化工有限公司。
2 方法与结果
2.1 B-PLGA纳米粒中马钱子碱含量测定
2.1.1 检测波长的确定 称取适量的马钱子碱对照品,将其溶解到色谱甲醇溶液中,定容到合适的浓度,二级阵列管检测器上设置检测波长190~400 nm,进行检测。马钱子碱在223.3、265.7、301.2 nm处有最大吸收峰,结合相关文献报道[4,14]的波长范围,确定265 nm为马钱子碱的检测波长。
2.1.2 色谱条件 色谱柱为Dikma C18(250 mm×4.6 mm,5 μm);流动相为甲醇-[水-乙酸-三乙胺(230∶2.4∶0.3)](30∶70);检测波长为265 nm;体积流量1 mL/min;进样量10 μL;柱温30 ℃。
2.1.3 供试品溶液的制备 从已经准备好的B- PLGA混悬液中精确量取10 mL溶液,将其加入15 mL色谱甲醇中,在40 kHz、200 W的环境下超声,时间为20 min,使纳米粒破乳,将处理后的溶液用孔径为0.22 μm的过滤膜滤过后得到B-PLGA纳米粒供试品溶液。用同样的方法制取PLGA空白纳米粒溶液。
2.1.4 对照品溶液的制备 先精确称量3.1 mg的马钱子碱,加入甲醇溶液使其定容至25 mL,作为对照品储备液,质量浓度为124.00 μg/mL。
2.1.5 专属性考察 分别取PLGA空白纳米粒溶液、马钱子碱对照品溶液和B-PLGA供试品溶液在“2.1.2”项色谱条件下进行检测,对其专属性进行考察,结果见图1。可以看到,在该色谱检测条件下辅料对主药马钱子碱的含量测定没有干扰,方法专属性良好,因此符合测定要求。
2.1.6 线性关系考察 精密量取马钱子碱对照品溶液10.00、5.00、2.50、1.25、0.63、0.31 mL,置于10 mL量瓶中,配制出6种质量浓度的对照品溶液,分别为124.00、62.00、31.00、15.50、7.75、3.88 μg/mL。按“2.1.2”项色谱条件下进行检测,并记录峰面积,以马钱子碱质量浓度为横坐标(),色谱峰面积为纵坐标(),对其进行线性回归,得到线性回归方程为=15 539+39 436,=0.999 7,结果表明马钱子碱在3.88~124.00 μg/mL线性关系良好。
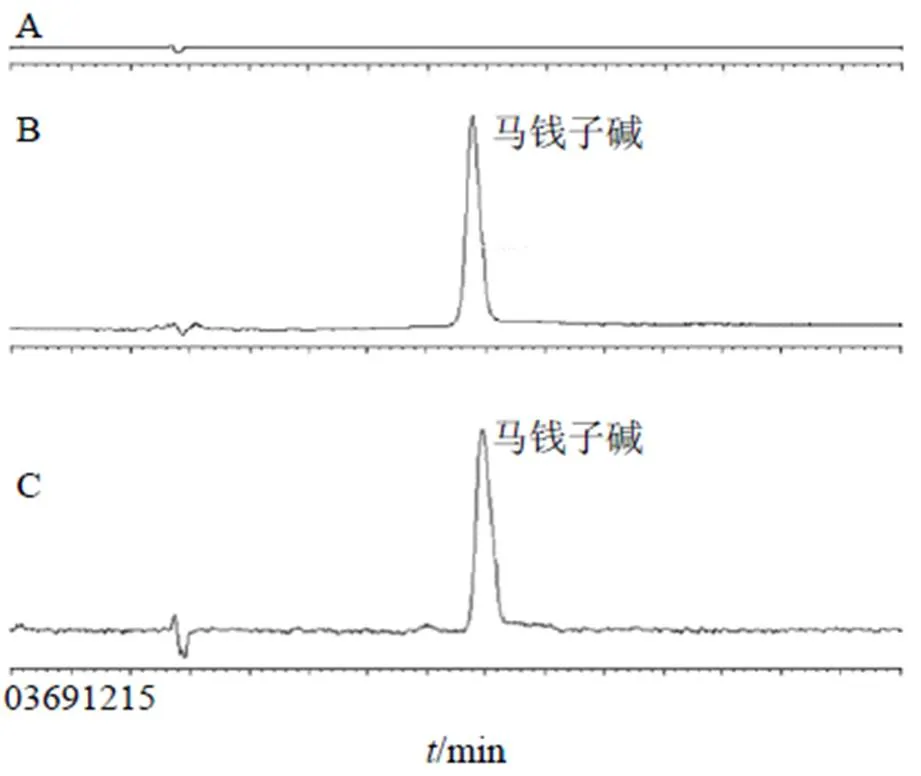
图1 PLGA空白纳米粒(A)、马钱子碱对照品溶液 (B) 和B-PLGA纳米粒(C)的HPLC图
2.1.7 精密度试验 取124.00 μg/mL的马钱子碱对照品溶液,在“2.1.2”项色谱条件下1 d内测定6次,连续测定6 d(每天1次),日内精密度和日间精密度RSD分别为0.87%和0.90%,说明日内、日间精密度良好。
2.1.8 稳定性试验 精密吸取同一份B-PLGA纳米粒供试品溶液,分别在制备后0、2、4、8、10、12 h时,按“2.1.2”项色谱条件进样测定。结果发现12 h内马钱子碱峰面积RSD为1.12%,表明供试品溶液在12 h内稳定性良好。
2.1.9 重复性试验 分别取同一B-PLGA纳米粒样品6份,按照“2.1.3”项下方法制备供试品溶液,在“2.1.2”项色谱条件下测定峰面积,计算得到马钱子碱质量浓度的RSD值为1.04%,表明该方法重复性良好。
2.1.10 加样回收率试验 精密吸取0.3 mL的空白纳米粒,共9份,分为3组,各组分别精密加入0.3 mL的低、中、高质量浓度(10、40、70 μg/mL)的马钱子碱对照品溶液,各3份,混匀。将处理后的溶液用孔径为0.22 μm滤膜滤过,并在“2.1.2”项色谱条件下进样检测并记录,计算加样回收率,结果3种质量浓度溶液的平均加样回收率在98%~101%,且其RSD值均小于2%,结果表明该方法符合检测要求。
2.2 包封率与载药量的测定方法
选取几种常见包封率和载药量的测定方法,并对其优缺点等进行分析,选择出适宜的测定方法,不同测定方法实验结果见表1。
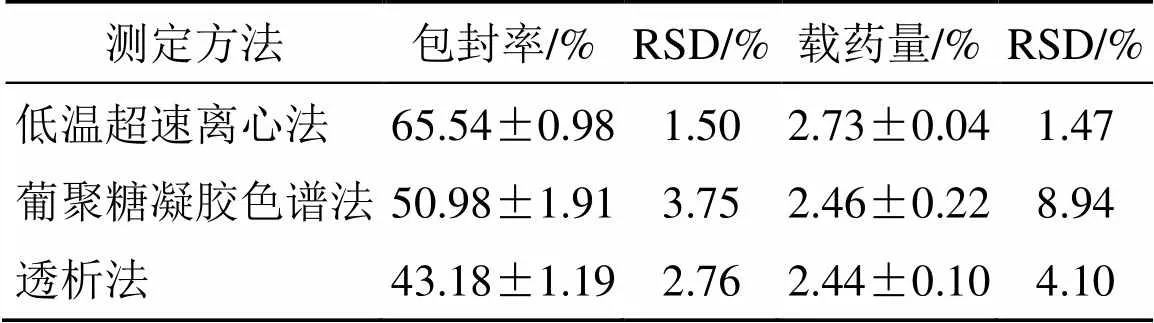
表1 不同测定方法的实验结果
2.2.1 低温超速离心法 取出2 mL的B-PLGA纳米粒混悬液,并将其放置在离心机中,在离心半径40 cm,15 000 r/min转速下离心30 min,将沉淀的纳米粒收集,再用蒸馏水超声使其分散,继续离心,重复3次,然后用孔径为0.22 μm的过滤膜滤过,计算其包封率和载药量。
2.2.2 葡聚糖凝胶色谱法 取出2 mL B-PLGA纳米粒混悬液,将其添加到已经经过处理的Sephadex G-50凝胶柱上,用蒸馏水洗脱2 min,收集纳米粒,然后用孔径为0.22 μm的过滤膜滤过,计算其包封率和载药量。
2.2.3 透析法 将装有2 mL B-PLGA纳米粒透析袋置于透析外液为含20%乙醇pH 7.4的磷酸盐缓冲溶液(PBS)中,用转速为1000 r/min的磁力搅拌器搅拌4 h,取透析内液,用孔径为0.22 μm的过滤膜滤过,计算其包封率和载药量。
包封率及载药量计算公式为包封率=(2-1)/2,载药量=(2-1)/3,其中1为测得的游离马钱子碱含量,2为马钱子碱总投料量,3为B-PLGA纳米粒总量。
由表1可知,通过低温超速离心法得到的药物包封率与载药量最高,最低的是透析法;而且,透析法耗费的时间较长,所以不排除存在纳米粒中药物释放的可能;葡聚糖凝胶色谱法的RSD值较大,可能因为某批次样品稀释过程中导致药物泄露,使得包封率和载药量的数值不稳定;低温超速离心法测得包封率和载药量较高且偏差值较小;因此,本课题最终确定使用低温超速离心法对纳米粒的包封率进行检测。
2.3 B-PLGA纳米粒处方工艺优化
2.3.1 制备方法的选择 选取几种常见的制备方法,并对其制备过程及优缺点进行分析,选择出B-PLGA纳米粒适宜的制备方法,不同制备方法实验结果见表2。
复乳法:用质量为1.2 mg药物和1 mL蒸馏水混合成溶液并将其作为内水相,用W1表示;然后用25 mg共聚物和10 mL丙酮混合并经过超声处理后作为油相,用O表示;用蒸馏水将聚山梨酯80制备成浓度为0.2%的水溶液作为外水相,用W2表示。操作方法:首先取出O溶液并向其中加入W1,然后将O与W1的混匀溶液放入细胞破碎仪中,超声30 s;然后将其加入到17.6 mL W2溶液中并放入磁力搅拌器中,再次超声30 min后得到并W1/O/W2复乳;然后将溶液放入蒸发仪中除去有机溶剂,获得纳米粒溶液。

表2 不同制备方法实验结果(, n = 3)
沉淀法:称取出25 mg共聚物,将其放入到10 mL丙酮中,超声使其溶解,该溶液作为有机相。向里面添加1.2 mg药物,再次超声使其充分溶解。配制20 mL含0.05% F68的水溶液,将其作为水相,将有机相加入到水相中并将其放在转速为1000 r/min的磁力搅拌30 min,将溶液放入旋转蒸发仪中除去有机溶剂,获得纳米粒溶液。
盐析法:取0.5 mL PLGA共聚物材料的丙酮溶液,加入到1.5 mL含28% MgCl2的F68溶液中,混合后的溶液超声3次,每次时间为10 s。再加到1.5 mL的溶有10 mg药物的水中,使丙酮扩散,于室温条件下磁力搅拌,直到丙酮全部挥干,即得。
由表2可知,不同的制备方法对制备B-PLGA纳米粒有着不同的影响。3种方法比较后可知,沉淀法制备纳米粒时药品包封率和载药量均高于其他2种方法,粒径最小,分散较好,且沉淀法实验操作过程较其他2种方法简便。因此,本课题选择使用沉淀法作为B-PLGA纳米粒的制备方法。
2.3.2 有机溶剂种类的考察 在保持其他条件不变的情况下,以乙腈、丙酮、甲醇有机溶剂作为有机相制备纳米粒,判断有机溶剂种类对B-PLGA纳米粒制备的影响,结果见表3。由实验数据可知,丙酮作有机溶剂时的纳米粒的平均粒径最小,但是其包封率和载药量都最大,粒径分布均匀,体系稳定,所以本实验最后确定有机溶剂为丙酮。
2.3.3 稳定剂种类的考察 在保持其他条件不变的情况下,分别以F68、聚山梨酯80、司盘40 3种表面活性剂为稳定剂制备纳米粒,考察不同种类稳定性对B-PLGA纳米粒制备的影响,结果见表4。随着稳定剂的改变,平均粒径和Zeta电位逐渐变大,而PDI均较好,包封率和载药量都在逐渐变小,由此可见,F68较聚山梨酯80和司盘40更加稳定,所以应用F68作为本实验的稳定剂。
2.3.4 超声时间的考察 保持其他条件不变,考察超声时间分别为0.5、1.0、1.5、2.0、2.5 min时,对B-PLGA纳米粒制备的影响,结果见表5。随着超声时间的增加,平均粒径和Zeta电位均是先减小后增大,而其包封率和载药量都是先增大之后减小。根据推测可能是因为超声时间的增加会使得纳米粒重新聚结,导致药物泄漏,粒径增大,包封率和载药量变小,所以本实验最后确定超声时间为1.0 min。

表3 不同种类有机溶剂实验结果(, n = 3)

表4 不同种类稳定剂实验结果(, n = 3)
2.3.5 磁力搅拌速率的考察 保持其他条件不变,考察300、600、900、1200、1500 r/min 5个搅拌速率对B-PLGA纳米粒制备的影响,结果见表6。当磁力搅拌速率在900 r/min时平均粒径最小,纳米粒的分布相对均匀,体系稳定,包封率和载药量均处于最大值。所以,本实验磁力搅拌的速度确定为900 r/min。

表5 不同超声时间实验结果(, n = 3)

表6 不同磁力搅拌速率对B-PLGA纳米粒的影响(, n = 3)
2.3.6 磁力搅拌时间的考察 保持其他条件不变,考察10、20、30、40、50 min 5个磁力搅拌时间对B-PLGA纳米粒制备的影响,结果见表7。当磁力搅拌时间为30 min时,纳米粒的分布相对均匀,粒径的大小变化不大,包封率和载药量都最大,所以本实验最后确定的磁力搅拌时间为30 min。
2.3.7 稳定剂F68用量的考察 保持其他条件不变的前提下,将F68用量设置成0、0.05%、0.10%、0.50%、1.00%系列不同的用量制备纳米粒。考察F68用量对B-PLGA纳米粒制备的影响,结果见表8。随F68用量的逐渐增加,平均粒径逐渐变大,但包封率和载药量均呈先变大后又变小的趋势,由此可知,F68用量对B-PLGA纳米粒制备的影响较大,而在F68用量为0.5%左右包封率载药量较大,所以本实验最后确定F68用量为0.50%左右,需进一步优化。
2.3.8 载体PLGA用量的考察 保持其他条件不变,选择10、20、30、40、50 mg 5个PLGA用量对制备B-PLGA纳米粒的影响,结果见表9。平均粒径和Zeta电位先变小后变大,包封率先变大后变小,载药量逐渐变小,可见载体PLGA用量对B-PLGA纳米粒的制备影响较大,载体用量在20 mg时,包封率最大,所以需对载体用量进一步优化。

表7 不同磁力搅拌时间实验结果(, n = 3)
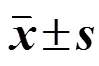
表8 稳定剂F68不同用量实验结果(, n = 3)
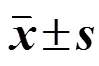
表9 不同载体用量实验结果(, n = 3)
2.3.9 药物用量的考察 保持其他条件不变,通过改变药物用量,判断药物用量对B-PLGA纳米粒制备的影响。分别制备0.5、1.0、1.5、2.0、2.5 mg 5个药物用量的纳米粒,结果见表10。随着药物用量的增加,平均粒径逐渐变大,Zeta电位先变小后变大,包封率和载药量先变大后变小,药物用量在1.0 mg时,包封率和载药量均最大,所以本实验最后确定的药物用量为1.0 mg。
2.3.10 有机相与水相体积比的考察 保持其他条件不变,将有机溶剂与水的体积比作为变量,分别设置5个比例1∶1.5、1∶2、1∶3、1∶4、1∶5考察对制备的B-PLGA纳米粒的影响,结果见表11。有机相与水相比例的逐渐减小,使得平均粒径和Zeta电位值先变小后又逐渐变大,分布均匀,体系稳定,包封率和载药量均逐渐增大后减小。因此,当有机溶剂和水的比例在1∶2时,纳米粒的状态最好,可进一步优化。
2.4 星点设计-效应面法(CCD-RSM)优化处方
2.4.1 实验设计 在前期对于影响B-PLGA纳米粒各种指标的单因素考察基础之上,发现载体PLGA用量、有机相与水相体积比、稳定剂F68用量对处方考察指标影响较大,所以本实验需要针对这3个因素进行更加深入的CCD实验设计。本实验共从5个角度对其进行衡量,其中包括中心点、析因设计点、极值点。当=1.682,各个变量范围的实际大小和标准大小见表12。本实验将包封率和载药量作为响应参数,分别用1和2表示,然后进行CCD实验,实验结果见表13。
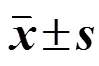
表10 不同药物用量实验结果(, n = 3)
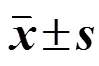
表11 不同有机相水相比例实验结果(, n = 3)
2.4.2 模型拟合及方差分析 分析软件为Design- Expert V8.0.6,以包封率(1)、载药量(2)分别对A、B、C实验数据进行二次多项式回归方程拟合。二次多项式拟合方程:1=71.42-0.042 A+6.41 B+0.72 C-1.14 AB+1.34 AC+4.27 BC-3.60 A2-5.61 B2-0.93 C2(2=0.915 8,=0.000 1);2=1.86-9.153×10−3A+0.061 B+0.011 C-0.016 AB+0.026 AC+0.091 BC-0.071 A2-0.120 B2-0.018 C2(2=0.885 1,=0.000 1)。从2和的计算结果可以看出,二次多项式的拟合相对较好,因此可用此模型对B-PLGA纳米粒的处方进行分析和预测,其分析实验结果分别见表14。由表14可知,1、2模型项<0.001,说明回归方程的关系是极显著的。对于1模型方程B、BC、A2、B2都是显著项,是1的显著影响因素,交互影响因素3D效果图与等高线图见图2。对于2模型方程B、BC、A2、B2都是显著项,是2的显著影响因素,交互影响因素3D效果图与等高线图见图3。

表12 各变量范围实际值标准化值
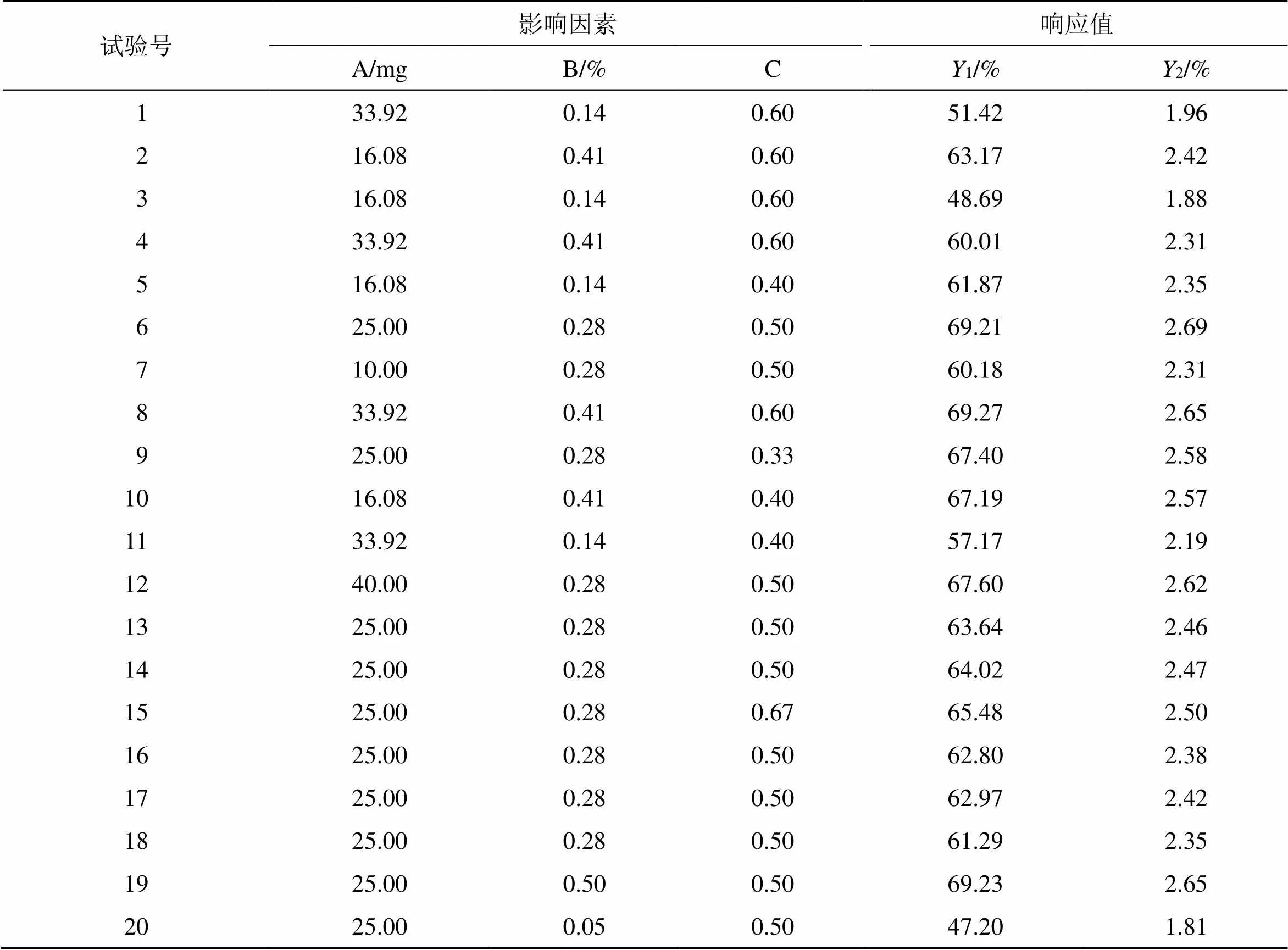
表13 CCD的实验设计及结果

表14 Y1和Y2方差分析实验结果

图2 Y1响应面图与等高线

图3 Y2响应面图与等高线
2.4.3 响应面优化与预测 根据上述实验结果可以看到,公共区域中效应面响应值较高部分为最佳的区域,由Design-Expert V8.0.6软件设计优化各因素,最终确定包封率、载药量最高的处方条件是 A=25 mg,B=0.35%,C=0.54,1=72.42%,2=2.77%。
2.4.4 优化后处方验证 综上所述,B-PLGA纳米粒最优处方是丙酮作为有机溶剂,F68作为稳定剂,超声时间为1 min,磁力搅拌速率为900 r/min,磁力搅拌时间为30 min,F68用量为0.35%,载体用量为25 mg,药物用量为1.0 mg,有机相与水相体积比为0.54。优化后处方验证结果见表15,可以看出,预测值和实测值之间的相对偏差[相对偏差=(预测值-实测值)/预测值]在5%以下,表明优化后的处方验证试验的预测值与实测值基本相吻合,经过CCD-RSM进行预测,结果显示其效果较好,因此,可以描述效应面和影响因素之间的关系。按优化后的工艺及处方制备3批B-PLGA纳米粒样品,PDI、平均粒径、Zeta电位、包封率及载药量测定结果见表16,外观见图4。由表16可知,3批样品批间的各项指标变化差异小,重现性良好;由图4可知,B-PLGA纳米粒为淡蓝色乳光透明液体。
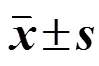
表15 验证结果(, n = 3)
2.5 B-PLGA纳米粒的表征
取适量最优工艺条件下制得的B-PLGA纳米粒溶液在其中取出40 μL溶液滴在铜网上(用支持膜覆盖),将多余的液体用滤纸吸净,放置在自然环境中待其风干。向其中加入浓度为2%磷钨酸染色约30 s,将其放在电镜下观察,结果见图5。该纳米粒的形态为类球形,各个粒子之间的分布相对均匀且没有明显的粘连现象。用激光粒度分析仪测定平均粒径及Zeta电位,结果见图6、7。
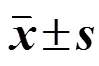
表16 验证结果(, n = 3)

图4 B-PLGA纳米粒样品外观

图5 B-PLGA纳米粒透射电镜图(×25 000)
2.6 B-PLGA纳米粒体外释药实验
体外试药研究采用动态透析法。首先精密称取B-PLGA纳米粒冻干品(相当于马钱子碱为5 mg),用5 mL生理盐水稀释,当二者完全处于混合状态后将溶液置于处理过的透析袋中,将透析袋的两头扎紧后放入具塞锥形瓶中;将50 mL的释放介质放入瓶中,此时应保证透析袋完全浸没在释放介质中;将锥形瓶放入恒温水浴震荡器中,温度设置在36.8~37.2 ℃,振摇速率设置为100 r/min;释放开始后,分别于0.25、0.5、1、1.5、2、2.5、3、4、6、8、10、12、18、24、36、48、60、72 h时,用移液枪量取1 mL透析含药外液,同时补充相同体积的透析空白外液,用孔径为0.22 μm的滤膜对其进行滤过,用相同的方法测定3次,计算B-PLGA纳米粒的药物累积释放率。另精密称取相同质量的马钱子碱原料药,按上述方法操作进行体外释药研究,以累积释药率对释药时间作图,绘制释放曲线,马钱子碱、B-PLGA纳米粒的释药曲线如图8所示,进行体外释药动力学拟合,结果见表17。各时间点的药物累积释放率()计算公式如下。

图6 B-PLGA纳米粒的粒径图

图7 B-PLGA纳米粒的Zeta电位图

0为释放介质的总体积,C为各时间点测得的药物质量浓度,为每次取样体积,为投入药物总质量

图8 B-PLGA纳米粒与马钱子碱的累积释药率曲线

表17 B-PLGA纳米粒组体外释放拟合结果
由上述结果可知,在释放介质中,马钱子碱溶液组释药相对较快,24 h时马钱子碱已基本全部释放,累积释放率为94.65%,而B-PLGA纳米粒组前4 h时释药较快,累积释放率为33.69%,之后释药曲线渐趋平稳,药物缓慢释放,48 h药物基本释放完全,72 h累积释放率为85.74%。可见,将马钱子碱制成B-PLGA纳米粒后,具有一定的缓释效果,拟合结果表明最符合Higuchi方程(²=0.948),属于典型的缓释模型。
3 讨论
本实验在进行处方优化时,F68具有极强的表面活性,其用量对样品的乳化程度影响很大,进一步影响装载药物的能力,故非离子型表面活性剂F68用量对样品的包封率影响较大。有机相与水相的比例对纳米粒包封率的影响可能是影响其形成纳米粒的过程,有机相与水相间溶剂的交换及界面作用也在一定程度上决定了样品成型的优劣。有限的载体装载药物的能力也有限,故载体用量对样品的包封率及载药量影响极大。载体用量较大时,样品极易聚集使粒径增加;载体用量过少,包封药物量过低,故合适的载体用量是马钱子碱纳米粒制备的关键影响因素。
B-PLGA纳米粒的制备工艺由诸多因素影响,且单因素或正交设计不能准确预测多因素的交互作用。星点设计-效应面法具有实验次数相对较少,精密度高、优选条件预测性好与实际大生产相吻合等特点[15-16],故在制备工艺的单因素基础上采用星点设计-效应面法,考察载体用量、有机相与水相的比例、稳定剂浓度3个因素对B-PLGA纳米粒制备的影响并进一步优化处方。通过模型拟合及方差分析可知此模型可用于B-PLGA纳米粒的处方的分析和预测。通过优化后的处方验证表明,实测值与预测值之间的相对偏差较小,并且对优化后的B-PLGA纳米粒进行微观形态观察和体外释放试验,显示纳米粒形态完整且具有一定缓释效果,表明优化后的纳米粒模型良好。本实验成功制备并优化了B-PLGA纳米粒,为马钱子碱进一步临床研究提供参考,为纳米给药系统研究提供了科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Tang M, Zhu W J, Yang Z C,. Brucine inhibits TNF-α-induced HFLS-RA cell proliferation by activating the JNK signaling pathway [J]., 2019, 18(1): 735-740.
[2] Yu G, Qian L, Yu J,. Brucine alleviates neuropathic pain in mice via reducing the current of the sodium channel [J]., 2019, 233: 56-63.
[3] 金晨, 陈家乐, 徐玲霞, 等. 马钱子总碱脂质液晶纳米粒的制备和体外评价研究 [J]. 中草药, 2018, 49(22): 5305-5312.
[4] 邓向涛, 阮晓东, 郝海军. 马钱子碱固体脂质纳米粒凝胶骨架缓释片的研制 [J]. 中草药, 2018, 49(22): 5298-5304.
[5] 胡亚, 刘运锋, 朱卫丰, 等. 马钱子生物碱类成分在MDCK-MDR1单层细胞模型中的转运机制研究 [J]. 中草药, 2019, 50(12): 2876-2883.
[6] 陈坚平, 方玉婵, 申楼. 熊果酸-PLGA纳米粒的工艺研究及其表征 [J]. 中药材, 2016, 39(10): 2315-2317.
[7] 柯文冬. 克服药物递送障碍的智能型纳米药物载体 [D].合肥: 中国科学技术大学, 2020.
[8] 高珩. 纳米技术在生物医药方面的应用研究 [J]. 创新创业理论研究与实践, 2020, 3(5): 168-169.
[9] 阙晓, 高明, 郭朋程,等. 红细胞膜包载粉防己碱PLGA纳米粒的制备与体外评价 [J]. 沈阳药科大学学报, 2020, 37(5): 401-407.
[10] 封烨, 周朝阳, 刘芊芊, 等. 星点设计-效应面法优化长春新碱长循环纳米粒的制备工艺 [J]. 湖北科技学院学报: 医学版, 2020, 34(4): 296-301.
[11] 徐晓川. IR780-VPN靶向纳米粒的制备及体外抗肾母细胞瘤增殖试验 [D].重庆:重庆医科大学, 2020.
[12] 王博, 李洪起, 连潇嫣, 等. 星点设计-效应面法优化阿德福韦-β-环糊精包合物制备工艺的研究 [J]. 现代药物与临床, 2014, 29(11): 1227-1230.
[13] 王婴, 李木生, 吴瑞婵, 等. 星点设计-效应面法优化青藤碱聚乳酸-羟基乙酸纳米粒的制备工艺 [J]. 中药新药与临床药理, 2017, 28(2): 232-237.
[14] 刘丽丽, 史畑女, 方蕾, 等. 马钱子总碱-白芍总苷脂质立方液晶纳米粒制备及体外评价 [J]. 中草药, 2019, 50(17): 4076-4083.
[15] 严春临, 张季, 刘敏, 等. 星点设计-效应面法优化吴茱萸次碱固体脂质纳米粒处方 [J]. 中草药, 2015, 46(9): 1307-1313.
[16] 郝吉福, 房信胜, 王建筑, 等. 应用Box-Behnken实验设计优化水飞蓟素固体脂质纳米粒处方研究 [J]. 中草药, 2011, 42(11): 2221-2225.
Optimization of formulation and characteristics of PLGA nanoparticles containing brucine
GUAN Qing-xia, XIA Zhao-rui, WANG Yan-hong, ZHANG Xue, LI Wei-nan, YANG Zhi-xin, WANG Rui, LI Xiu-yan, FENG Yu-fei
College of Pharmacy, Heilongjiang University of Chinese Medicine, Harbin 150040, China
To optimize the formulation and process of poly(lactic-co-glycolic acid) (PLGA) nanoparticles containing brucine (B-PLGA).The precipitation method was used to prepare B-PLGA nanoparticles, and the particle size, polydispersity coefficient (PDI), Zeta potential, encapsulation efficiency, and drug loading were used as evaluation indicators. The single factor investigation method combined with the central composite design-response surface method (CCD-RSM) were used to screen the optimal formulation of B-PLGA nanoparticles, and the characterization andrelease experiments on the optimal formulation were performed.Acetone and Poloxamer 188 (F68) were selected as the organic solvent and the stabilizer for the optimal prescription, the ultrasonic time was 1 min, the magnetic stirring speed was 900 r/min, the magnetic stirring time was 30 min, the F68 concentration was 0.35%, the carrier dosage was 25 mg, the drug dosage was 1.0 mg. The ratio of organic phase to water phase was 0.54. The prepared B-PLGA nanoparticles were light blue opalescent transparent liquid with a particle size of (97.12 ± 4.23) nm, a PDI of 0.098 ± 0.035, a Zeta potential of (−27.30 ± 0.31) mV, and an encapsulation efficiency of (69.24 ± 1.42)%, and the drug loading was (2.65 ± 0.03)%. Through characterization, the morphology of the nanoparticles was complete, and therelease experiment showed that therelease fit of the nanoparticles conforms to the Higuchi equation.The method is stable and feasible, which can be used for the formulation and process optimization of PLGA nanoparticles containing brucine, and the optimized nanoparticles have slow-release effect.
brucine; polylactic acid-glycolic acid copolymer; nanoparticles; precipitation method; single factor method; star point design-response surface method;release; Higuchi equation; sustained release
R283.6
A
0253 - 2670(2021)04 - 0951 - 11
10.7501/j.issn.0253-2670.2021.04.007
2020-09-29
国家自然科学基金青年基金项目(81703944);黑龙江省自然科学基金优秀青年项目(YQ2019H031);黑龙江中医药大学“优秀创新人才支持计划”项目(2018年)
管庆霞,博士,副教授,从事中药纳米递药系统及中药新药开发研究。Tel: (0451)87266893 E-mail: 546105832@qq.com
冯宇飞,博士,副教授,从事中药新技术与新剂型、方剂药效物质基础研究。Tel: (0451)87266893 E-mail: fuf-002@163.com
[责任编辑 郑礼胜]

