宫颈癌放化疗骨盆骨髓保护与急性血液不良反应关系分析
谢洋,李丽
宫颈癌是女性常见的生殖系统恶性肿瘤,发病率、病死率均较高,已经成为威胁女性身心健康的主要疾病[1]。目前,该病治疗主要采取放化疗手段。但如果同步放化疗时照射剂量较大,容易损伤骨髓,引起急性血液不良反应,严重时患者无法耐受[2]。因此,在保证疗效的情况下,减少急性血液不良反应的发生风险,是保障治疗顺利进行的关键,可进一步提高治疗效果。近年来,临床对接受同步放化疗的患者实施骨盆骨髓保护方案,限制了骨髓的照射剂量和体积,有效降低了骨髓抑制等急性血液不良反应发生率[3]。本研究通过观察宫颈癌患者在接受同步放化疗时骨盆骨髓保护的剂量及急性血液不良反应的发生情况,分析两者之间的关系,报道如下。
1 资料与方法
1.1 一般资料 选取2018年4月-2020年3月襄阳市襄州区人民医院收治的宫颈癌术后患者50例为研究对象,根据随机数字表法分为观察组和对照组,每组25例。观察组平均年龄(52.60±4.81)岁;平均ECOG评分(1.27±0.13)分;鳞癌22例、腺癌3例;TNM分期:Ⅰ期6例、Ⅱ期8例、Ⅲ期11例。对照组平均年龄(52.48±4.73)岁;平均ECOG评分(1.30±0.14)分;鳞癌21例、腺癌4例;TNM分期:Ⅰ期7例、Ⅱ期6例、Ⅲ期12例。2组患者一般资料比较差异无统计学意义(P>0.05),可进行比较。
1.2 纳入及排除标准 纳入标准:(1)患者均符合宫颈癌的诊断标准,已进行手术经病理学活检确诊;(2)符合放射治疗的适应证;(3)本研究经医学伦理委员会批准,患者和家属了解本次研究内容并签署知情同意书。排除标准:(1)已经接受过放化疗患者;(2)免疫系统疾病患者;(3)患有精神疾病,无法配合研究者。
1.3 方法 2组患者均进行同步放化疗,观察组治疗时则进行骨盆骨髓保护,处方剂量为40~50 Gy,将95%的处方剂量置于病灶区域内,每周5次,持续治疗4周[4];主要方法为先勾画患者的肿瘤的原发灶、骨髓,并根据靶区部位不同,如髂骨、坐骨、腰骶骨、耻骨等情况限定骨髓的剂量,计算患者的骨髓受到10 Gy、20 Gy、30 Gy、40 Gy、50 Gy照射的体积。
1.4 观察指标 记录2组患者骨髓照射剂量、骨髓抑制发生情况,对结果进行对比、分析,得出两者相关性。对所有宫颈癌患者同步放化疗时发生急性血液不良反应的危险因素进行回归性分析,寻找急性血液不良反应的独立危险因素。
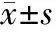
2 结 果
2.1 骨髓照射剂量比较 观察组患者平均骨髓照射剂量为(32.81±3.46)Gy,低于对照组的(40.65±3.97)Gy,差异有统计学意义(t=7.444,P=0.000)。
2.2 治疗后骨髓抑制发生情况比较 观察组骨髓抑制总发生率为32.00%,低于对照组的60.00%,差异有统计学意义(χ2=3.945,P=0.048)。见表1。

表1 2组患者骨髓抑制发生情况比较 [例(%)]
2.3 宫颈癌患者同步放化疗时发生急性血液不良反应危险因素回归性分析 年龄、肿瘤部位、病理类型、同步放化疗照射面积均是宫颈癌患者同步放化疗时发生急性血液不良反应的独立危险因素。见表2。

表2 宫颈癌患者同步放化疗时发生急性血液不良反应 危险因素回归性分析
3 讨 论
同步放化疗是治疗宫颈癌的主要手段之一,可延长患者的生存时间,提高其生活质量。但在治疗同时也会发生腹泻、腹痛、急性血液不良反应等,影响患者的耐受性,从而降低治疗的效果[5]。急性血液不良反应是放化疗不良反应中较严重的一种,主要由于骨髓抑制诱发,患者可表现出多种症状,对放化疗方案的进行有所限制,甚至诱发感染、出血等其他严重的问题,造成放化疗方案的中断;而且在同步放化疗时,这种不良反应会大幅度增加,甚至造成放化疗的治疗周期延迟达1年以上,患者错失了救治的最佳时期,病情容易复发或出现远处转移。因此,临床对宫颈癌患者进行同步放化疗时,应在保证疗效的基础上,尽量减少患者的不良反应,维持放化疗方案的顺利进行。冯静等[6]研究发现,宫颈癌患者术后盆腔调强放疗后的骨髓抑制程度与骨髓照射的体积、照射的剂量具有相关性,而且照射后患者的白细胞计数、中性粒细胞减少的程度与骨髓照射的剂量、照射的体积呈正相关,因此,在对宫颈癌患者进行同步放化疗时应限制照射的剂量,以保护骨髓,避免发生急性血液不良反应。近年来的研究显示,宫颈癌同步化疗的血液毒性单因素分析中,V40、V50均与血液毒性的发生有关[7];也确定了以V40较高的剂量作为急性血液不良反应的预测值,但对具体的急性血液不良反应照射剂量的限量仍无明确的标准;还有部分研究建议将V10作为骨髓移植的预测。
骨髓虽然不是淋巴组织,但对血液主要成分的再生具有重要的作用,人体绝大多数造血干细胞分布在此,造血干细胞能通过一系列生理作用分化为血细胞和淋巴细胞,是免疫细胞的发源地、抗体产生的主要部位,在人体免疫系统中占有重要的地位[8]。因此,同步放化疗时进行骨盆骨髓保护,对人体的免疫功能具有重要意义。在同步放化疗时进行骨盆骨髓保护主要通过精确的定位、计划和照射,使放射线尽量集中到肿瘤的内部,减少或避免周围的正常组织、器官受到不必要的照射,从而提高了病灶内部的照射剂量,减少了对正常组织的损害,更好地控制肿瘤的复发、降低并发症的发生[9]。因此,在盆腔的放疗中可利用调强放疗的技术进行优化,限制骨盆骨髓接受照射的剂量、体积以进行骨盆骨髓保护,可以减少骨髓抑制的发生[10]。有研究证明,骨盆骨髓保护不但可以达到不加限制的同步放化疗的覆盖率,而且病灶区域内放射线的剂量无明显降低,也未增加危险器官的照射体积。
本研究结果显示,观察组平均骨髓照射剂量、急性血液不良反应发生率均低于对照组,提示在接受同步放化疗时进行骨盆骨髓保护和急性血液不良反应的发生率呈正相关;其原因可能是由于患者单位体积的骨髓受到照射的剂量较小,从而发生急性血液不良反应的几率较低。而在对急性血液不良反应危险因素回归性分析中发现,年龄、肿瘤部位、病理类型、同步放化疗照射面积等都是宫颈癌患者同步放化疗时发生急性血液不良反应的独立危险因素,这一回归性研究也证实了上述研究的结果。在同步放化疗时采取骨盆骨髓保护是目前治疗宫颈癌较先进的放射治疗技术,治疗前通过精确定位,并进行勾画,制定准确的治疗方案,并严格按照治疗方案要求的部位、剂量进行照射,最大限度将放射线集中于肿瘤的内部,提高了肿瘤内部的放射剂量,不但可以更好地杀灭肿瘤细胞,还可降低周围的正常组织、器官受到照射的剂量,减少对正常组织的损伤,从而减少不良反应的发生,保障放化疗方案的顺利进行,延长患者的存活周期,提高其生活质量[11]。
综上所述,宫颈癌患者接受同步放化疗时实施骨盆骨髓保护与急性血液不良反应的发生率呈正相关,减低骨髓照射的剂量可降低急性血液不良反应发生率,有利于治疗的顺利进行。

