shRNA靶向干扰UL27、UL54基因对HSV-2复制的影响
潘晓瑜,吕延成,宋其芳,韩晋辉,朱俊访
(1.广东食品药品职业学院,广州 512000;2.遵义医科大学 珠海校区,珠海 519041;3.暨南大学 生命科学技术学院,广州 512000)
单纯疱疹病毒-2型(HSV-2)是导致生殖器疱疹(Genital herpes, GH)的主要病因,GH反复发作,目前难以根治,且增加HIV感染的风险[1-2],治疗GH的主要手段是核苷类抗病毒药物,但这类药物难以清除潜伏感染的HSV-2。RNA干扰研究现已广泛应用于病毒领域[3-6]。HSV-2基因组约为155 kb,编码80多种蛋白,其中HSV-2UL27和UL54基因一直都是HSV-2研究的热点,UL27基因表达是黏附性糖蛋白(glycoprotein B, gB),是HSV-2识别和吸附受体而感染细胞的重要组分[7]。UL54基因编码的ICP27蛋白主要抑制宿主细胞蛋白合成,抑制病毒DNA合成及其晚期基因的表达[8-9]。根据前期研究筛选HSV-2UL27基因和UL54基因的shRNA重组质粒表达载体[10-11],本研究在细胞水平上进行联合干扰HSV-2复制,为HSV-2的多基因治疗提供线索。
1 材料与方法
1.1 材料
HEK293细胞由暨南大学抗体研究中心馈赠。Lipofectamine 2000试剂为美国Invitrogen公司产品。HSV-2 gB蛋白单克隆抗体、HSV-2 ICP27蛋白单克隆抗体分别为美国Santa cruz 公司和美国Abcam公司产品。
1.2 方法
1.2.1 HSV-2UL27和UL54基因干扰靶位的选择
在前期试验中已成功构建表达UL27和UL54序列特异性siRNA的质粒载体且发现与阴性对照shRNA比较,UL27shRNA75、UL27shRNA 2265、UL54shRNA1081、UL54shRNA 1407干扰效率较高[10-11],shRNA具体靶位序列见表1。
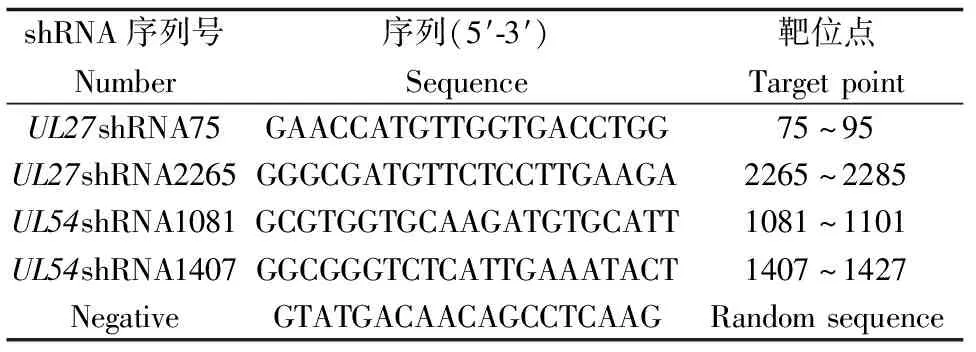
表1 针对HSV-2 UL27、UL54基因的shRNA序列
1.2.2 pGPU6/GFP/Neo-shRNA表达载体转染HEK293细胞
UL27和UL54基因的重组表达载体shRNA单干扰组UL27shRNA75、UL27shRNA2265、UL54shRNA1081和UL54shRNA1407,联合干扰组UL27shRNA75+UL54 shRNA1081、UL27shRNA2265+UL54shRNA1081、UL27shRNA2265+UL54shRNA1407和UL27shRNA75+UL54shRNA1407,分别转染HEK293细胞,每组设3个复孔。转染操作参考文献[12],流式细胞仪检测转染效率。
1.2.3 HSV-2感染HEK293细胞
各试验组转染重组表达载体shRNA 48 h后,接种HSV-2,每隔12 h,观察细胞病变情况,48 h后检测病毒滴度。
1.2.4 实时荧光定量PCR检测UL27和UL54基因mRNA表达
收集各实验组细胞,提取总RNA,根据荧光定量PCR试剂盒(日本TOYOBO公司)说明书进行具体操作。各基因的引物序列如下:内参GAPDH上游引物:5′-AGAAGGCTGGGGCTCATTTG-3′,下游引物:5′-AGGGGCCATCCACAGTCTTC-3′;UL27上游引物:5′-CAAAGACGTGACCGTGTCGCAG-3′,下游引物:5′-GCGGTGGTCTCCATGTTGTTCC-3′;UL54上游引物:5′-CCAGGACCCTATCATCGGAACG-3′,下游引物:5′-AGTATTTCAATGAGACCCGCCAT-3′;反应条件:95 ℃ 预变性5 min; 95 ℃ 变性20 s, 62 ℃ 退火30 s,70 ℃延伸30 s,共40个循环。采用2-△△Ct法计算UL27基因和UL54基因mRNA相对表达量。
1.2.5 Western印迹检测gB蛋白和ICP27蛋白表达
从收集各试验组的细胞中提取总蛋白,测定蛋白浓度,SDS-PAGE电泳后转PVDF膜,体积分数为5%的BSA封闭,分别加入gB单克隆抗体(1∶500)、ICP27单克隆抗体(1∶400)4 ℃过夜,羊抗鼠二抗(1∶3 000)37 ℃孵育2 h,最后化学发光,显影定影。Western Blot条带采用Image J软件进行分析。
1.2.6 HSV-2病毒滴度的测定与MTT法检测细胞存活率
在25 cm2细胞培养瓶中培养HEK293细胞,当单层细胞丰度>80%时,接种2 mL HSV-2病毒悬液至单层HEK293细胞,37 ℃、5%CO2培养箱中培养吸附1~2 h。当细胞病变超过90%时,采用反复冻融法收集病毒检测其子代病毒滴度,按Reed-Muench法[13]计算,能引起50%细胞发生病变的病毒液最高稀释度(50% tissue culture infective dose, TCID50),即病毒滴度。各试验组细胞转染质粒表达载体48 h后收集病毒悬液,检测各试验组的子代病毒悬液的TCID50。
使用 96孔培养板接种0.5~1×104/mL细胞悬液。转染质粒表达载体后接种病毒,37 ℃、5% CO2培养箱中培养48 h后弃上清液,每孔加MTT溶液(5 mg/mL)10 μL,孵育4 h,弃上清液。加入 DMSO,492 nm波长处检测吸光度A值。
1.3 统计学处理
2 结果与分析
2.1 细胞转染效率检测
流式细胞仪检测质粒pGPU6/GFP/Neo-shRNA与转染试剂lipofetamine2000复合物转染HEK293细胞后,绿色荧光蛋白阳性细胞占总细胞的80%,转染效率(%)=荧光细胞数量/细胞总数×100%,即转染效率为80%,证明转染成功(图1)。
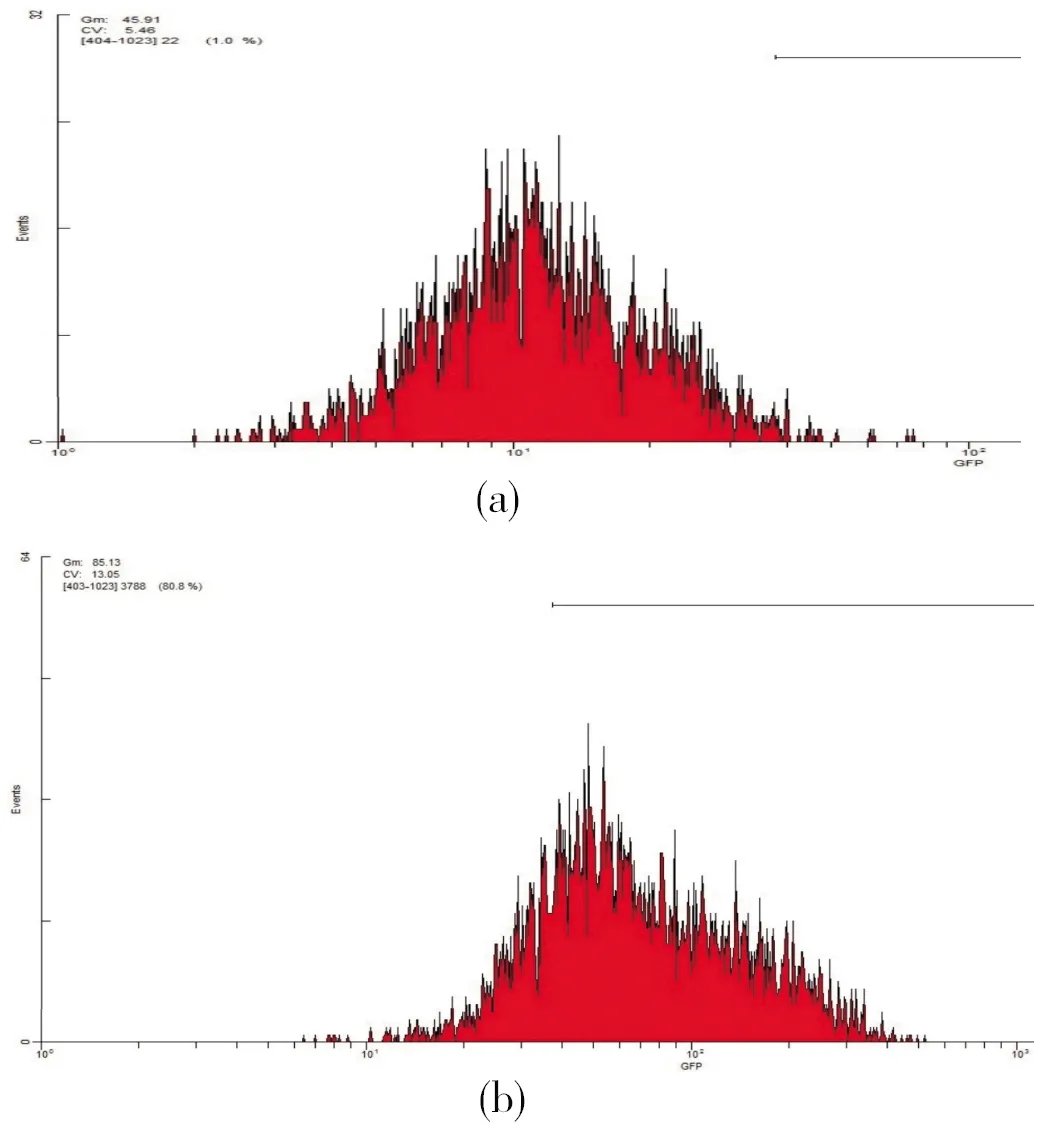
(a)正常HEK293细胞;(b)转染pGPU6/GFP/Neo-shRNA
2.2 实时荧光定量PCR检测UL27和UL54mRNA的表达
qRT-PCR法检测表明:与对照组比较,其中UL27 shRNA75+UL54shRNA1081联合干扰组mRNA表达抑制率最高(F=419.39,P<0.05);各联合干扰组分别与 UL27 shRNA75组比较,差异有统计学意义,LSD-t分别为8.13、9.42、17.65和2.07,均P<0.05;各联合干扰组再与UL54shRNA108组比较,差异有统计学意义,LSD-t分别为10.01、3.59、19.19和2.25,均P<0.05(表2)。
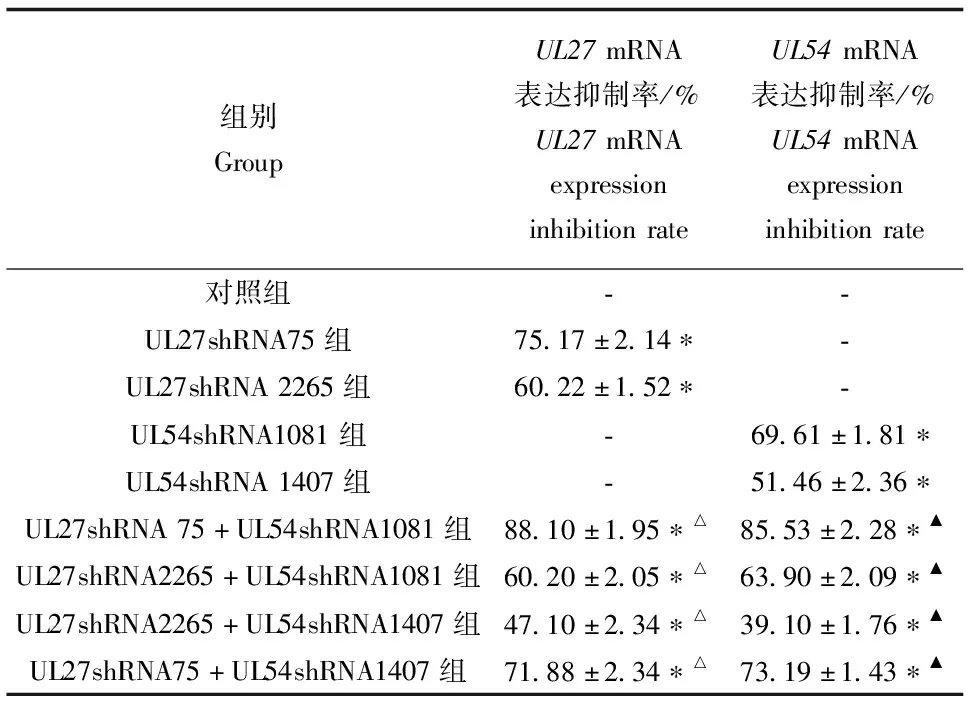
表2 shRNA重组质粒表达载体转染后UL27、UL54 mRNA表达情况
2.3 Western Blot 检测HSV-2UL27、UL54基因的蛋白表达变化情况
1)gB蛋白表达结果:和对照组比较,各试验组的gB蛋白表达水平差异均具有统计学意义(F=83.77,P<0.05)。联合干扰组与单干扰UL27shRNA75组比较, gB蛋白表达水平差异有统计学意义,LSD-t分别为8.74、3.01和3.39,均P<0.05。2)ICP27蛋白表达结果:与对照组相比,UL54shRNA1407组表达水平无明显差异(P>0.05),其他试验组的ICP27蛋白表达水平差异均具有统计学意义(F=46.20,P<0.05)。结果表明联合干扰组UL27shRNA75 +UL54 shRNA1081组的gB蛋白和ICP27蛋白表达下降最明显,具体见表3和图2。
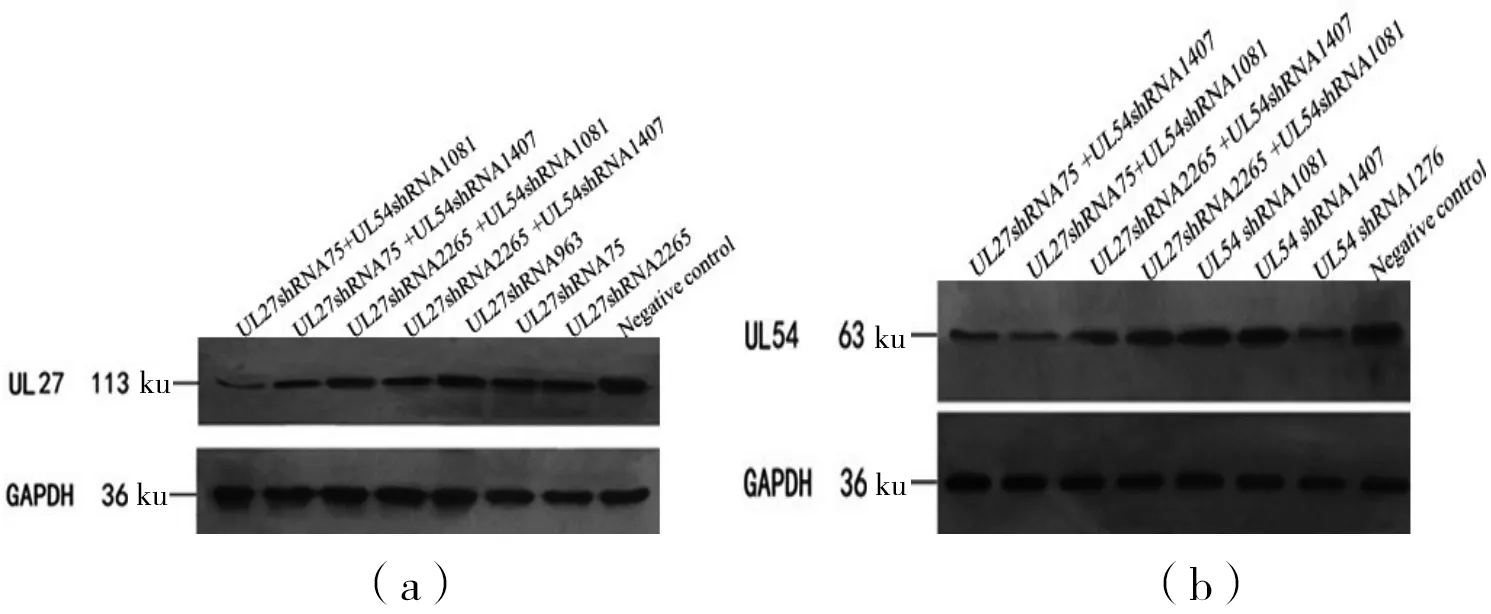
(a)gB蛋白表达;(b)ICP27蛋白表达
2.4 子代病毒滴度和细胞存活率的检测
结果发现,UL27 shRNA 75+UL54 shRNA1081组的子代病毒滴度降低最明显,细胞存活率提高(表3)。
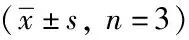
表3 各试验组转染后子代病毒滴度、细胞存活率、目的基因蛋白的表达检测
3 讨论与结论
大量研究表明RNA干扰已广泛应用于肿瘤和抗病毒的治疗[14-15],但病毒感染和复制是由其自身基因与宿主基因共同协同的结果,在病毒复制的各个阶段,至少有两个或以上功能不同的基因各自发挥不同作用,协同加强了病毒感染复制的能力。仅仅针对单个病毒基因的治疗方法并不能完全抑制病毒的感染复制,多基因和多手段的联合治疗是今后抗病毒治疗的主要研究方向。
HSV-2感染最常见的是引起生殖器溃疡的疾病,UL27基因编码的糖蛋白gB是一种对病毒-细胞融合至关重要的糖基化蛋白,通过其内部融合环直接插入细胞膜,将病毒包膜和宿主细胞膜稳定的吸附结合在一起,是病毒进入机体所必需的[16]。UL27基因表达的降低或缺失必定影响病毒的吸附和穿入细胞,可减弱HSV-2的感染性。UL54基因编码多肽ICP27能直接作用于病毒mRNA在感染细胞中的表达,同时还是HSV-2裂解性复制必需的高保守蛋白,还激活DE基因和L基因的表达[17]。本研究结果表明UL27 shRNA75+UL54 shRNA1081组联合靶向干扰效果优于各自的单个干扰。另外,从细胞的存活率、子代的病毒滴度和目的蛋白的表达也表明UL27 shRNA75 +UL54 shRNA1081组联合干扰比单干扰组更加有效地在HSV-2中发挥了基因沉默作用,对病毒的抑制最为明显,证实了UL27基因和UL54基因确实在HSV-2复制过程中有着重要的作用,干扰二者基因的表达,能影响HSV-2的复制,提示两个基因所选择的这两个靶位点之间可能具有相互协同效应,能够相互联合增强对单一基因的抑制。其机制可能是:在病毒感染初期,抑制gB蛋白的表达病毒就不能识别相应的受体并黏附在细胞膜上,降低了病毒的感染能力,同时还能减少病毒将遗传物质注入细胞。联合干扰ICP27影响它介导病毒从细胞核到细胞质的mRNAs输出能力,可进一步抑制病毒DNA的合成。另外,联合干扰UL27和UL54基因可调节子代病毒与感染细胞表面的相互作用[17],从而影响HSV-2病毒感染与复制,提示联合靶向特异性shRNA可能从不同途径阻止HSV-2感染和复制。
本研究结果显示联合UL27基因靶位点75和UL54基因靶位点1081的shRNA重组表达载体比单一基因干扰可以明显降低UL27基因和UL54基因的mRNA、蛋白表达和子代病毒滴度,提高HEK293细胞存活率。这是在细胞水平上进行的,还不能断定相应的shRNA在动物体内的效应,因此下一步将把shRNA载体用于动物模型,观察靶向UL27基因、UL54基因在动物体内是否能够抑制HSV-2的复制,从而为下一步的临床转化提供试验依据。

