藻菌共生体系的建立及其对造纸废水的处理效果
张 波, 陈佳琛, 崔梦瑶, 刘珂轶, 张安龙
(陕西科技大学环境科学与工程学院, 西安 710021)
微藻是一类在自然界中分布广泛的微生物,具有较强的适应性,因其可高效吸收氮磷营养及较高的化学需氧量(chemical oxygen demand,COD)去除率而被应用于废水处理。常见的用于废水处理的微藻种类主要有绿藻门的小球藻(Chlorella)[1-3]、栅藻(Scenedesmus)[4-6]、衣藻(Chlamydomonas)[6-7]和蓝藻门的螺旋藻(Spirulina)[8]、颤藻(Oscillatoria)[9]等。许多研究表明,微藻可用于各种废水的处理,如工业废水[4-5]、市政污水[10]、农业废水[1]等。利用废水培养微藻可在废水净化的同时积累微藻生物量,用于生物柴油、生物饲料等领域,大幅降低微藻的培养成本,进而实现废水的无害化处理与资源化利用。
制浆造纸工业是中国国民经济支柱性产业之一,给中国带来了巨大的经济收益,但造纸生产过程中产生的造纸废水给水生态环境带来了巨大的压力。造纸废水具有排放量大、各段废水成分复杂、处理难度大等特点。经过一级物化、二级生化处理后仍不能达到排放标准。近年来,芬顿高级氧化技术多被应用于造纸废水三级深度处理,然而其反应条件窄、药剂成本高、二次污染严重等问题限制其更广泛的应用[11-12]。相比之下,藻菌共培养体系用于造纸废水三级深度处理具有显著优势,其处理成本低、效果好且获得的微藻生物质可进一步加工制备高附加值产品,提高经济效益。利用藻菌共生体系处理废水技术具有巨大的经济效益和环境效益,是深度处理造纸废水的一种很有发展潜力的技术。
近年来,关于建立藻菌共生体系以提高微藻生物量、油脂产率和污水处理效率的研究已有一定的进展。卫治金等[13]在缺氮条件下将无菌小球藻与细菌以不同初始比例共培养,结果表明,在小球藻与固氮菌70∶1(V/V) 共培养体系中,其生物量和油脂含量分别较单独小球藻培养时提高了66.3%和47.7%。Bashan等[14]采用小球藻和巴西固氮螺菌(Azospirillum) 组成的藻菌共生体系用于处理城市污水,其氨氮、硝酸盐氮和磷的去除效率分别达到100%、15%和36%,显著高于纯藻系统的处理效果。Liang等[15]研究了地衣芽孢杆菌(Bacilluslicheniformis) 与普通小球藻(Chlorellavulgaris) 共培养去除污水中氨氮,当藻/菌细胞密度比为1∶1时,氨氮的去除率显著提高到78%,而在相同条件下,单藻系统中氨氮的去除率为63%。Zhou等[16]利用小球藻和曲霉菌获得的人工藻菌共生体进行废水处理,对氨氮、总氮、总磷和化学需氧量的去除率分别为100%、58.85%、89.83%、62.53%(浓缩液) 和23.23%、44.68%、84.70%、70.34%(稀释猪粪废水)。这些研究表明,藻菌共生体系可以有效提高微藻的生物量及油脂产量,同时将其应用于废水处理中具有良好的COD及氮磷去除效果,具有良好的应用前景。
综上,藻菌共生体系处理废水的可行性已得到广泛认可,但目前的研究大多是利用藻菌共生体系处理市政污水以及畜禽养殖业废水等,对于造纸废水处理的相关研究甚少;且已有研究大多是通过在微藻培养体系中外源添加某类功能细菌来实现共生体系的构建,而对于微藻生长过程自然形成的微生态体系中大量存在的细菌对微藻生长的影响研究并不系统。现将从棕鞭藻自养培养体系分离筛选出对微藻生长具有显著促进作用的微藻共栖细菌,通过确定最佳的藻菌投加比例以优化藻菌共生体系,并探究其对造纸废水的处理效果。以期为揭示微藻共栖细菌对藻细胞生长代谢的影响以及藻菌共生体系在造纸废水深度处理的应用提供重要参考。
1 材料与方法
1.1 废水来源与分析方法
实验所用造纸废水来源于陕西某造纸厂二沉池出水,经纱布过滤除去悬浮固体物后测定其水质。总氮和总磷浓度分别采用碱性过硫酸钾消解紫外分光光度法[17]与钼酸铵分光光度法[18]测定;COD采用连华科技5B-6C多参数水质测定仪测定;色度采用恩帆EFS-3D色度测定仪测定。造纸废水水质指标如表1所示。
1.2 微藻的来源与培养
棕鞭藻属(Ochromonassp. MN028526) 分离自陕西科技大学人工湖。利用BG11培养基[19]培养棕鞭藻,取BG11培养基100 mL并置于250 mL三角瓶中,接种藻株至棕鞭藻培养液OD540为0.2。将棕鞭藻培养液于光强3 000 lx、温度28 ℃、光周期L∶D=14 h∶10 h、摇床转速150 r/min的条件下培养至稳定期。
1.3 棕鞭藻共栖细菌分离、培养与鉴定
将培养至稳定期的棕鞭藻培养液用无菌水以1∶10的比例逐级稀释,取100 μL稀释至10-4~10-6的稀释液,涂布至LB培养基(蛋白胨 10 g/L、牛肉膏 5 g/L、氯化钠 10 g/L) 中,分离棕鞭藻的共栖细菌。将平板置于28 ℃培养箱中2~3 d,分离不同的菌落,多次划线培养直至获得单一、纯净的菌落。
利用LB液体培养基培养分离获得的共栖细菌,培养至稳定期后1 000g离心,获得菌株。利用细菌基因提取试剂盒(Ezup柱式细菌基因组DNA抽提试剂盒) 提取细菌DNA。利用已提取的基因组DNA为模板,采用细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCGA-3′) 和1492R(5′-GGTTACCTTGTTACGACTT-3′) 进行PCR扩增[20]。PCR反应体系(25 μL) 为Taq PCR Master Mix 12.5 μL,10 μmol/L的正反向引物各1 μL,DNA模板1 μL,加纯水补充至25 μL。PCR反应条件:94 ℃预变性3 min;94 ℃变性3 min,61 ℃退火1 min,72 ℃延伸1 min,29个循环;循环结束后72 ℃延伸5 min,最后12 ℃保存。PCR扩增产物经1.5%琼脂糖凝胶电泳后,经核酸染料染色后用凝胶成像系统进行验证,使用胶回收试剂盒对混合后的PCR产物进行切胶纯化,将纯化产物进行细菌宏基因组16S rDNA测序,测序区间为V3~V4可变区,测序平台为Illumina MiseqTM,委托生工生物工程有限公司完成。将测序获得的16S rRNA序列上传至NCBI网站,进行BLAST比对(http://www.ncbi.nlm.nih.gov),然后用MEGA7.0构建进化树。
1.4 构建棕鞭藻与细菌的共培养体系
将分离获得的细菌与微藻共培养,进一步研究细菌对微藻生物量积累的影响。将棕鞭藻与分离获得的细菌分别培养至对数期,8 000 r/min离心5 min后弃上清,按比例取适量加入到BG11培养基或废水中振荡培养。
1.5 棕鞭藻细胞叶绿素a含量的测定
取棕鞭藻藻液5 mL,10 000g离心5 min,弃上清;并将微藻细胞悬浮于5 mL 90%的甲醇溶液,75 ℃水浴5 min后,10 000g离心10 min。将上清液取出,以90%甲醇为对照,检测相应吸光度D(λ)(λ为波长),再计算样品中叶绿素a的浓度(CChla)[21],计算公式为
CChla=16.82D(665)-9.28D(652)
2 结果与分析
2.1 棕鞭藻共栖细菌的分离
经平板多次划线筛选出5株细菌,编号为A~E(表2)。A、B、E三株细菌菌落为球形,表面光滑,边缘整齐,菌落颜色分别为橙红色、白色、乳白色;C菌落呈现扁平状,表面粗糙,边缘褶皱,为淡黄色;D菌落呈球形,表面光滑,边缘整齐,乳白色。

表2 不同菌群形态Table 2 Morphology of different bacterial
2.2 棕鞭藻共栖细菌的鉴定
经平板多次划线筛选出5株细菌,将5株共栖细菌16S rDNA序列在NCBI数据库中进行Blast对比,5株共栖细菌分别与卟啉杆菌属(Porphyrobactersp.)、生丝单胞菌属(Hyphomonassp.)、水单胞菌属(Aquimonassp.)、农杆菌属(Agrobacteriumsp.),噬氢菌属(Hydrogenophagasp.) 高度相似,进一步构建系统发育树(图1)。

图1 棕鞭藻伴生细菌系统发育树Fig.1 Phylogenetic trees of associated bacteria of Ochromonas
2.3 共栖细菌对微藻生长的影响
将培养到对数生长期的棕鞭藻与5株共栖菌分别以1∶1比例接种至BG11培养基,共培养10 d,监测每天微藻叶绿素a浓度(图2)。结果表明,在前4 d,除菌株D农杆菌对微藻生长有抑制外,其他4组长势基本相同;5 d后水单胞菌对微藻的生长开始出现明显的促进作用,其他3株菌仍无较大影响。在5株共栖菌中,菌株C水单胞菌属促微藻生长效果明显,微藻叶绿素a含量在第10 d达到5.236 mg/L,比对照组叶绿素a含量增加了43.57%,此时微藻干重达到0.513 g/L。菌株D农杆菌属对棕鞭藻的生长有抑制作用,菌株A、B、E对棕鞭藻的生长效应作用不明显。据此,筛选出促进微藻生长的优势促生菌株C菌种,即水单胞菌,用于棕鞭藻藻菌共生体系的构建。
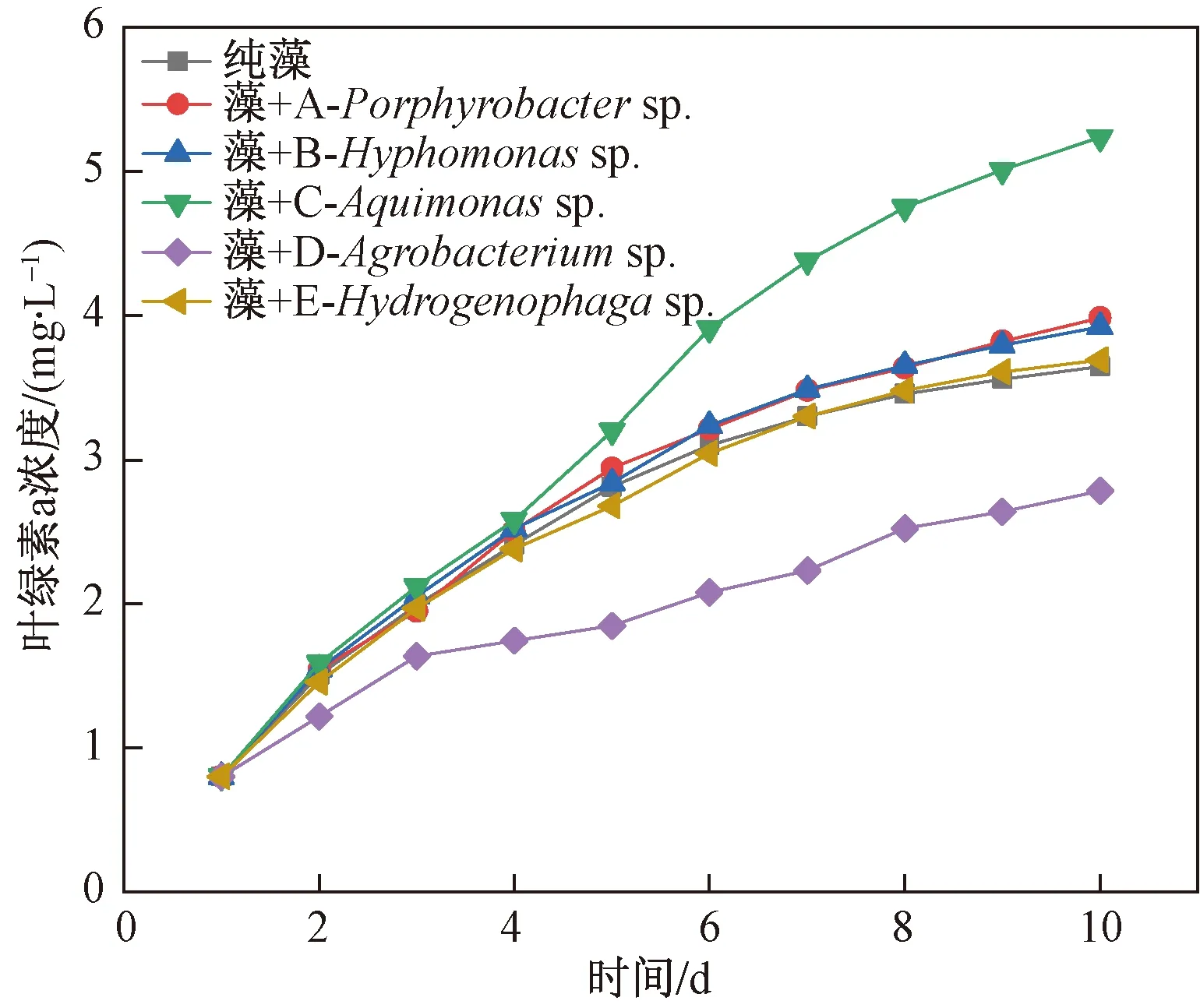
图2 5株伴生菌对棕鞭藻生长的影响Fig.2 Effect of five bacteria on the growth of Ochromonas
2.4 棕鞭藻与水单胞菌共生体系的建立
建立棕鞭藻与水单胞菌共生体系,将藻菌以不同比例(10∶1、2∶1、1∶1、1∶3、1∶5) 配比接种至BG11培养基,共培养10 d,监测其每日的叶绿素a变化情况。结果如图3所示,可知叶绿素a含量总体出现先增高后逐渐平稳的趋势;与对照组相比可以看出,在这5种比例只要加入水单胞菌,就会对微藻的生长产生促进作用,且随着藻菌比的减小促进作用出现先增高后降低的趋势。当藻菌比为1∶3时,叶绿素a含量增长最快,说明在这个比例下细菌对微藻的促进作用最高;在第10 d时,叶绿素a含量达到7.975 mg/L,高出对照组叶绿素a含量112.23%,此时微藻产量干重为0.78 g/L。据此,选用棕鞭藻与水单胞菌以1∶3建立藻菌共生体系用于对造纸废水处理的研究。
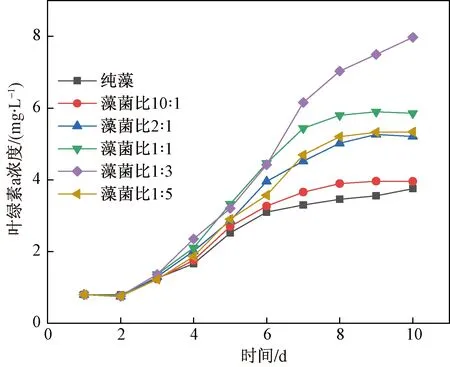
图3 藻菌比对棕鞭藻叶绿素a含量的影响Fig.3 Effect of the ratio of algae to bacteria on the content of chlorophyll a in Ochromonas
2.5 造纸废水对微藻生长的影响
将造纸废水用不同比例纯水稀释(分别为原水、稀释2倍废水和稀释5倍废水),灭菌后接入微藻培养物或藻菌共生培养物,培养8 d测其每日叶绿素a浓度。由图4(a) 可知,微藻叶绿素a总体变化趋势相似,在稀释2倍废水培养的藻菌共生体系中叶绿素a含量始终保持最佳,在培养第8 d时,叶绿素a含量高达10.952 mg/L,此时体系中微藻干重为1.073 g/L。从图4(b) 中可以看出,相较于其他稀释倍数,当造纸废水稀释2倍时,纯藻和藻菌共生体系中的微藻的生物量积累均处于更高的水平。与未经稀释的废水体系相比,纯藻和藻菌共生体系中微藻的叶绿素含量在第8 d分别高出36%和34.33%。结果说明稀释2倍的造纸废水中氮磷等营养条件更适宜微藻的生长,在该稀释度下废水中总氮、总磷浓度大约为11.21 mg/L和2.45 mg/L。需要特别指出的是,除纯藻和藻菌共生体系在稀释5倍废水比生长速率基本相等外,其余两组微藻在藻菌共生体系生长比纯藻系统好,说明藻菌之间形成了良好的共生作用,此时细菌给棕鞭藻提供CO2进行光合作用,同时细菌吸收棕鞭藻产生O2及其他有机物。
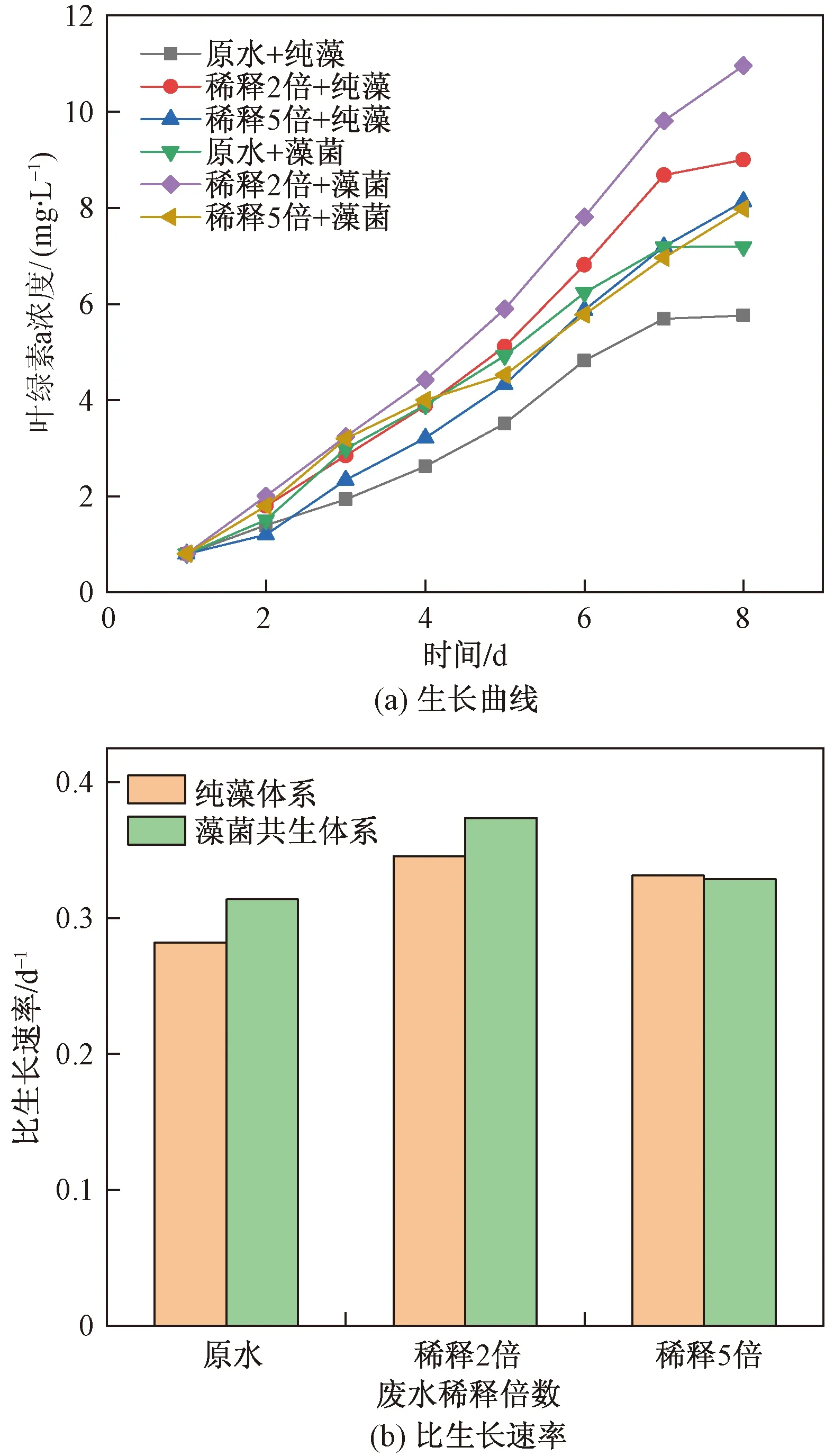
图4 不同废水稀释度下藻菌生长情况Fig.4 Growth of algae and bacteria under different dilution of wastewater
2.6 藻菌共生体系处理造纸废水的效果
为对比纯藻、藻菌共生和纯菌体系对造纸废水的处理效果,将造纸废水用纯水稀释2倍,灭菌后分别接入微藻培养物、藻菌共培养物和细菌培养物,培养8 d后计算体系内COD、总氮量(total nitrogen,TN)、总磷量(total phosphorus,TP)及色度的去除效率。由图5可知,藻菌共生体系对造纸废水COD、TN、TP和色度的去除能力都显著优于纯藻和纯菌体系。藻菌共生体系对废水COD的去除率达到75.67%,较纯藻体系(去除率为63.13%) 和纯菌体系(去除率为59%) 提高了近1.3倍;相较于前期课题组使用的芬顿法,去除造纸废水COD效果相当[22],使用藻菌共生体系处理造纸废水可大幅降低处理成本和提高环境效益,且微藻可用于后续生物柴油的开发利用,实现良好的经济价值。
对于TN的去除,相较于纯藻体系(去除率为22.24%) 和纯菌体系(去除率为28.53%),藻菌共生体系中TN去除率可达到35.19%;纯菌对TN的去除效率较纯藻高,说明废水体系中细菌对N源的吸收利用是影响藻菌共生体系处理总氮效率的关键因素之一。
图5显示单独的细菌处理TP的去除率为30.96%,纯藻体系和藻菌共生体系处理可使得TP去除率升高至75.21%和90.2%。这一结果可能是由于微藻不但可以直接吸收和利用无机盐,还可以提高水中溶解氧浓度,促进细菌的生长,从而加强有机质分解,降低水中氮磷含量。因此,藻菌协同作用可以显著促进棕鞭藻对废水中氮磷等的吸收。由图5(b)可看出,藻菌共生体系对造纸废水色度的去除能力显著,处理8 d后,去除率高达93.45%。
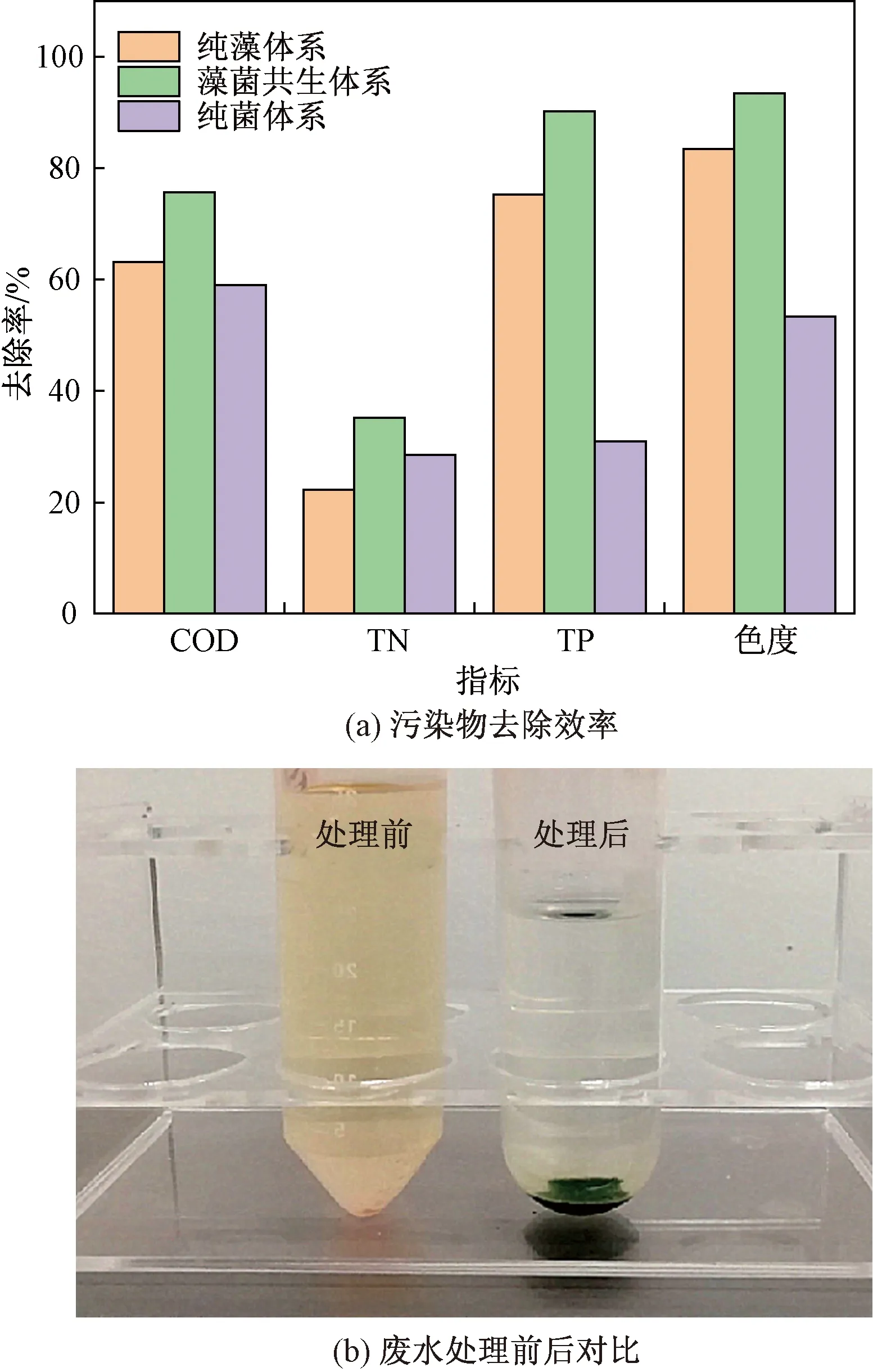
图5 不同体系对造纸废水中COD、TN、TP色度去除效果Fig.5 Removal effect of different systems on COD, TN, TP and chroma in papermaking wastewater
3 结论
(1)分离纯化获得棕鞭藻(Ochromonassp. MN028526) 5株伴生细菌,经16S rDNA基因测序,5株菌株分别为Porphyrobactersp.(卟啉杆菌属)、Hyphomonassp.(生丝单胞菌属)、Aquimonassp.(水单胞菌属)、Agrobacteriumsp.(农杆菌属) 和Hydrogenophagasp.(噬氢菌属)。
(2)水单胞菌(Aquimonassp.) 能明显促进微藻叶绿素a含量的增长,对微藻生物量积累促进率可达43.57%。农杆菌属(Agrobacteriumsp.) 对棕鞭藻的生长有抑制作用,卟啉杆菌(Porphyrobactersp.)、生丝单胞菌(Hyphomonassp.)、噬氢菌(Hydrogenophagasp.) 对棕鞭藻无显著影响。且当棕鞭藻与水单胞菌的初始接种比例为1∶3时,细菌对微藻的促进作用最佳,微藻干重最高可达0.78 g/L。
(3)水单胞菌与棕鞭藻藻菌共生体系对造纸废水中COD、TN、TP及色度的去除效果显著优于纯藻和纯菌处理体系,去除率最高分别达75.67%、35.19%、90.2%和93.45%。

