PI3K/Akt信号通路对脐血间充质干细胞减轻缺血性脑损伤和炎症反应的调节作用
陈 慧 郑晓梅 夏 晓 孙玉锦 徐 静
(西南医科大学附属医院神经内科,泸州 646000)
脑血管疾病的致死率与致残率在所有疾病中位居第二,且发病率逐年上升,有可能成为导致死亡的首要疾病,其致死率与致残率在我国位居第一[1-3]。在所有脑血管疾病中,缺血性脑卒中的发病率位居第一,具有起病急、难预测、致死率与致残率高的特点,缺血性脑卒中的预防与治疗一直是临床研究重点。目前FDA批准的缺血性脑卒中治疗方式为静脉注射重组组织纤溶酶原激活物,但多数患者并未获益[4-5]。除短期的溶栓治疗窗外,目前仍无证据表明该干预可有效促进神经元功能恢复。
干细胞疗法是治疗脑卒中的潜在策略,相关研究已证明干细胞移植治疗可改善缺血性脑卒中患者的疗效,但目前对干细胞移植修复缺血性脑卒中的作用机制仍不明确[6-7]。脐血间充质干细胞(umbilical cord blood-derived mesenchymal stem cells,UCBMSCs)具有获取无痛、免疫耐受高、无伦理争议等特点,成为细胞移植治疗的较好选择。研究证明PI3K/Akt信号通路与缺血性脑卒中关系密切,但UCBMSCs对缺血性脑卒中的神经保护作用是否与该通路相关尚未明确。本研究观察人UCBMSCs对大鼠缺血性脑损伤的保护作用,分析UCBMSCs对缺血性脑损伤患者PI3K/Akt信号通路的影响,探讨其可能的作用机制。
1 材料与方法
1.1材料
1.1.1脐血 由我院妇产科提供,来自健康足月婴儿,孕产妇血常规与感染免疫9项检查均正常,产妇及其家属知情同意。无菌条件下共采集脐血10份,每份80 ml,加入25 U/ml肝素抗凝。
1.1.2实验动物 成年雄性SD大鼠70只,体重(260±25)g,饲养于25℃、光12 h/暗12 h环境中,自由饮食。
1.1.3主要试剂与仪器 Akt1/2/3抗体抑制剂GSK2141795(EYK-CAS0019337,厦门研科生物技术有限公司);DMEM-LG培养液(129075-73-6,上海鼓臣生物技术有限公司);胎牛血清(深圳市浩克生物技术有限公司);流式细胞仪(BriCyte E6,深圳迈瑞生物医疗电子股份有限公司);CD105-APC抗体(MHCD10505)、CD90-APC抗体(A15726)和CD30-APC抗体(A15715,Invitrogen);AKT1/2/3抗体(AP20658c,百奇生物科技(苏州)有限公司);Western blot检测试剂盒(xyW001,上海信裕生物科技有限公司);ELISA检测试剂盒(YOYOBIO,上海研谨生物科技有限公司);Bcl-2抗体(ab692)、Bax抗体(ab32503,Abcam);TUNEL细胞凋亡原位检测试剂盒(SNM537-OSJ,北京百奥莱博科技有限公司) 。
1.2方法
1.2.1UCBMSCs提取、培养 取新生儿脐血,以1∶1.5比例加入D-Hank′s 缓冲液稀释,移液器吹打均匀;25℃下2 000 r/min离心15 min,吸取界面细胞层;D-Hank′s 缓冲液清洗1次,25℃下1 500 r/min离心8 min,弃上清,取细胞沉淀,加入含5%胎牛血清、2 mol/L L-谷氨酰胺与100 U/ml青-链霉素的DMEM-LG培养液重悬细胞,调整细胞浓度为4×107个/ml,置于37℃、5%CO2培养,根据细胞生长情况更换培养液,去除未贴壁细胞。细胞生长至80%融合时按1∶2 比例进行传代培养,每4 d半量换液1次,显微镜观察细胞生长形态。将第3代UCBMSCs以鼠抗人细胞系特异性抗体MAB1281标记,进行移植实验[8]。
1.2.2UCBMSCs鉴定 取第3代UCBMSCs,胰酶消化,以PBS调整细胞浓度为1×106个/ml,流式细胞术检测CD105、CD90和CD30表面标记物表达,诱导UCBMSCs向成骨细胞与脂肪细胞分化[9]。
1.2.3构建脑损伤模型 取SD大鼠称体重,腹腔注射3.6%水合氯醛10 ml/kg麻醉,固定于手术台,常规消毒、铺巾,在颈部正中皮肤做4 cm左右切口,假手术组分离右侧颈总、颈内与颈外后直接缝合切口;脑损伤组制作大脑中动脉缺血模型,于右侧颈总动脉基底部结扎血管,并用动脉瘤夹夹闭右侧颈总动脉,在右侧颈内动脉根部剪1个斜形小口,向内缓缓插入线栓,当插入线栓到达预定深度时打开动脉瘤夹,继续插入出现阻滞感时迅速结扎颈内动脉,45 min 后拔除线栓,逐层关闭切口、缝合皮肤。以Z-Longa神经功能评分1~3分为造模成功[10]。
1.2.4人UCBMSCs的脑保护作用检测 将30只大鼠随机分为假手术组、脑损伤组、UCBMSCs组,每组10只。缺血性脑损伤造模成功后24 h,脑损伤组于左侧股静脉注射1 ml生理盐水,UCBMSCs组左侧股静脉注射等体积UCBMSCs生理盐水溶液,细胞浓度为3×106个/ml。术后1、3、7、14 d采用改良神经功能缺损评分评估大鼠神经功能恢复情况,包括评估运动能力、感觉能力、平衡能力与异常活动能力,总分18分,评分越高说明神经功能缺损越严重。术后1、3、7、14 d尾静脉取血1 ml、8℃、1 000 r/min离心15 min,取上清,ELISA检测试剂盒检测IL-6、TGF-β水平。
1.2.5尼氏染色 术后14 d断头取脑海马组织,40 g/L多聚甲醛固定24 h,制备石蜡切片(25 μm),脱蜡入水,甲基紫染色15 min,蒸馏水冲洗3次,梯度乙醇脱水,Nissl Differentiation染色液分化8 s,乙醇脱水,二甲苯透明,中性树脂封固,显微镜下观察。
1.2.6免疫荧光染色 术后14 d取UCBMSCs组海马组织,制作冰冻切片,加入抗MAB1281抗体(1∶125)与NeuN抗体(1∶50)混合抗体,4℃孵育24 h 后加入FITC标记的羊抗兔IgG(1∶100)与PE标记的羊抗鼠IgG(1∶100)混合抗体孵育,DAPI复染,甘油封固后荧光显微镜下观察。
1.2.7UCBMSCs对PI3K/Akt信号通路的影响 将40只大鼠随机分为假手术组、脑损伤组、UCBMSCs组与抑制剂组,每组10只。缺血性脑损伤造模成功后24 h,模型组于左侧股静脉注射1 ml生理盐水,UCBMSCs组左侧股静脉注射等体积UCBMSCs生理盐水,细胞浓度为3×106个/ml;抑制剂组左侧股静脉注射0.1 ml Akt1/2/3抗体抑制剂GSK2141795与1 ml UCBMSCs生理盐水,细胞浓度为3×106个/ml。术后14 d处死大鼠。
1.2.8Tunel法检测细胞凋亡 取大鼠部分脑组织制作2 mm切片,取切片缺血区脑组织10%甲醛固定,制作石蜡切片,常规脱蜡,滴加4%H2O2后25℃保存10 min,蒸馏水冲洗3次,加入蛋白酶36℃消化15 min,PBS清洗,36℃下加标记缓冲液120 min,封闭液封闭、稀释,DAB显色,蒸馏水冲洗,脱水、透明、封固,镜下观察。
1.2.9Western blot检测相关蛋白表达 取大鼠脑海马组织50 mg提取总蛋白,Western blot检测Bax、Bcl-2凋亡蛋白、IL-6、TGF-β1炎症因子蛋白、Akt、p-Akt蛋白表达,严格按照试剂盒说明书操作。BCA法检测蛋白浓度,行10%SDS-PAGE 凝胶电泳,加样量为50 μg,转膜,加入稀释的一抗4℃孵育24 h,加入二抗室温孵育1 h,DAB显色,曝光、显影。

2 结果
2.1UCBMSCs鉴定 接种72 h后出现细胞贴壁,细胞形态多呈梭形,接种7 d后可见逐渐增多的梭形细胞(图1A、B);第3代UCBMSCs呈典型的旋涡状排列,单个细胞呈纺锤形(图1C),其高表达CD105、CD90表面标记物,低表达CD30表面标记物(图2)。油红O染色显示UCBMSCs可分化为脂肪细胞(图3A),可见大小不等的红色脂滴,茜素红染色显示UCBMSCs可分化为成骨细胞(图3B),可见大小不规则的红色矿化结节。
2.2UCBMSCs促进神经功能恢复 假手术组大鼠神经功能正常,不同时段的神经功能缺损评分为0分。UCBMSCs组与损伤组术后1 d的神经功能缺损评分差异无统计学意义,UCBMSCs组术后3、7、14 d的神经功能缺损评分明显低于损伤组(P<0.05),见表1。

图1 UCBMSCs的细胞形态特征(×100)Fig.1 Morphological characteristics of UCBMSCs(×100)
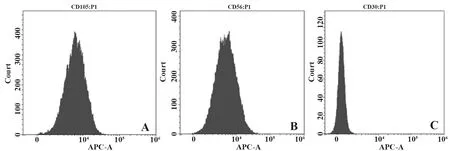
图2 第3代UCBMSCs的表面标记物表达Fig.2 Expression of surface markers in generation 3 UC-BMSCs

图3 UCBMSCs的成脂与成骨诱导分化(×100)Fig.3 Adipogenic and osteogenic differentiation of UCB-MSCs(×100)

表1 各组大鼠术后不同时段神经功能缺损评分
2.3UCBMSCs改善炎症因子分泌 术后1、3、7、14 d,损伤组IL-6水平均高于假手术组(P<0.05),TGF-β1水平低于假手术组(P<0.05);术后3、7、14 d, UCBMSCs组IL-6水平低于损伤组(P<0.05),TGF-β1水平高于损伤组(P<0.05),见表2。
2.4UCBMSCs的神经保护作用 假手术组海马区锥体细胞排列规则紧密,细胞结构完整,胞浆内可见丰富的尼氏小体;损伤组海马区锥体细胞缺失,排列混乱,细胞轮廓不清晰,胞浆内尼氏小体缩小;与损伤组相比,UCBMSCs组海马区椎体细胞明显增加,排列规则有序,细胞轮廓较清晰,胞浆内尼氏小体变大,见图4。
2.5移植UCBMSCs的存活与分化 术后14 d,在大鼠脑海马组织内可见MAB1281标记的阳性细胞,同时也可见NeuN标记的阳性细胞,两者有重叠,说明移植的UCBMSCs在海马区存活,并部分分化为神经样细胞,见图5。DAPI 染色的为脑组织内的神经元细胞,MAB1281标记的为移植的UCBMSCs,NeuN标记的阳性细胞为移植干细胞分化的神经元样细胞。
2.6UCBMSCs调节p-Akt蛋白表达 4组Akt蛋白表达差异无统计学意义。损伤组p-Akt蛋白表达高于假手术组(P<0.05),UCBMSCs组、抑制剂组p-Akt蛋白表达高于损伤组(P<0.05),UCBMSCs组p-Akt蛋白表达高于抑制剂组(P<0.05),见图6。
2.7UCBMSCs通过PI3K/Akt信号通路抑制神经元细胞凋亡 Tunel染色可见假手术组仅有少量凋亡神经元细胞,凋亡率为(6.19±1.23)%;与假手术组相比,损伤组可见大量凋亡神经元细胞,凋亡率为(56.79±3.41)%;UCBMSCs组也可见较多凋亡的神经元细胞,但数量明显少于损伤组,凋亡率为(26.38±2.17)%;抑制剂组凋亡神经元细胞数量介于损伤组与UCBMSCs组之间,细胞凋亡率为(40.13±2.97)%,4组神经元细胞凋亡率差异有统计学意义(P<0.05),见图7。
2.8UCBMSCs通过PI3K/Akt信号通路调节凋亡蛋白、炎症因子蛋白表达 与假手术组相比,损伤组Bax蛋白表达升高(P<0.05),Bcl-2蛋白表达下降(P<0.05);与损伤组相比,UCBMSCs组、抑制剂组Bax蛋白表达降低(P<0.05),Bcl-2蛋白表达升高(P<0.05);UCBMSCs组与抑制剂组Bax蛋白、Bcl-2蛋白表达差异有统计学意义(P<0.05)。与假手术组相比,损伤组IL-6蛋白表达升高(P<0.05),TGF-β1蛋白表达降低(P<0.05);与损伤组相比,UCBMSCs组、抑制剂组IL-6蛋白表达降低(P<0.05),TGF-β1蛋白表达升高(P<0.05);UCBMSCs组与抑制剂组IL-6蛋白、TGF-β1蛋白表达差异有统计学意义(P<0.05),见图8。
表2 各组大鼠血清炎症因子浓度
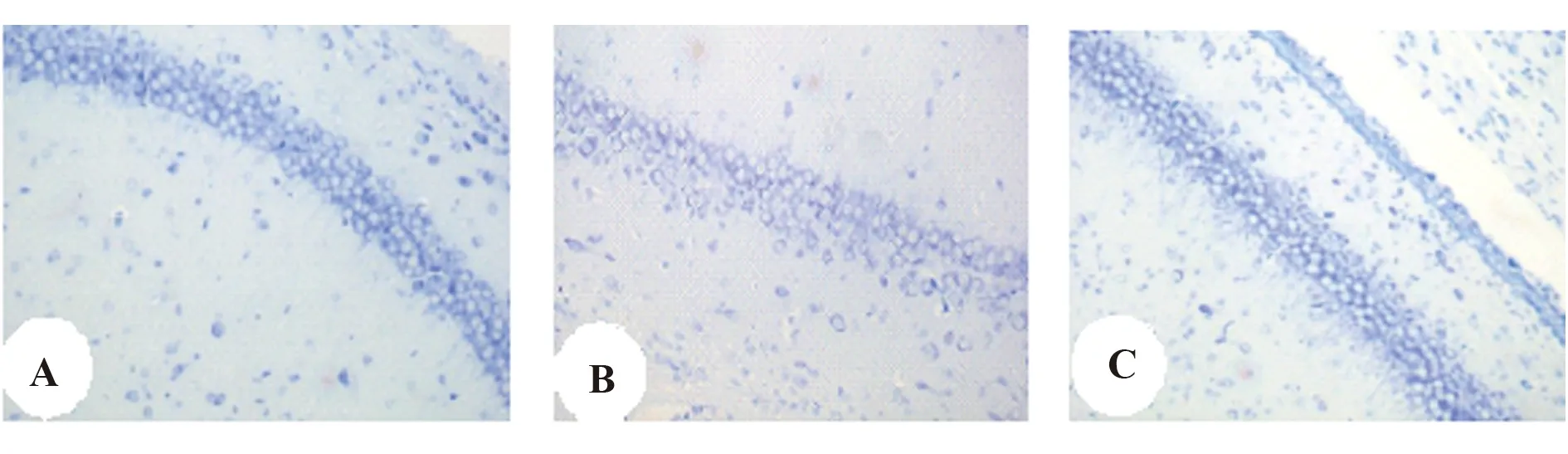
图4 各组大鼠脑海马区尼氏染色(×100)Fig.4 Nissl staining in hippocampus of rats in each group(×100)Note:A.Sham;B.Injury;C.UCBMSCs.
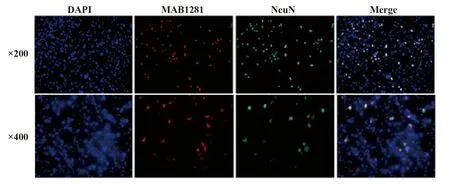
图5 移植的UCBMSCs在大鼠脑海马区的存活与分化Fig.5 Survival and differentiation of UCBMSCs transplanted in rat hippocampus
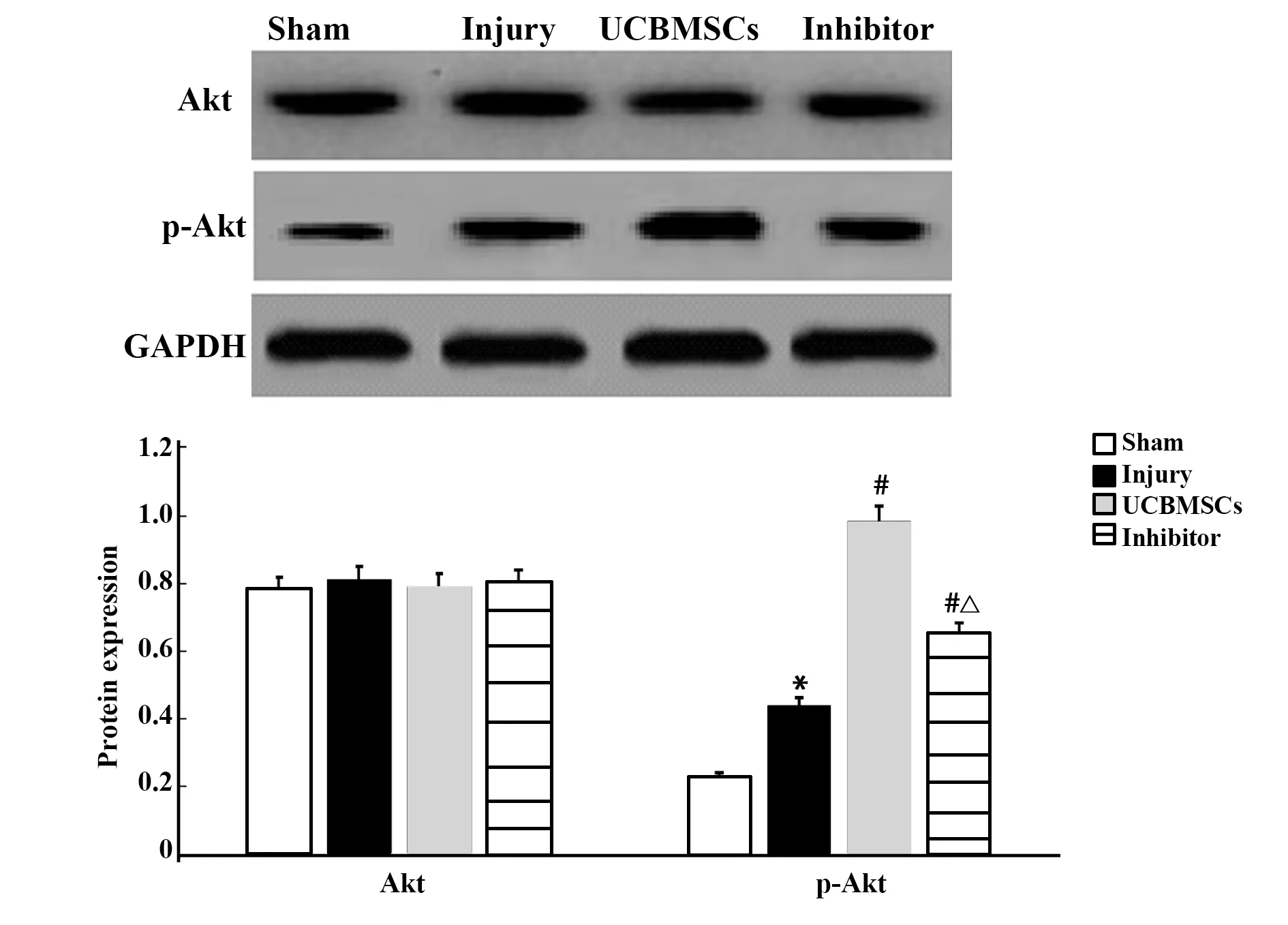
图6 各组Akt、p-Akt蛋白表达Fig.6 Expressions of Akt and p-Akt in each groupNote:Compared with sham,*.P<0.05;compared with injury,#.P<0.05;compared with UCBMSCs,△.P<0.05.
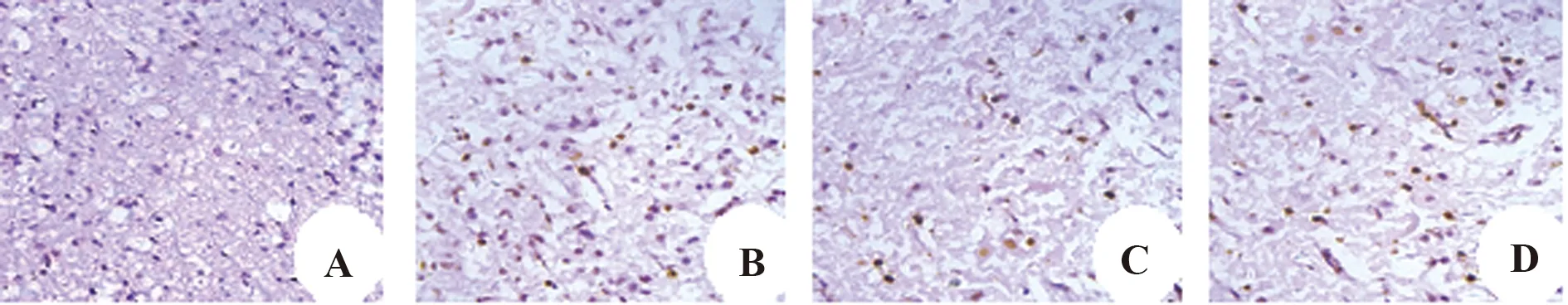
图7 Tunel染色检测各组细胞凋亡(×400)Fig.7 Tunel staining of apoptotic cells in each group(×400)Note:A.Sham;B.Injury;C.UCBMSCs;D.Inhibitor.
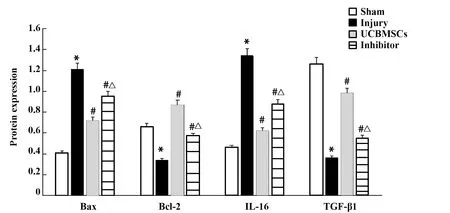
图8 各组凋亡蛋白与炎症因子蛋白表达Fig.8 Expressions of apoptotic protein and inflammatory factor in each groupNote:Compared with sham group,*.P<0.05;compared with injury group,#.P<0.05;compared with UCBMSCs,△.P<0.05.
3 讨论
炎症反应在缺血性脑卒中发病过程中发挥重要作用,脑组织缺血后,多种炎症介质破坏神经血管单元,其中IL-6是脑损伤后出现最早的炎症因子,临床将其作为早期评估缺血性脑卒中损伤程度的重要指标[11-12]。TGF-β1参与缺血性脑卒中发展过程,可作为缺血性脑损伤预后独立保护因子,对判断患者预后具有一定价值。本研究选择炎症因子IL-6、TGF-β1进行检测,实验结果显示IL-6与TGF-β1参与缺血性脑损伤发生发展,与既往研究结果一致[13]。UCBMSCs组术后3~14 d,IL-6水平明显低于损伤组,TGF-β1水平明显高于损伤组,神经功能损伤评分低于损伤组,说明UCBMSCs可通过降低IL-6水平、提升TGF-β1水平改善缺血性脑损伤大鼠的神经功能。课题组推测UCBMSCs可能通过以下途径调节炎症因子水平:脑缺血损伤后,脑组织内免疫细胞(如小胶质细胞)活化及外周血免疫细胞浸润引发炎症反应,而UCBMSCs分泌的因子作用于巨噬细胞,使其由M1向M2型转化,干预免疫分泌的细胞因子图谱,同时抑制和极化胶质细胞可发挥免疫调节与抗炎作用[14]。但UCBMSCs自身还是其分化后分泌的物质参与免疫调节,还是二者共同发挥作用还有待进一步研究。
尼氏染色显示,损伤组大鼠海马区锥体细胞缺失,排列混乱,细胞轮廓不清晰,胞浆内尼氏小体缩小;相比于损伤组,UCBMSCs组大鼠海马区椎体细胞明显增加,排列规则有序,细胞轮廓较清晰,胞浆内尼氏小体变大,说明UCBMSCs可能通过抑制细胞凋亡发挥神经保护作用。
干细胞移植主要有手术(脑内立体定向、腰椎穿刺、介入选择性颈内动脉注射)与非手术(静脉注射)2种途径,各注射方式都有其优缺点,临床中应根据患者实际情况进行选择。本实验选择股静脉注射途径,简单易行,无医疗条件及医疗水平限制,且不会对患者造成损伤,治疗费用较低。同时,由于脑缺血后各种致脑损伤的炎症因子被释放与激活,严重破坏血脑屏障,经血管移植的干细胞较易进入脑损伤部位。本实验免疫荧光染色显示,经股静脉移植的UCBMSCs可在脑组织中存活,并部分分化为神经样细胞,但最佳移植细胞数还有待进一步研究。
PI3K/Akt信号通路是经典的抗凋亡通路,其作用途径可分为Akt/Caspase途径、Akt/GSK-3β途径、Akt/叉头途径、Akt/Bcl-2途径、NF-kB途径与eNOS途径,研究证明PI3K/Akt信号通路与缺血性脑卒中关系密切[15]。涂献坤等[16]研究显示大鼠脑组织缺血24 h后,缺血脑组织p-Akt蛋白表达上调,PI3K/Akt信号通路确实参与缺血性脑损伤发病。本研究假设PI3K/Akt信号通路参与UCBMSCs的神经保护作用,结果显示缺血性脑损伤发生后,大鼠脑组织海马神经元凋亡数上调,脑组织IL-6蛋白、Bax蛋白表达升高,而TGF-β1蛋白、Bcl-2蛋白表达降低,同时p-Akt蛋白表达上升;UCBMSCs移植后,缺血性脑损伤大鼠脑海马神经元凋亡数减少,脑组织IL-6蛋白、Bax蛋白表达降低、TGF-β1蛋白、Bcl-2蛋白表达升高,同时p-Akt蛋白表达进一步上升,说明PI3K/Akt信号通路可能在UCBMSCs的抗炎与神经保护作用中具有重要调节作用。UCBMSCs的抗炎与神经保护作用可被Akt1/2/3抗体抑制剂削弱,进一步说明UCBMSCs通过激活PI3K/Akt信号通路发挥抗炎与神经保护作用[17]。
综上,本研究证实PI3K/Akt信号通路在UCBMSCs减轻缺血性脑损伤和炎症反应过程中发挥重要调节作用,但UCBMSCs的神经保护作用是否还有其他通路参与、其具体作用机制如何仍有待进一步研究。

