玉屏苍耳散对实验性AR 大鼠维甲酸相关孤儿核受体γt 及相关因子表达的影响
张 田喻国冻顾 平金 莹
(贵州医科大学附属医院 耳鼻咽喉科,贵阳 550004)
变应性鼻炎(AR)是耳鼻喉科常见疾病,发病率达30%左右[1-2],且发病人数逐年增加[3]。 AR 的主要临床症状为鼻痒、鼻塞、喷嚏、流涕、头疼等,严重影响患者的身心健康以及日常生活[4]。 然而常规的西药或者手术治疗效果不佳,且病情反复,治疗瓶颈长期存在[5]。 中医认为AR 属“鼻鼽”范畴,中药治疗以益气固表、宣肺通窍、补益脾肾为主。相关研究[6]表明:玉屏苍耳散对于AR 具有显著的治疗效果,可以明显改善甚至消除AR 的相关临床症状。 但是关于玉屏苍耳散对于AR 的治疗作用机制尚未明确,因此本研究建立实验性AR 大鼠模型,进一步验证了玉屏苍耳散对实验性AR 大鼠的治疗效果并对其相关机制进行研究,为该药的应用提供科学的理论依据。
1 材料和方法
1.1 实验动物
11 周龄的SPF 级SD 雄性大鼠,体重(266±15)g,共计40 只,由贵州医科大学实验动物中心提供[SCXK(黔)2018-0001];依照贵州医科大学实验动物中心实验动物管理办法,室温下标准饲料、自由饮水。 饲养环境:昼夜明暗各半循环照明,在22℃~26℃下维持恒定湿度,适应性饲养一周后用于实验。所有动物均在本实验室SPF 级动物房饲养[SYXK(黔)2018-0001 ],动物的使用及操作按照本院动物管理委员会(IACUC2018-035)的规定执行,并在不影响实验要求和结果基础上,按照3R 原则给予人道主义关怀。
1.2 主要试剂与仪器
玉屏苍耳散由我院中药制剂室提供;西替利嗪(国药准字H20030191)购买于成都恒瑞制药有限公司;氢氧化铝购自天津江天化工试剂有限公司;卵清蛋白(OVA)购买于美国Sigma 公司; cDNA 逆转录试剂盒购买于北京索莱宝科技有限公司;戊巴比妥购买于成都嘉叶生物科技有限公司;白细胞介素(IL-17)、维甲酸相关孤儿核受体γt(RORγt)以及白细胞介素(IL-23)引物由上海生工生物工程股份有限公司设计合成;IL-17、IL-6、TNF-α 以及IL-23酶联免疫试剂盒购自上海碧云天生物技术有限公司;RORγt 免疫组化试剂盒、TRIzol 试剂盒购于美国sigma 公司;RIPA 裂解液I 购于英国Abcam 公司;紫外分 光 光 度 计 (Thermo, 美 国); 倒 置 显 微 镜(OLYMPUS,日本);超低温冰箱(Siemens,德国);高速离心机(Eppendorf,德国);切片机(Leica,德国);ABI 7500 实时荧光定量 PCR 仪( Applied Biosystems,美国);多功能酶标仪(Thermo Fisher,美国)。
1.3 实验方法
1.3.1 动物分组及建模
本研究设置正常组,模型组,治疗组,西替利嗪组,每组10 只大鼠。 除正常组外,其余各组在第0、2、4、6、8、0、12 天以及第14 天对于SD 大鼠进行腹腔注射1 mL 由20 mg 卵清蛋白与30 mg 氢氧化铝配置的PBS 混悬液构建AR 大鼠模型。 正常组注射等量无菌PBS 溶液。 在第15 ~30 天时间段,正常组、模型组以5% OVA 生理盐水100 μL 双侧滴鼻激发,治疗组、西替利嗪组分别以10 g/kg 及西替利嗪2 mg/kg 灌胃给药,30 min 后以5% OVA 生理盐水共100 μL 双侧滴鼻激发,正常组大鼠给予等量的不含OVA 的PBS 溶液,每天1 次。 模型的建立通过大鼠鼻部症状评分进行检测:于第一次药前以及末次给药后观察30 min 内大鼠鼻窦炎症状,评分规则[7]如表1。 病理评分由2 名经过训练的人员分别进行评定,若意见不一致,则由第3 名人员进行评判。
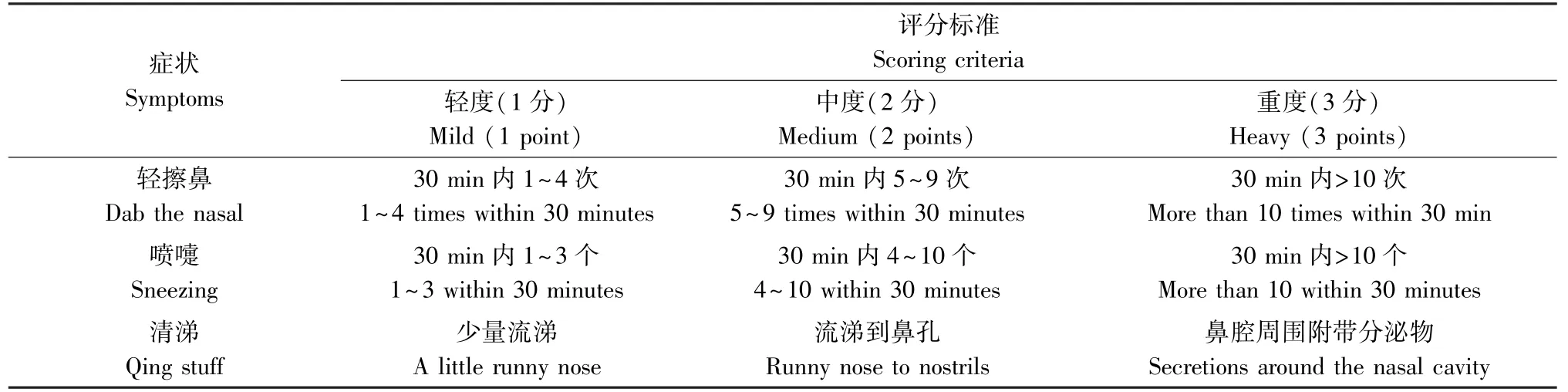
表1 大鼠鼻部症状评分表Table 1 Rating scale of nasal symptoms in rats
1.3.2 大鼠鼻腔黏膜细胞因子检测
将各组大鼠处死后分离鼻腔黏膜,加入RIPA裂解10 min,离心5 min,收集上清,采用酶联免疫吸附试剂盒测定各组大鼠鼻粘膜组织中IL-17、IL-23、TNF-α 以及IL-6 的浓度。 根据试剂盒说明书通过多功能酶标仪检测450 nm 处吸光度,根据标准曲线计算各组样本中IL-17、IL-23、TNF-α 以及IL-6 的浓度。
1.3.3 大鼠鼻黏膜组织HE 检测
腹腔麻醉后,固定,开胸,用注射器吸取生理盐水100 mL 进行心脏灌注,然后灌注100 mL 4%多聚甲醛固定液,待大鼠肝、脾变色后表示灌注完成,剔除大鼠鼻面部皮肤以及周边软组织,取包含鼻黏膜的鼻腔组织,4%甲醛溶液固定,常规石蜡切片,苏木精-伊红染色,显微镜下进行病理学观察。
1.3.4 免疫组化法检测各组大鼠鼻黏膜中RORγt的表达
采用免疫组织化学染色法(SABC)检测大鼠鼻黏膜组织中RORγt 的表达:首先,将标本按常规方法制成石蜡切片,厚度为4 μm,常规脱蜡,血清封闭,抗原修复后根据RORγt 免疫组化试剂盒说明书进行操作。 待染色完成后,于显微镜下观测并拍照记录,以棕褐色或者棕黄色反应产物为阳性,采用Image J 软件进行光密度分析。
1.3.5 qRT-PCR 检测
收集各组大鼠鼻黏膜,根据TRIzol 试剂盒说明书操作,提取总RNA,采用紫外分光光度计对RNA浓度进行检测。 使用cDNA 逆转录试剂盒将RNA逆转录为cDNA,反应条件:95℃预变性10 s; 95℃变性55 s; 59℃退火45 s; 70℃延伸60 s,共40 个循环。 以β-actin 做为扩增内参,采用ABI 7500 实时荧光定量PCR 仪对扩增结果进行数据分析。 引物 序 列 为, RORγt ( 正 向: 5 ' -CATCTCCAGCCTCAGCTTTGA-3', 反 向: 5 ' -TCCCCCAGAAGTCCTTAAATCC-3');IL-23(正向:5'- ACACACACCAGTGGGACAAA -3',反向:5'-ACAACCATCACCACACTGGA-3');IL-17(正向:5'-TCTCTGATGCTGTTGCTGCT-3 ', 反 向: 5 ' -CGTGGAACGGTTGAGGTAGT-3'); β-actin (正 向:5 '-TTCAACGGCACAGTCAAG-3 ', 反 向: 5 '-CCACGACATACTCAGCAC-3')。
1.4 统计学方法
实验数据采用软件SPSS 21.0、GraphPad Prism 5 进行分析,数据以平均数±标准差()来表示,组间采用单因素方差分析,P<0.05 代表数据间具有统计学差异。
2 结果
2.1 大鼠鼻部症状评分检测
首次给药前模型组和玉屏苍耳散组以及西替利嗪组鼻部症状评分大于5 分,相比于正常组,鼻部评分显著升高(P<0.05)。 末次给药后,模型组评分显著高于正常组(P<0.05),玉屏苍耳散组以及西替利嗪组显著低于模型组(P<0.05),玉屏苍耳散组与西替利嗪组在评分上无统计学差异(P>0.05)见表2。
2.2 大鼠鼻黏膜组织炎性细胞因子检测
与正常组比较,模型组大鼠鼻黏膜组织中细胞因子IL-17、IL-23、TNF-α 以及IL-6 明显增加(P<0.05);玉屏苍耳散组与模型组相比鼻黏膜组织中IL-17、IL-23、TNF-α 以及IL-6 表达明显显著降低(P<0.05);玉屏苍耳散组与西替利嗪组相比,细胞因子表达无显著差异(P>0.05),见图1。

表2 各组大鼠鼻部症状检测(n=10)Table 2 Nasal symptom detection of rats in each group
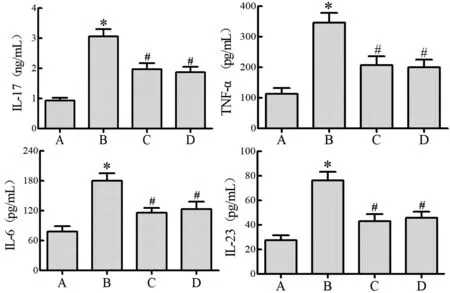
图1 各组大鼠鼻黏膜组织细胞因子分泌情况Note.A, Normal group.B, Model group.C, Yu Pingcanger Powder group.D, Cetirizine group.Compared with the normal group,*P<0.05.Compared with model group, #P<0.05.The same as below.Figure 1 Cytokine secretion in nasal mucosa of rats in each group
2.3 大鼠鼻黏膜组织HE 染色
相比于正常组,模型组大鼠鼻黏膜组织中显著增厚(P<0.05);玉屏苍耳散组与西替利嗪组大鼠相比于模型组,鼻粘膜增厚程度显著降低(P<0.05),玉屏苍耳散组与西替利嗪组相比无显著性差异(P>0.05)见图2。
2.4 各组大鼠鼻粘膜组织RORγt 的表达
与正常组比较,模型组大鼠鼻粘膜组织RORγt表达明显增加(P<0.05);与模型组相比,玉屏苍耳散组与西替利嗪组大鼠鼻粘膜组织RORγt 表达显著降低(P<0.05),玉屏苍耳散组与西替利嗪组相比RORγt 表达无明显差异(P>0.05)见图3。
2.5 qRT-PCR 检测大鼠鼻黏膜组织RORγt、IL-23、IL-17 mRNA 的表达
与正常组比较,模型组大鼠鼻黏膜组织RORγt、IL-23 以及IL-17 mRNA 的表达明显增加(P<0.05);与模型组比较,玉屏苍耳散组与西替利嗪组大鼠鼻黏膜组织中RORγt、IL-23 以及IL-17 mRNA 的表达显著降低(P<0.05);玉屏苍耳散组与西替利嗪组相比无明显差异(P>0.05),见图4。
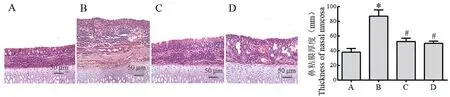
图2 各组大鼠鼻黏膜组织HE 染色情况Figure 2 HE staining of nasal mucosa tissues of rats in each group

图3 各组大鼠鼻黏膜组织RORγt 的表达Figure 3 Expression of ROR T in nasal mucosa of rats in each group
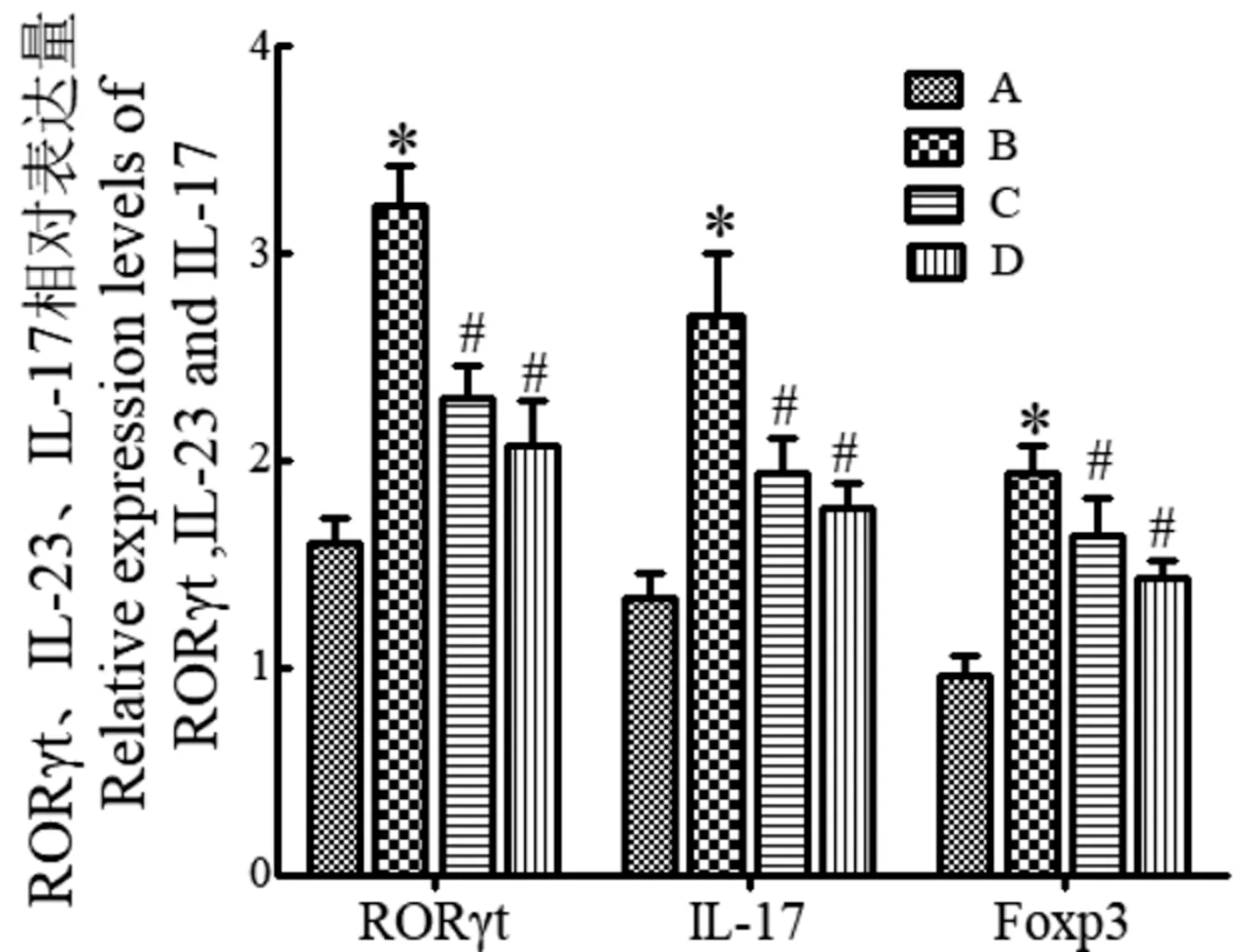
图4 各组大鼠RORγt 以及相关因子的表达水平Figure 4 Expression levels of ROR T and related factors in each group
3 讨论
随着中医药理论的完善,中药应用于AR 的研究受到众多研究者的重视与关注[6-11]。 据报道[12],玉屏苍耳散对于AR 具有一定的治疗效果,可明显改善AR 的临床症状。 但是,玉屏苍耳散对AR 治疗的作用机制仍不清楚。 在本研究中,建立AR 大鼠模型,结果显示模型组大鼠鼻部症状检测评分以及炎性因子水平分泌显著高于正常组,证明模型建立成功。 给予玉屏苍耳散治疗后,相比于模型组大鼠,玉屏苍耳散组大鼠的评分以及炎性因子分泌水平显著降低,表明玉屏苍耳散对于AR 大鼠具有明显的治疗作用。
近年来,Th17 细胞被发现并被广泛研究报道,相关研究[13-15]表明Th17 细胞参与某些过敏性疾病的发生与发展。 有研究[16]发现在AR 鼻粘膜中Th17 明显升高。 Th17 主要分泌细胞因子IL-17,IL-17 具有促炎作用,可诱导促炎细胞因子如IL-6、TNF-α 等的分泌,引发组织细胞的炎性浸润,造成组织损伤[17]。 本研究中,模型组大鼠炎症因子TNFα、IL-6 表达显著升高,玉屏苍耳散显著降低鼻黏膜部位的炎症因子IL-6、TNF-α 的水平,证明玉屏苍耳散可改善AR 大鼠鼻部组织的炎性浸润,发挥治疗作用。 IL-23 作为IL-12 家族的一员,可促进Th17细胞分泌IL-17 等细胞因子发挥生物学功能,IL-23参与Th17 的扩增与存活,是维持Th17 存活的重要因子[18-19]。 模型组大鼠鼻粘膜部位的IL-23 以及IL-17 表达水平显著高于正常大鼠,玉屏苍耳散组表达水平明显降低。
RORγt 是Th17 细胞的特异性转录因子,RORγt在预防免疫激活和抑制炎性病变中至关重要[20],在过敏性疾病、感染以及自身免疫病的发生发展中起到重要作用[21-22]。 在本研究中,模型组大鼠鼻黏膜RORγt 以及相关因子IL-23 和IL-17 的mRNA 表达显著高于正常组,说明RORγt、IL-23 和IL-17 参与过敏性鼻炎的发展。 玉屏苍耳散中的中药成分对于机体的免疫调节已有报道,刘慧等[23]在研究治疗胶原诱导性关节炎小鼠的机制中发现,黄芪糖蛋白能够降低RORγt 的表达水平,恢复Th17 与Treg 细胞之间的平衡。 另有报道称[24],金银花可通过下调鼻黏膜RORγt 表达水平,纠正其失衡,并抑制IL-17产生,从而缓解鼻部炎性反应。 本研究中玉屏苍耳散组大鼠RORγt 以及相关因子表达明显降低,揭示了玉屏苍耳散可以通过抑制RORγt、IL-23 的表达,从而抑制TH17 细胞扩增与存活,进而降低IL-17 的分泌,抑制炎性的浸润,从而发挥对AR 的治疗作用。
综上所述,本研究通过建立AR 大鼠模型验证了玉屏苍耳散抑制RORγt 以及相关因子IL-17、IL-23 的表达,从而发挥对AR 的治疗作用。 由于AR发病因素复杂,病情发展过程受众多因素调控。 因此玉屏苍耳散对于AR 的作用机制有待深入研究。

