清肠化湿方对溃疡性结肠炎小鼠炎症及肠道菌群的影响
刘丽,康安,刘春样,田磊,刘志辉,沈洪
(1.南京中医药大学附属医院,江苏 南京 210029;2.南京中医药大学药学院,江苏 南京 210023)
溃疡性结肠炎(Ulcerative colitis,UC)属于炎症性肠病(Inflammatory bowel disease,IBD),是一种主要累及大肠黏膜、黏膜下层的慢性炎症性肠道疾病,表现有体质量减轻、腹泻、直肠出血和腹痛[1]。UC患者生活质量差,病情常反复发作,但是临床上西医用药及治疗手段种类有限、疗效欠佳,且预后很难判断。沈洪教授借鉴金代名医刘完素治疗“久痢”理法原则,将经方芍药汤加减化裁而成清肠化湿方,在临床实践中治疗湿热蕴肠、气血不调为主的活动期UC患者,可以很好地改善UC患者临床症状,降低复发率[2]。前期药效学实验结果亦显示清肠化湿方具有良好的抗炎、降低血管通透性和镇痛功效[3]。葡聚糖硫酸钠(Dextran sulfate sodium,DSS)诱导的UC造模简单且与人类UC具有高度相似性,经常用于研究UC的发病机理[1]。本文拟通过清肠化湿方干预治疗DSS制备的小鼠急性期UC模型,进一步探讨清肠化湿方治疗UC的作用机制。
1 材料与方法
1.1 材料
1.1.1 药品及主要试剂 清肠化湿方由黄芩10 g,黄连6 g,煨木香6 g,炒当归10 g,地榆10 g,炒白芍15 g,白芷10 g,甘草6 g等组成,购自南京中医药大学附属医院,经南京中医药大学附属医院刘志辉教授鉴定为正品。上述饮片加入10倍量的水,浸泡1 h后,加热煎煮1 h,滤过;药渣再加8倍量水,煎煮1 h,滤过;合并2次滤液,减压浓缩,制成生药浓度为3.776 g/mL的制剂。DSS(平均分子量:36 000~50 000)为MP Biomedicals公司产品,用无菌饮用水制成质量分数为3%的溶液用于实验。柳氮磺胺吡啶(Salicylazosulfapyridine,SASP)购自上海信谊天平药业有限公司,用0.5% CMC-Na溶液配制成质量浓度为20 mg/mL用于实验。IL-6和TNF-α ELISA试剂盒为Biolegend公司产品。BCA试剂盒为碧云天生物技术有限公司产品。EZNA Stool DNA Kit为Omega Bio-tek公司产品,TransStartFastPfuDNA Polymerase为北京全式金生物技术有限公司产品,AxyPrep DNA GelExtraction Kit为Axygen Biosciences公司产品。
1.1.2 实验动物 雄性C57BL小鼠,8周龄,18~22 g,购自南京市江宁区青龙山动物繁殖场,许可证号:SCXK(苏)2017-0001。
1.2 方法
1.2.1 DSS诱导制备小鼠溃疡性结肠炎模型及药物干预 实验小鼠适应性喂养3 d后,称小鼠体质量,随机分为正常对照组(Control)、模型组(DSS)、清肠化湿方组(QCHS)和柳氮磺胺吡啶组(SASP),每组10只小鼠。模型组和治疗组小鼠自由饮用3%DSS溶液5 d,第6天更换无DSS饮用水至实验结束。正常对照组小鼠饮用水不含有DSS。柳氮磺胺吡啶组于造模当日开始进行柳氮磺胺吡啶(每10 g小鼠体质量灌胃0.1 mL)饲喂至实验结束,清肠化湿方组于造模前1 d开始给小鼠灌胃给药(33.8 g/kg)至实验结束,模型组一直饲喂生理盐水。分别于造模第0、2、4、6、8、9天进行小鼠体质量称量。造模第9天处死小鼠,分离小鼠脾脏并称质量,分离小鼠结肠并量取结肠长度,收集小鼠结肠内肠道内容物。
1.2.2 小鼠结肠组织病理学观察 取福尔马林固定后的小鼠结肠组织,按顺序依次进行脱水、透明、石蜡包埋、切片、脱蜡至水后行苏木精-伊红染色,光学显微镜下观察结肠组织的炎性细胞浸润和黏膜组织损伤情况。
1.2.3 ELISA法检测小鼠结肠组织中IL-6和TNF-α的含量 结肠经匀浆后的上清液适当稀释后,按试剂盒所述方法,经上样、孵育、洗板、封板,加入各自的底物显色剂、终止液检测,按标准曲线法计算出IL-6和TNF-α的含量,根据稀释倍数及结肠上清液的蛋白浓度校正后,得出IL-6和TNF-α最终含量。
1.2.4 气相色谱-质谱法(GC-MS)检测小鼠肠道内丁酸、异丁酸的含量 检测方法由一步法衍生,参照文献[4]:在水、丙醇和吡啶(8∶3∶2)的反应系统中,加入氯甲酸丙酯100 μL,用己烷两步萃取法提取。Agilent 7890A气相色谱-安捷伦5975C惰性色谱系统XL EI/CI质谱检测器(GC-MS)分析生物样品中的丁酸(Butyric acid,BA)、异丁酸(Isobutyric acid,IBA)的含量。衍生品分离使用涂覆有5%苯基,95%甲基聚硅氧烷(30 m i.d.、0.25 μm膜厚)毛细管柱。电子能量设定为-70 V,全扫描模式(m/z30~600)收集质谱数据,分析丁酸、异丁酸在小鼠肠道内容物中的含量。
1.2.5 小鼠粪便微生物DNA提取、PCR反应、测序文库构建、测序和数据分析 根据试剂盒说明书操作步骤,使用E.Z.N.A. Stool DNA Kit提取正常对照组、模型组和清肠化湿方组小鼠粪便中微生物DNA。DNA浓度和质量检测合格后,对DNA样本进行16S核糖体RNA基因V3~V4(341F-806R)区域的PCR扩增。引物341F:5'-CCTAYGGGRBGCASCAG-3',806R:5'-GGACTACNNGGGTATCTAAT-3'。PCR反应体系包含4 μL 5×FastPfuBuffer、2 μL 2.5 mmol/L dNTPs、0.8 μL上游引物(5 μmol/L)、0.8 μL下游引物(5 μmol/L)、0.4 μLFastPfuDNA Polymerase和10 ng模板DNA。PCR反应程序如下:95 ℃初始变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,27个循环;72 ℃ 10 min,10 ℃。扩增产物使用AxyPrep DNA Gel extraction kit纯化。纯化后的PCR产物进行Illumina PE250文库构建、Illumina PE250测序。对测序后的原始数据进行分析,以上工作委托上海凌恩生物科技有限公司完成。Illumina PE250测序获得的序列,对Reads的质量进行质控过滤,对质控拼接好的序列按照97%相似性进行OTU聚类分析。基于OTU聚类分析结果进行多样性指数分析、测序深度的检测,基于分类学信息在各个分类水平上进行群落结构的统计分析。
1.2.6 统计学方法 本实验所获得的小鼠体质量、结肠长度、脾脏质量、促炎因子和丁酸含量等数据采用SPSS12.0软件One-WayANOVA方法进行分析。各组小鼠肠道内的菌群丰度统计比较采用Wilcoxon秩和检验分析,P<0.05为差异有统计学意义。PCoA统计分析采用R语言完成。
2 结果
2.1 清肠化湿方对UC小鼠一般情况的影响
与模型组比较,清肠化湿方组和柳氮磺胺吡啶组可以不同程度地改善实验动物症状,使大部分实验动物的大便性状、毛色、精神状态逐渐好转。各组小鼠在造模当天体质量无显著差别。在第6、8、9天,模型组与正常组相比,体质量显著降低(P<0.01)。在第8、9天,柳氮磺胺吡啶组与模型组相比,体质量显著升高(P<0.05~0.01);清肠化湿方组与模型组相比,体质量显著升高(P<0.05~0.01)(图1a)。
2.2 清肠化湿方对UC小鼠结肠长度的影响
模型组小鼠与正常组小鼠相比,结肠长度显著缩短(P<0.01)。清肠化湿方组和柳氮磺胺吡啶组小鼠结肠长度显著大于模型组小鼠(P<0.01)(图1b)。
2.3 清肠化湿方对UC小鼠脾脏质量的影响
与正常组相比,模型组脾脏质量显著增加(P<0.01);清肠化湿方组(P<0.01)和柳氮磺胺吡啶组(P<0.01)小鼠脾脏质量显著低于模型组(图1c)。
2.4 清肠化湿方对UC小鼠结肠病理的影响
如图1d所示,正常对照组小鼠结肠组织结构完整清晰,隐窝结构正常、杯状细胞未见破坏,散在或少量炎性细胞位于固有层间质。模型组、清肠化湿方组和柳氮磺胺吡啶组小鼠结肠都表现出不同程度的炎症和黏膜损伤,且这些损伤在整个实验期间都未得到完全恢复。其中,模型组小鼠结肠组织炎症、黏膜损伤程度最重,肠道上皮细胞和杯状细胞数量减少,隐窝结构受到损坏,黏膜和黏膜下层有较多炎性细胞浸润。和模型组相比,清肠化湿方组和柳氮磺胺吡啶组小鼠结肠组织病理形态得到改善,黏膜损伤程度减轻,隐窝结构较为正常,肠道上皮和杯状细胞数量减少得到改善,固有层炎症减轻。

注:Control.正常对照组;DSS.模型组;SASP.柳氮磺胺吡啶组;QCHS. 清肠化湿方组。黑色箭头指向病理损伤及文中描述病理部位(HE, ×200)。与模型组比较,
2.5 清肠化湿方对UC小鼠结肠组织IL-6、TNF-α水平的影响
与正常组相比,模型组小鼠结肠组织IL-6、TNF-α水平显著升高(P<0.01)。与模型组相比,清肠化湿方组小鼠结肠组织IL-6、TNF-α水平显著降低(P<0.01);柳氮磺胺吡啶组小鼠结肠组织内IL-6、TNF-α表达水平显著降低(P<0.01)(图2)。
2.6 清肠化湿方对UC小鼠结肠肠道内容物中丁酸、异丁酸含量的影响
如图3显示,与正常组相比,模型组小鼠结肠肠道内容物中丁酸、异丁酸含量均显著降低(P<0.01)。与模型组相比,清肠化湿方组小鼠结肠肠道内容物中丁酸、异丁酸含量均显著升高(P<0.05);柳氮磺胺吡啶组小鼠的结肠肠道内容物中异丁酸含量显著增加(P<0.01)。

注:Control.正常对照组;DSS.模型组;SASP.柳氮磺胺吡啶组; QCHS.清肠化湿方组。与模型组比较,图2 清肠化湿方对DSS诱导UC模型小鼠结肠组织IL-6、 TNF-α水平的影响

注:Control.正常对照组;DSS.模型组;SASP.柳氮磺胺吡啶组; QCHS.清肠化湿方组;BA.丁酸,IBA.异丁酸。与模型组比较,
2.7 实验小鼠粪便菌群的稀释性曲线和物种累积曲线分析
本次实验稀释性曲线(图4a)趋向平坦,表示更多的数据量只会产生少量新的OTU,说明本研究测序数据量合理,样本测序深度充分。物种累积曲线(图4b)趋于平缓,表示本次实验中检测到的物种不会随样本量的增加而显著增多,说明本次实验样本量充分。
2.8 实验小鼠粪便菌群的alpha多样性分析
Shannon指数和Simpson指数常用来定量描述样本的生物多样性。Shannon值越大,说明群落多样性越高;Simpson指数值越大,说明群落多样性越低。如图4c和4d所示,与正常对照组相比,DSS诱导UC模型小鼠粪便菌群的多样性降低;清肠化湿方药物干预治疗后,小鼠粪便菌群的多样性较模型组增加,接近于正常对照组,提示DSS诱导的模型组小鼠表现出肠道菌群失调,清肠化湿方可以通过提高肠道菌群多样性,在一定程度上保持肠道菌群多样性平衡。
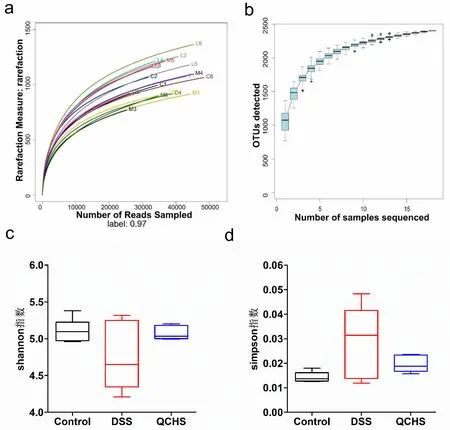
注:a.稀释性曲线;b.物种累积曲线;c.Shannon指数图;d.Simpson指数 图。C1~C6.正常对照组样本;M1~M6.模型组样本;L1~L6.清肠化 湿方组样本。Control.正常对照组;DSS.模型组;QCHS.清肠化湿方组。
2.9 实验小鼠粪便菌群的主坐标分析(PCoA)分析
PCoA是一种非约束性的数据降维分析方法,可用来研究样本群落组成的相似性或差异性,样本距离越接近表示物种组成结构越相似。本研究通过PCoA作图发现正常组、模型组和清肠化湿方组的菌群样本分布在不同区域,同组样品分布在相近区域内(图5),提示各组间肠道菌群结构存在差异性。

注:红色C1~C6.正常对照组;绿色M1~M6.模型组; 蓝色L1~L6.清肠化湿方组,n=6。
2.10 清肠化湿方对UC模型小鼠肠道菌群丰度的影响
通过对测序样品的序列进行比对分析,各组小鼠的粪便菌群主要属于5个菌门,包括拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和疣微菌门(Verrucomicrobia),这5个菌门序列总和占各组小鼠粪便菌群中序列总数99%以上。其中,拟杆菌门和厚壁菌门又是肠道菌群中的绝对优势菌,这2个菌门丰度在正常对照组中约占95.75%,在清肠化湿方组中约占93.34%,在模型组中约占86.62%,模型组拟杆菌门和厚壁菌门丰度之和小于正常对照组和清肠化湿方组,但无显著性差异。正常对照组中疣微菌门(0.000 66%)含量极少,模型组疣微菌门(4.071%)含量较正常对照组显著增加(P<0.01),上调6 000余倍;清肠化湿方组干预治疗后疣微菌门丰度较模型组下调近一半(2.136%),但与模型组比较无差异显著性。与正常对照组中变形菌门丰度(2.090%)相比,模型组变形菌门丰度增加(6.845%),清肠化湿方组干预治疗后变形菌门丰度下降(2.749%)并且与正常对照组变形菌门丰度相似,但两两比较皆无统计学差异(图6a、c)。
图6b显示的是在属水平上丰度排序前50位(TOP50)的菌群Heatmap图,展示了这些菌群在每个实验样本中的含量变化。图6d~6e展示的是各组在TOP50菌群内丰度有显著变化的菌群。与正常对照组比较,模型组中显著上调的菌属有Akkermansia(P<0.01)、Candidatus_Stoquefichus(P<0.01)、Turicibacter(P<0.01)、Romboutsia(P<0.01)、Eubacterium_fissicatena_group(P<0.05)、Parasutterella(P<0.05)、Parabacteroides(P<0.05)、Faecalitalea(P<0.05)、Olsenella(P<0.05)、Erysipelatoclostridium(P<0.05)和Adlercreutzia(P<0.01),下调的菌有Alistipes(P<0.01)、Ruminiclostridium(P<0.01)、Alloprevotella(P<0.01)、PrevotellaceaeNK3B31group(P<0.05)、Ruminococcaceae_uncultured(P<0.01)、Lachnospiraceae_uncultured(P<0.05)和Odoribacter(P<0.05)。在这些变化的菌群中,对于丰度上调的菌属,清肠化湿方干预治疗后的小鼠肠道中Akkermansia、Eubacterium_fissicatena_group、Turicibacter、Adlercreutzia、Romboutsia、Parasutterella、Parabacteroides、Erysipelatoclostridium、Faecalitalea、Olsenella这些菌属的丰度呈较大下调趋势(下调倍数≥1.4),且下调后的Erysipelatoclostridium、Parabacteroides、Faecalitalea、Olsenella丰度与正常对照组相比无显著性差异。对于在模型组中丰度显著下调的菌属Alistipes、Odoribacter、Ruminiclostridium、Ruminococcaceae_uncultured,清肠化湿方干预治疗后,这些菌属丰度呈较大上调趋势(上调倍数≥1.3),且上调后的Ruminiclostridium丰度与模型组相比显著上调(P<0.05),另外上调后的Odoribacter丰度与正常对照组相比无显著性差异。由此可见,清肠化湿方干预治疗能够不同程度地逆转模型组小鼠肠道内的菌群失衡并向正常组菌群趋近。
3 讨论
丁酸作为肠道内厌氧细菌发酵的主要产物之一,对结肠功能的正常发挥具有重要的作用。与健康个体相比,UC患者的肠黏膜丁酸盐摄取和利用受到抑制[5]。重度UC患者粪便中丁酸、异丁酸浓度下降[6],采用丁酸治疗UC患者可使其临床症状和组织学病理得到改善[7]。丁酸作为结肠上皮细胞的重要能量来源[8],可以增强肠道黏膜屏障,加强细胞紧密连接[9],下调促炎细胞因子TNF-α、IL-6的表达[10]等。强效促炎细胞因子如IL-6、TNF-α能够介导持续性的IBD炎症导致组织破坏[11],TNF-α亦会降低丁酸氧化导致结肠细胞能量供应减少[12]。本研究结果显示清肠化湿方治疗后的小鼠结肠组织中TNF-α、IL-6含量显著下调,说明清肠化湿方减轻肠道炎症与下调促炎因子有关。清肠化湿方治疗后,小鼠肠道内丁酸含量较模型组显著升高,上调的丁酸可以进一步下调促炎因子水平,从而减缓肠炎进展。
肠道菌群被认为是UC发病机理的关键因素[13],UC与肠道菌群失衡和微生物多样性降低有关[14]。本研究中,模型组小鼠的肠道菌群多样性亦表现为下降趋势,一些菌群的组成及丰度也发生了改变。在门水平,模型组小鼠疣微菌门丰度显著增加,这与文献[15]报道一致。DSS诱导肠炎模型动物中Akkermansia[16]、Erysipelatoclostridium[13]、Turicibacter[17]、Faecalitalea[18]、Parasutterella[19]和Parabacteroides[17]的丰度增加。Parasutterella和Parabacteroides被认为是潜在有害菌群,与炎症性肠病呈正相关[19]。Parabacteroides丰度与结肠紧密连接蛋白Occludin、ZO-1基因表达水平负相关[20]。在TNBS诱导结肠炎大鼠模型中,侵袭性细菌如Escherichia-Shigella、Akkermansia、Turicibacter与结肠促炎细胞因子如TNF-α、IL-6等呈正相关[21]。
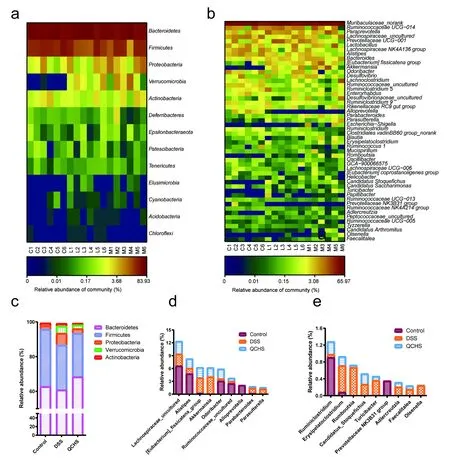
注:a,c.各组在菌门水平的丰度;b.各组在TOP50菌属的丰度; d,e.TOP50菌属内丰度有显著变化的菌群;C1~C6.正常对照组; M1~M6.模型组;L1~L6.清肠化湿方组。Control.正常对照组; DSS.模型组;QCHS.清肠化湿方组。
Alistipes主要存在于健康人类的肠道中,其存在与促进健康表型有关,在结肠炎疾病中具有保护作用,能够产生具有抗炎性质的短链脂肪酸[22]。Alloprevotella[23]、Odoribacter[24]、Ruminococcaceae和Lachnospiraceae[25]都能够产生丁酸。Alloprevotella、PrevotellaceaeNK3B31group属于抗炎细菌[26]。Odoribacter增加可能有助于减轻炎症[24]。DSS诱导肠炎小鼠粪便中Alloprevotella丰度与IL-6和TNF-α负相关而与抗炎因子IL-10水平正相关[27]。DSS诱导肠炎大鼠粪便中Prevotellaceae_NK3B31_group显著降低并推测此降低与炎症相关[18]。Ruminococcaceae具有抗炎活性,在宿主健康中可能发挥潜在的生理功能[28]。Lachnospiraceae能够维持胃肠道健康,并成为评估肠道健康的有力工具[21]。UC患者粪便中Lachnospiraceae丰度显著降低,人体肠道菌群模型中丁酸产量下降与Lachnospiraceae丰度下降有关[29]。本研究中模型组小鼠肠道内丁酸含量降低和炎症增加,亦可能与这些产生丁酸或抗炎相关菌群的数量下降有关。
清肠化湿方能够下调模型组小鼠肠道内疣微菌门、变形菌门丰度,使模型组小鼠肠道内丰度显著上调的菌属Akkermansia、Eubacterium_fissicatena_group、Turicibacter、Adlercreutzia、Romboutsia、Parasutterella、Parabacteroides、Erysipelatoclostridium、Faecalitalea、Olsenella含量呈较大降低趋势,且下调后的Erysipelatoclostridium、Parabacteroides、Faecalitalea、Olsenella丰度与正常对照组相比无显著性差异。对于在DSS模型组中丰度显著下调的菌属Alistipes、Odoribacter、Ruminiclostridium和Ruminococcaceae_uncultured,清肠化湿方可以使这些菌属丰度增加,其中Ruminiclostridium较模型组显著上调,Odoribacter丰度增加后与正常对照组相比没有显著性差异。因此,清肠化湿方能不同程度回调DSS造模小鼠肠道内失调的大部分菌群,虽然未能使肠道菌群恢复至正常状态,但逆转了失调的大部分菌群变化趋势,使得变化的菌群不同程度地向正常组水平趋近恢复。这也从肠道菌群角度,说明清肠化湿方干预治疗DSS诱导UC模型小鼠后可以改善肠道菌群生态平衡,降低促疾病发生发展的相关菌群丰度,增加产丁酸或抗炎等有益疾病恢复的菌群丰度。
综上所述,通过DSS诱导制备的小鼠UC模型,本研究展示了清肠化湿方对UC模型小鼠良好的治疗作用,表现为可以增加疾病小鼠体质量、减轻脾脏肿大、降低结肠病理损伤、增加结肠长度等。通过结肠组织中促炎因子IL-6、TNF-α和丁酸、异丁酸含量检测,结合粪便菌群测序分析,证明清肠化湿方缓解模型小鼠肠道炎症机制与下调促炎因子水平、上调肠道内丁酸和异丁酸含量、维持肠道菌群平衡有关。本研究完善了清肠化湿方治疗UC的机制研究,从微生物及其代谢产物角度探讨了清肠化湿方治疗UC的作用机理,研究结果将为基于清肠化湿方的药物开发提供实验和理论依据。
- 南京中医药大学学报的其它文章
- 中药活性化合物高良姜素与吉非替尼抗非小细胞肺癌的协同增效作用及机制研究
- 基于网络药理学的扶土生金康复方调节新型冠状病毒肺炎恢复期免疫功能机制研究
- Study on the Mechanism of Jiangzhi Mai'an Granule in Treating Nonalcoholic Fatty Liver Disease Based on Network Pharmacology
- 2010-2019年国家自然科学基金中医学领域糖尿病相关项目申请与资助情况分析
- 冰片引经作用的探讨及其分子机制研究进展
- 金荞麦联合SASP治疗大肠湿热型UC的疗效及其对TLR4/NLRP3信号通路的影响

