Percheron动脉梗死临床特征
戴晓蓉 李明 马秀芝 陈杰 魏青
丘脑旁正中动脉闭塞多为单侧,当旁正中动脉解剖变异支配双侧时被称为Percheron动脉(artery of Percheron,AOP),AOP闭塞可出现双侧丘脑梗死,在临床上较少见。AOP梗死占缺血性卒中的0.4%~0.5%[1],占所有丘脑梗死的 4%~18%[2]。AOP梗死的临床表现以意识障碍、记忆力减退、语言障碍和垂直注视麻痹为特征。还可能出现小脑体征,偏侧轻瘫和偏身感觉减退[1],早期易误诊而延误治疗。为提高临床医生对本病的认识,对我院自2014年收治的11例患者进行分析。
1 对象与方法
1.1 研究对象 收集玉溪市人民医院脑血管病科2014年8月至2020年10月收治的Percheron动脉梗死患者。纳入标准:①急性起病,发病72 h内入院;②颅脑MR-DWI证实为双侧丘脑旁正中区新发梗死,伴或不伴中脑和(或)丘脑前部梗死。排除标准:①存在丘脑、中脑以外部位的梗死灶;②静脉病变所致梗死;③感染、代谢、肿瘤、中毒等因素所致双侧丘脑病变;④入院前改良Rankin量表(modified Rankin scale,mRS)评分>2 分。
1.2 资料收集 记录患者性别、年龄、职业、烟酒史、既往病史、发病时间、首发症状、临床表现、急性卒中治疗低分子肝素试验 (Trial of Org 10172 in Acute Stroke Treatment,TOAST) 分型、Glasgow昏迷评定量表(Glasgow coma scale,GCS)评分、美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS)评分、mRS 评分、影像学资料、心电图、心脏彩超、实验室检查等,以及治疗和预后资料,进行回顾性分析。
1.2.1 头颅CT①GE公司64 Light speed VCT扫描参数:探测器宽度64 mm×0.625 mm,螺距0.984 mm,扫描时间0.5 s,视野 250 mm,重建层厚0.625 mm,层间距0.625 mm,采用管电压为120 kV,自动毫安技术。②Siemens公司双源Somatom Force CT扫描参数:采用Turbo Flash大螺距模式。管电压80/100 kV,管电流300 mA,CARE Dose模式打开,螺距3.2,探测器准直为2 mm×192 mm×0.6 mm,球管旋转时间为0.25 s。在工作站采用多平面重建(multi planar reformation,MPR)、最大密度投影(maximal intensity projection,MIP) 和容积重建技术(volume rendering,VR)等方法进行重建。
1.2.2 头颅MRI①采用飞利浦公司3.0 T Ingenia超导型全身磁共振扫描仪和32通道头部线圈,主要扫描序列及扫描参数如下。T1WI横断面:重复时间2000 ms,回波时间 20 ms,层厚 6 mm,层间距0.6 mm。T2WI横断面:重复时间4000 ms,回波时间90 ms,层厚6 mm,层间距0.6 mm。T2WIFLAIR横断面:重复时间9000 ms,回波时间120 ms,层厚6 mm,层间距0.6 mm。DWI横断面:重复时间3334 ms,回波时间98 ms,b值为0和1000 s/mm。②采用飞利浦公司1.5 T Interia超导型全身磁共振扫描仪和32通道头部线圈,主要扫描序列及扫描参数如下。T1WI横断面:重复时间650 ms,回波时间 15 ms,层厚6 mm,层间距0.6 mm。T2WI横断面:重复时间5288 ms,回波时间110 ms,层厚6 mm,层间距0.6 mm。T2WI-FLAIR横断面:重复时间 6000 ms,回波时间 120 ms,层厚6 mm,层间距0.6 mm。DWI横断面:重复时间3372 ms,回波时间87 ms,b值为0和1000 s/mm。
2 结果
2.1 一般资料 共纳入11例患者,男8例,女3例,年龄 58~85 岁,平均(71.36±7.96)岁。吸烟史 6例,饮酒史2例,高血压病6例,糖尿病4例,高脂血症3例,有冠心病2例,风湿性心脏病1例,心房颤动4例,脑出血病史1例,脑梗死病史1例。
2.2 首发症状 意识障碍6例(昏迷4例、昏睡1例、嗜睡1例),精神行为异常1例,头痛1例,头晕、呕吐1例,发作性视物模糊1例,言语困难、四肢乏力1例,头昏、行走不稳1例。
2.3 其他症状体征 病程中10例患者出现不同程度意识障碍,记忆力下降8例,眼球垂直凝视麻痹6例,言语减少5例,上睑下垂3例,瞳孔不等大4例,复视3例,呕吐3例,小便失禁2例,肢体轻瘫3例,锥体束征2例,发作性意识丧失1例,抽搐1例。入院时 GCS评分 5~15 分,平均(10.73±4.22)分,NIHSS 评分中位数为 6(0~36)分。见表 1。
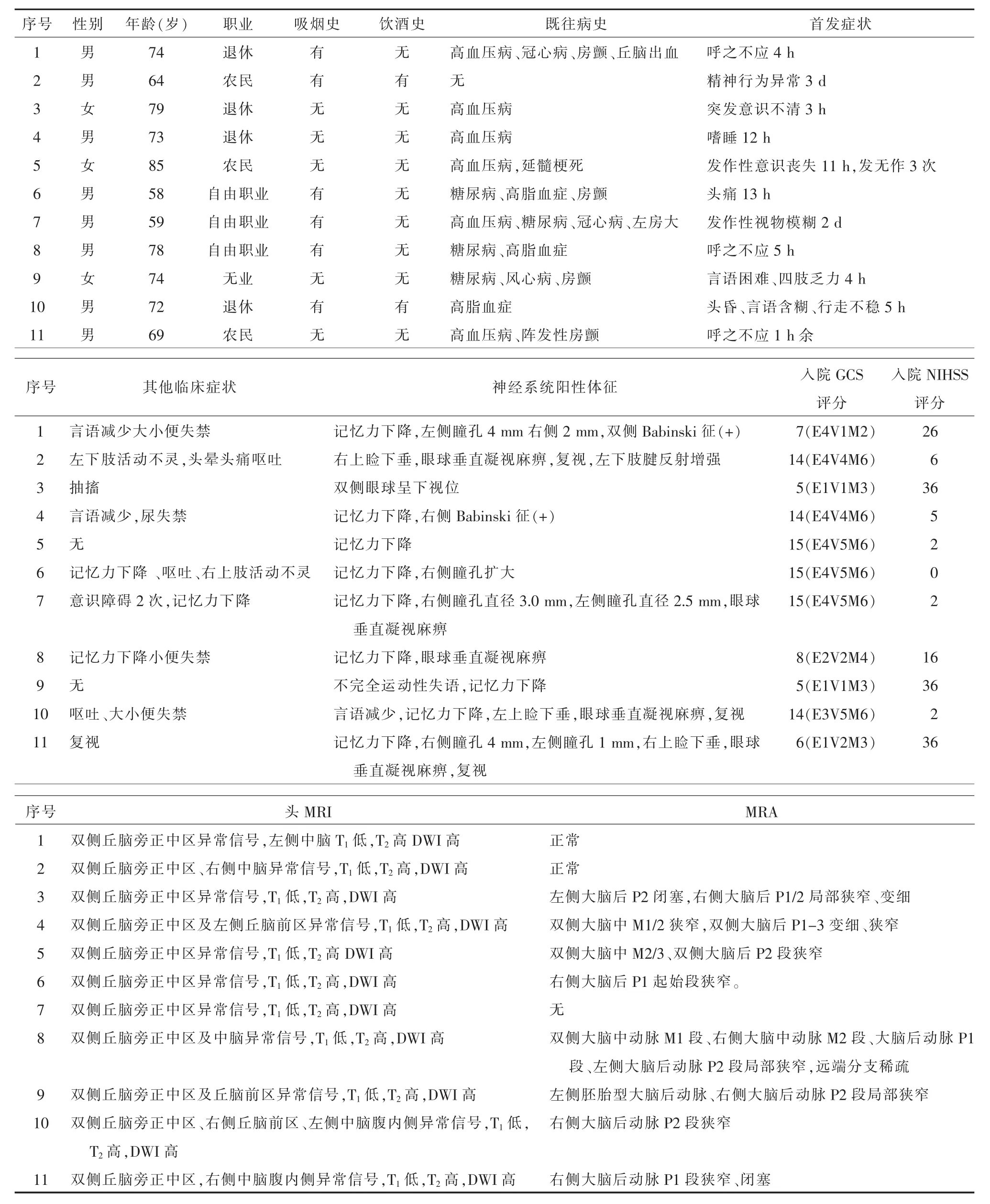
表1 11例Percheron动脉梗死患者临床资料

续表1
2.4 辅助检查 患者均行肝功能、肾功能、血糖、血脂、血常规、血沉、HIV抗体及梅毒抗体检测,5例行抗核抗体谱检测,患者均行心电图、头胸CT、头 MRI平扫及 DWI、FLAIR检查,10例行磁共振血管成像 (magnetic resonance angiography,MRA)检查,5例行磁共振静脉血管成像(magnetic resonance venography,MRV)检查,3例行头颈 CT血管造影成像(computer tomography angiography,CTA)检查。
入院时11例患者均行头CT检查,9例未发现丘脑病变,1例可见双侧丘脑低密度灶,1例左侧丘脑低密度灶。
11例患者分别于超急性期、急性期进行头MRI检查,均表现为双侧丘脑斑片状异常信号,5例患者合并中脑腹内侧异常信号,T1低信号,T2高信号,Flair高信号,DWI高信号,ADC低信号。病变累及丘脑旁正中部+中脑腹内侧部4例,见图1、2、8、11;病变仅累及丘脑旁正中部4例,见图3、5、6、7; 病变累及丘脑旁正中部+中脑腹内侧部+丘脑前部1例,见图10;累及丘脑旁正中部+丘脑前部2例,见图4、9。
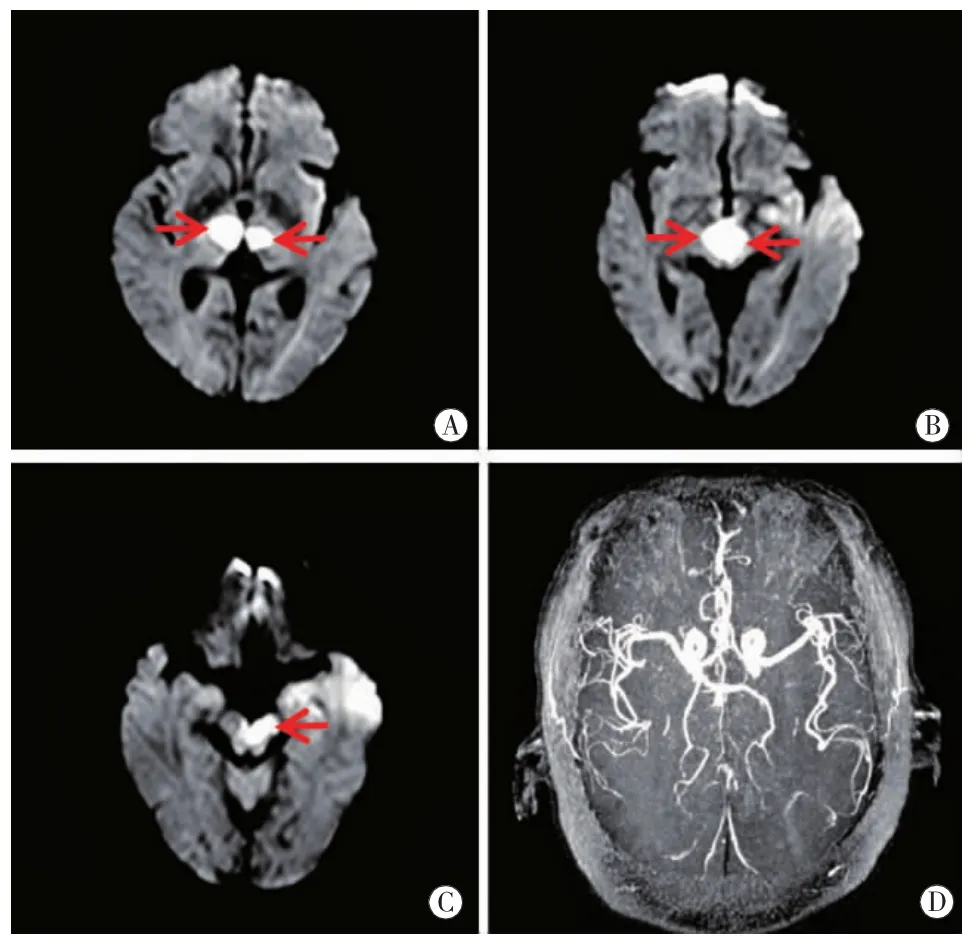
图1 病例1头颅MRI双侧丘脑旁正中区(图A、B红箭)、左侧中脑(图C红箭)DWI高信号,ADC值低。MRA(图D)正常。
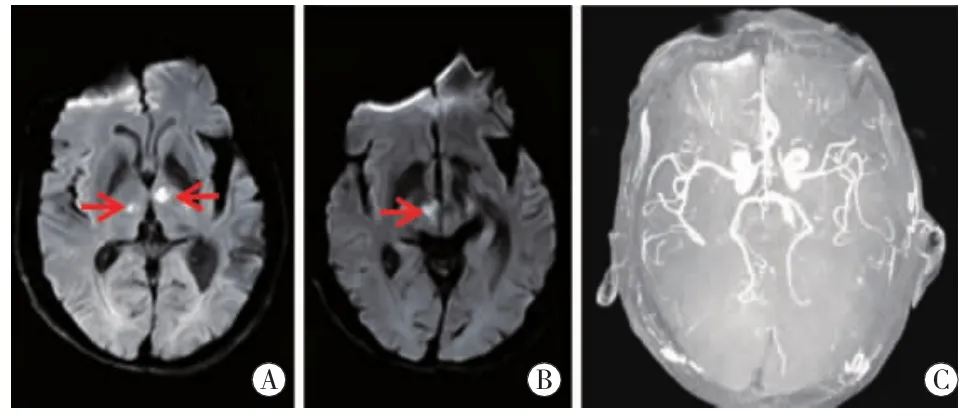
图2 病例2头颅MRI双侧丘脑旁正中区(图A红箭)、右侧中脑腹内侧(图B红箭)DWI高信号,ADC值低。MRA(图C)正常。
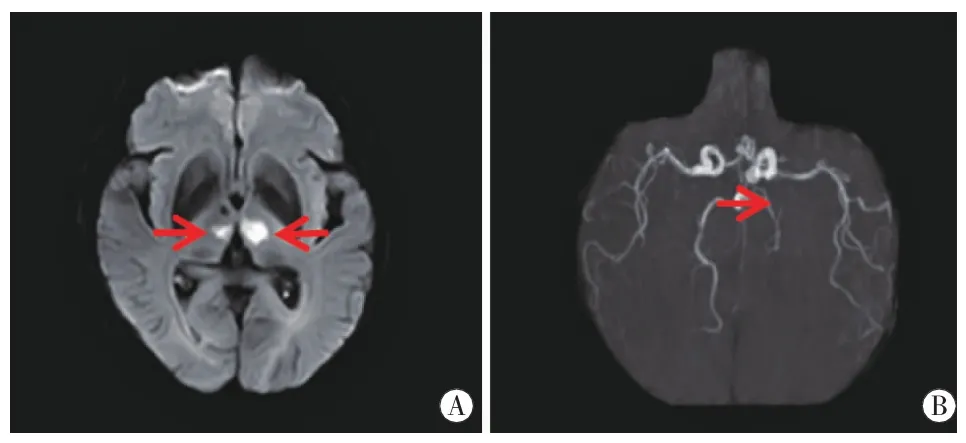
图3 病例3头颅MRI双侧丘脑旁正中区(图A红箭)DWI高信号,ADC值低,MRA右侧大脑后动脉P1(图B红箭)局部狭窄变细。
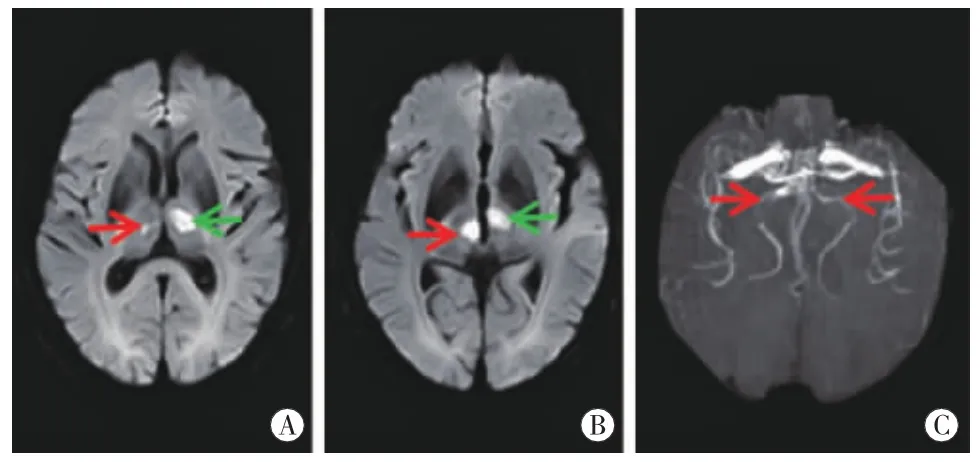
图4 病例4头颅MRI右侧丘脑旁正中区(图A、B红箭)、左侧丘脑前区 (图A、B绿箭)DWI高信号,ADC值低。MRA双侧大脑后动脉P1(图C红箭)变细、狭窄。
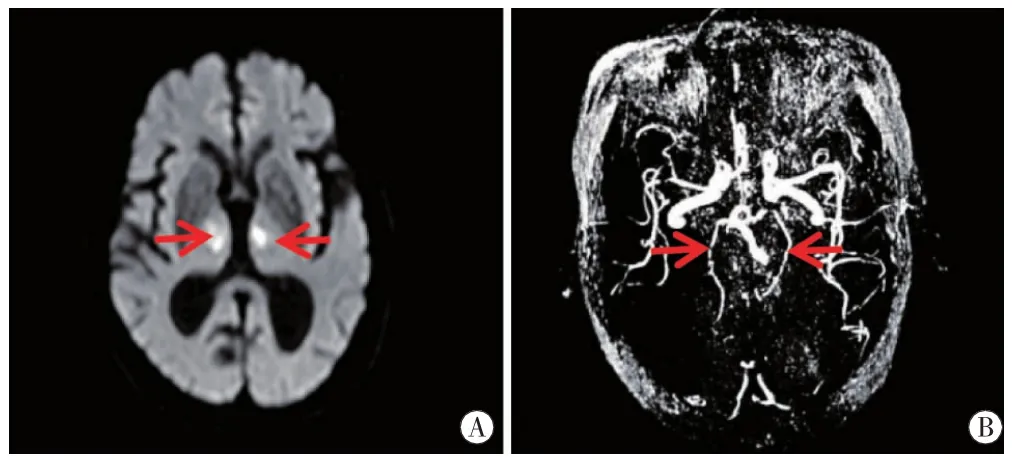
图5 病例5头颅MRI双侧丘脑旁正中区 (图A红箭)DWI高信号。MRA双侧大脑后P2(图B红箭)狭窄。
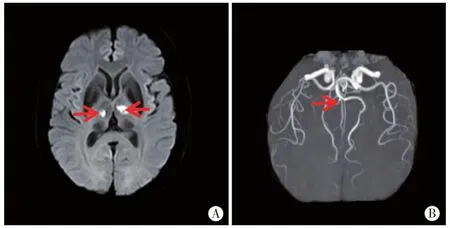
图6 病例6头颅MRI双侧丘脑旁正中区(图A红箭)DWI高信号,ADC值低。MRA右侧大脑后动脉P1起始段(图B红箭)狭窄。
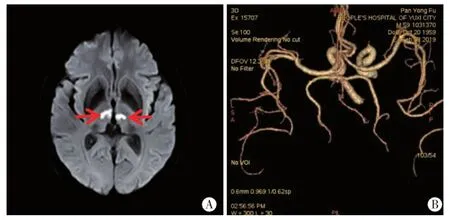
图7 病例7头颅MRI双侧丘脑旁正中区 (图A红箭)DWI高信号,ADC值低。CTA(图B)正常。
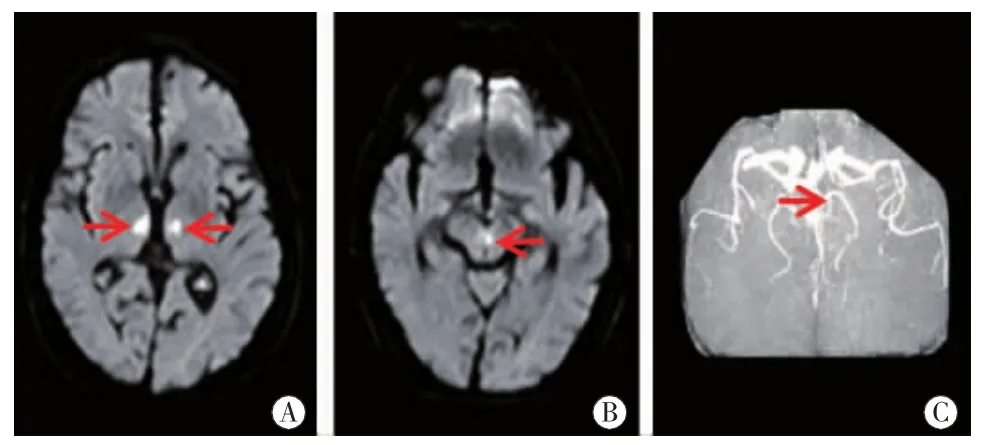
图8 病例8头颅MRI双侧丘脑旁正中区(图A红箭)及左侧中脑腹内侧(图B红箭)DWI高信号,ADC值低。MRA右侧大脑后动脉P1(图C红箭)狭窄。
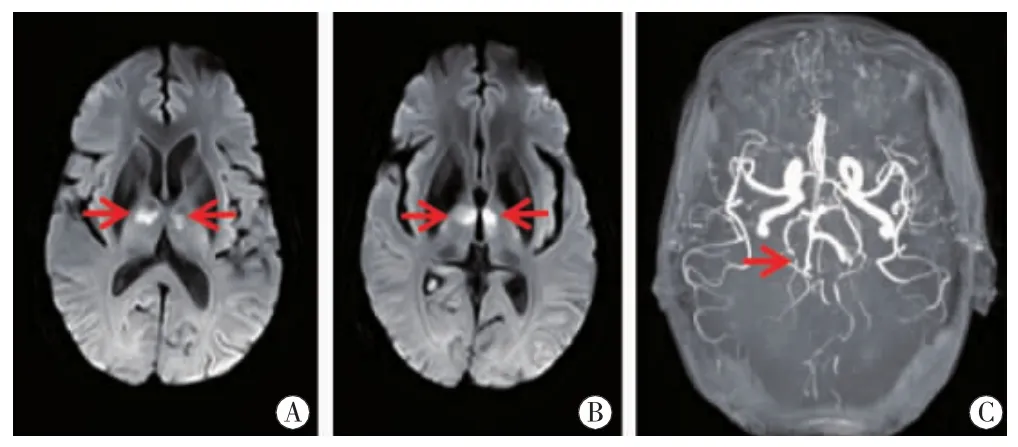
图9 病例9头颅MRI双侧丘脑旁正中区(图A红箭)及丘脑前区(图B红箭)DWI高信号,ADC值低。MRA右侧大脑后动脉P2狭窄。
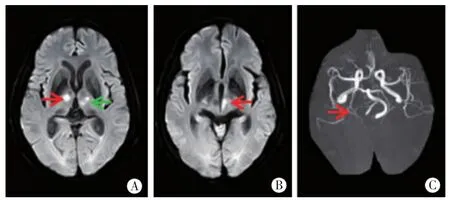
图10 病例10头颅MRI右侧丘脑前区(图A红箭)、左侧丘脑旁正中区(图A绿箭)及左侧中脑腹内侧(图B红箭)DWI高信号,ADC值低。MRA右侧大脑后动脉P2(图C红箭)狭窄。
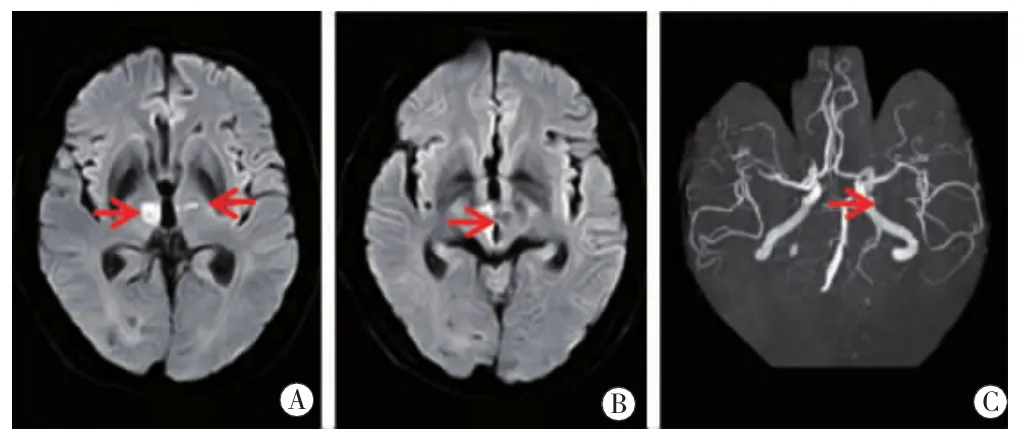
图11 病例11头颅MRI双侧丘脑旁正中区(图A红箭)、右侧中脑腹内侧(图B红箭)DWI高信号,ADC值低。MRA右侧大脑后动脉P1(图C红箭)闭塞。
10例患者行头MRA:一侧或双侧大脑后动脉P1段狭窄6例。2例患者行MRV均无异常。4例患者行头颈CTA检查:基底动脉末端栓子形成并双侧大脑后动脉起始段闭塞1例,右侧锁骨下动脉狭窄、大脑后动脉P2段狭窄1例,基底动脉扩张延长1例,正常1例。
2.5 TOAST分型 小动脉闭塞型3例,大动脉粥样硬化型4例,心源性栓塞3例,不明原因型1例。
2.6 治疗 所有患者使用阿司匹林和(或)氯吡格雷抗血小板聚集,低分子肝素或利伐沙班或华法林抗凝,阿托伐他汀或瑞舒伐他汀降脂、稳定斑块,控制血压、血糖及对症支持治疗,使用呼吸机3例,气管切开1例。
2.7 预后 出院时死亡1例,9例神志清楚,1例昏睡,6例记忆力下降,3例言语减少,1例复视,3例无明显症状。出院时mRs评分中位数0(0~6)分。
3 讨论
按血供来源,丘脑可分为4个部分:①下外侧部由丘脑膝状体动脉供应;②前部由丘脑结节动脉供应;③旁正中部由丘脑旁正中动脉供应;④后部由脉络膜后动脉供应[3]。Percheron动脉旁正中动脉先从单侧大脑后动脉发出,随后分成两支,同时为双侧丘脑旁正在区和中脑供血[4]。旁正中动脉可以同时供应丘脑旁正中部和丘脑前部,特别是在丘脑结节动脉缺失的情况下。丘脑结节动脉在30%~60%的人群中不存在,因为它起源于后交通动脉,后交通动脉本身具有高度的易变性,可以不存在或发育不全[5]。本组患者有3例病变累及丘脑前部,3例患者脑血管造影均显示后交通动脉缺如,提示丘脑旁正中动脉同时供血丘脑前部,而并非旁正中动脉和结节动脉同时梗死。
数字减影血管造影(digital subtraction angiography,DSA)很少显示 AOP,目前几项研究报告DSA上证明了这种变异[5-7]。有报告在CTA上显示AOP[8]。本组患者均行MRA和(或)CTA检查,但都未显示AOP,可能由于AOP闭塞或者太细小的原因[1]。有文献报告一侧胚胎型大脑后动脉可能是AOP梗死的潜在变异因素[9],但本组患者仅1例伴有胚胎型大脑后动脉。AOP梗死两个最常见的病因是小动脉闭塞和心源性栓塞[7,10-11]。本组患者TOAST分型大动脉粥样硬化型最多,病因的差异可能与本研究样本量过小以及种族和地域有关。
由于丘脑结构复杂,血管变异较多,以及解剖结构的变异和邻近血管区域的大小不同,每个区域的确切供血也有所不同[8],临床症状取决于病变累及的位置和范围。所以AOP梗死的临床表现复杂多样。最常见的是意识障碍,本组患者54.5%(6/11)以突发意识障碍为首发症状,90.9%(10/11)在病程中出现不同程度意识障碍,与文献报告相符[10,12-15]。意识障碍考虑由双侧髓板内核及中央正中核受累所致,髓板内核属于非特异性上行网状激活系统,是脑干网状激活系统的延伸,与唤醒和意识维持有关[16]。
出现肢体瘫痪、锥体束征、共济失调、瞳孔异常、眼睑下垂、垂直凝视麻痹通常提示中脑受累[5-6,17-18]。但垂直凝视麻痹也在无中脑损伤的患者中观察到,可能是由于皮层输入信号在穿过丘脑到达吻侧间质内侧纵束的途中被打断[5],本研究也观察到无中脑损伤但双侧眼球呈下视位的患者。
LAZZARO等[5]确定了AOP梗死四种模式:①累及双侧旁丘脑和中脑;②只累及旁丘脑;③旁丘脑、中脑上部、丘脑前部均受累;④旁丘脑和丘脑前部受。本组患者36%(4/11)病变累及丘脑旁正中部和中脑;36%(4/11)仅累及丘脑旁正中部;9%(1/11)累及丘脑旁正中部、中脑和丘脑前部;18%(2/11)累及丘脑旁正中部和丘脑前部。
AOP梗死急性期静脉溶栓的研究报告通过DWI-Flair不匹配而进行rt-PA静脉溶栓治疗,取得较好疗效[13,19-20]。亦有报告rt-PA静脉溶栓治疗效果欠佳者[21]。还有文献报告过超选择动脉溶栓后神经功能缺损明显改善[22]。而多数病例均因超急性期未能识别而错过溶栓治疗。目前未见到机械取栓治疗的病例。本组11例患者中有7例在血管开通治疗时间窗内到达医院,但均未及时识别而错过最佳治疗时机。
MRI可清晰显示丘脑、脑干结构,超早期DWI即可显示病变区高信号,MRI-DWI的应用,对早期诊断有非常重要的意义[1,23]。有文献报告CT灌注成像也可诊断超急性期AOP梗死[24]。提示血管开通治疗时间窗内的患者合理应用影像学检查,可使患者及早确诊和治疗。
研究显示没有累及中脑的AOP梗死结局通常是良好的[7]。XU等[25]认为如果涉及中脑或更大的梗死体积或发生出血转化,AOP梗死的结果常常是不利的。有部分患者需使用呼吸机,最终结局差,甚至死亡[11,14,26]。本组有3例患者使用呼吸机治疗,死亡1例,多数患者预后良好,出院时mRs评分中位数为0分。
总之,神经科医生和急诊室医生应提高警惕,凡遇急性起病的意识障碍、记忆力下降、眼球活动障碍患者,应考虑AOP梗死,结合病史体征进行鉴别诊断,必要时行急诊头MRI-DWI、FLAIR检查尽快确诊。

