番鸭源鸭疫里默氏杆菌的耐药性及rpoB基因突变分析
林彬彬,谢碧林,王秀祯,翁汉东,程龙飞,傅光华,刘荣昌,林志敏
(1. 莆田市农业科学研究所, 福建 莆田 351144;2. 福建省农业科学院畜牧兽医研究所, 福建 福州 350013)
0 引言
【研究意义】鸭疫里默氏杆菌(Riemerella anatipestifer,RA),属黄杆菌科(Flavobacteriaceae),革兰氏阴性,无芽孢,无鞭毛,可形成荚膜,能感染鸭、鹅[1]、火鸡和其他禽类,引起的传染性浆膜炎是影响全世界养鸭业的一种接触性、败血症型传染病[2]。主要感染1~8周龄的雏鸭,恶劣的环境和不良的饲养管理会增加该病的死亡率,最高可达75%[3],耐过鸭表现生长迟缓、料重比下降、消瘦和胴体品质下降。从分子水平研究鸭疫里默氏杆菌耐药性的机制机理,了解相关基因突变对鸭疫里默氏杆菌耐药性的影响具有重要意义。【前人研究进展】鸭疫里默氏杆菌血清型众多,疫苗对同血清型野毒的免疫保护较好,但如果流行的血清型发生变化,则免疫效果大打折扣,因此,抗生素仍然会被应用于该病的预防或治疗。然而,随着抗生素在养殖业中的广泛甚至不合理使用,鸭疫里默氏杆菌的耐药现象越来越严重,耐药谱也在不断扩大。不少学者也从分子水平上对鸭疫里默氏杆菌的耐药机制展开研究。Sun等[4]对中国南方地区的103株鸭疫里默氏杆菌分离株的研究发现,gyrA、parC基因的突变与鸭疫里默氏杆菌对喹诺酮产生耐药有关。Xing等[5]对中国80株鸭疫里默氏杆菌分离株的研究,发现鸭疫里默氏杆菌基因组多重耐药区中ermF、ermFU和ereD基因与红霉素抗性相关。利福平(Rifampicin,RFP)为利福霉素类半合成广谱抗菌药,对多种病原微生物均有抗菌活性,在许多兽医临床药物组方中广泛使用。然而,近些年来报道的鸭疫里默氏杆菌分离株对利福平的耐药情况呈逐渐上升趋势[6-7],利福平对传染性浆膜炎的治疗效果越来越差。有研究表明,细菌对利福平的主要耐药机制是由利福平耐药基因rpoB突变引起的[8],此外药物外排泵作用也是导致利福平耐药的机制之一[7]。【本研究切入点】莆田市是福建省小日龄水禽交易的集散地,年交易数量超亿羽,分析莆田地区鸭疫里默氏杆菌rpoB基因的突变情况,可以在一定程度上代表全省的流行情况及基因突变情况。【拟解决的关键问题】对鸭疫里默氏杆菌分离株rpoB基因序列进行比对分析,探究rpoB基因突变情况与鸭疫里默氏杆菌利福平耐药的相关性,为今后寻找新的药物靶点提供理论依据。
1 材料与方法
1.1 材料
1.1.1 病料来源 2019-2021年,收集莆田市荔城区、秀屿区等番鸭养殖场(户)疑似传染性浆膜炎的死亡番鸭,剖检见纤维素性心包炎、肝周炎和气囊炎,无菌采集脑部、心脏或肝脏等组织57份。
1.1.2 主要试剂 胰蛋白胨大豆琼脂(Tryptic Soy Agar,TSA)、胰蛋白胨大豆肉汤(Tryptic Soy Broth,TSB)、麦康凯琼脂,购自北京索莱宝科技有限公司;药敏纸片,购自杭州微生物试剂有限公司;新生胎牛血清,购自浙江天杭生物科技股份有限公司;细菌基因组DNA提取试剂盒、2×TaqPCR MasterMix、DL2000 DNA Marker、GeneRed核酸染料,购自天根生化科技有限公司。
1.1.3 试验仪器 电热恒温培养箱,DHP-9052,上海申贤;CO2培养箱,BPN-50CH,上海一恒;恒温摇床,SHZ-82A,国华企业;高速台式冷冻离心机,TGL-16M,湖南湘仪;PCR仪,Genesy96T,西安天隆;水平电泳仪,DYY-12,北京六一;凝胶成像分析系统,Gel Doc XR+,美国BIO-RAD;微量移液器,德国Eppendorf。
1.2 方法
1.2.1 细菌的分离鉴定 病料划线接种于TSA平板(含2%新生牛血清)上,置5%CO2培养箱中,37 ℃培养24~48 h,观察细菌生长情况。然后挑取单个典型菌落进行纯化培养。纯化后的菌落挑少量接种于麦康凯平板。纯化后的菌落经革兰氏染色镜检。挑纯化的菌落个数,接种于TSB(含2%新生牛血清)中,置37 ℃摇床中,160 r·min-1,震荡培养24 h。将菌液保存于30%甘油保存液中,置于-80 ℃冰箱保存。
1.2.2 菌株基因组DNA的提取 取纯化后的细菌培养液,参照细菌基因组DNA提取试剂盒说明书提取分离株的DNA,用100 μL TE缓冲液溶解所提取的DNA,放入-20 ℃冰箱储存备用。
1.2.3 引物设计与合成 参照文献[7,9]合成 RA 16S rDNA特异性引物、rpoB基因扩增引物,引物序列及相关反应参数见表1,引物由生工生物工程(上海)股份有限公司合成,稀释为10 μmol·L-1,冰冻保存备用。

表1 引物序列及相关参数Table 1 Primer sequence and related parameters
1.2.4 菌株的PCR鉴定 以RA 16S rDNA特异性引物进行菌株的鉴定,PCR反应体系为20 μL:2×TaqPCR MasterMix 10 μL;上下游引物各0.5 μL;模板DNA 1 μL;ddH2O 8 μL。PCR反应程序:96 ℃预变性5 min;94 ℃变性1 min,54 ℃退火50 s,72 ℃延伸1 min,30个循环;最后72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳,阳性扩增产物送生工生物工程(上海)股份有限公司测序,将所得测序结果在http://www.ncbi.nlm.nih.gov/blast在线分析。
1.2.5 菌株的耐药表型测定 根据CLSI(2018)[10]的要求,采用K-B纸片扩散法测定分离株对β-内酰胺类、氨基糖苷类、喹诺酮类、四环素类、酰胺醇类、大环内酯类、磺胺类、多肽类和利福霉素类等9类28种抗菌药物的敏感性。
用接种环挑取经纯化鉴定的菌落接种于TSB(含2%新生牛血清)液体培养基中,置37 ℃摇床中,160 r·min-1,培养24 h后,取少量培养液使用细菌比浊管和灭菌生理盐水调整菌液菌株含量约为1×108CFU。取100 μL调整后的菌液于TSA平板(含2%新生牛血清)上并用无菌涂布棒均匀涂布,待晾干数分钟后,用无菌镊子夹取不同的药敏纸片间隔一定距离贴于TSA平板上,置5%CO2培养箱中,37 ℃培养24 h,观察记录结果。结果参照CLSI(2018)标准判定各分离菌株对28种抗菌药物的敏感性。
1.2.6rpoB基因的扩增及分析 以rpoB基因扩增引物,扩增各分离株中的rpoB基因片段。PCR反应体系为50 μL:2×TaqPCR MasterMix 25 μL;上下游引物各1 μL;模板DNA 2 μL;ddH2O 21 μL。PCR反应程序:96 ℃预变性5 min;94 ℃变性1 min,50 ℃退火50 s,72 ℃延伸1 min,30个循环;最后72 ℃延伸10 min。扩增产物经1%琼脂糖凝胶进行电泳检测。阳性扩增产物送生工生物工程(上海)股份有限公司进行测序,利用DNASTAR Lasergene 7.0分子生物学软件中的Clustal W程序将所测序列及其翻译氨基酸序列与参考菌株的相应序列ATCC 11845(登录号:AFD56686.1)、CH3(登录号:AIH01966.1)、HXb2(登 录 号:AQY22366.1)、Yb2(登 录 号:AKQ39593.1)、RCAD0392(登录号:QOZ86257.1)进行比对,分析rpoB基因的突变位点。
2 结果与分析
2.1 细菌的分离鉴定结果
共分离到49株疑似鸭疫里默氏杆菌,在5%CO2培养箱中,37 ℃培养24 h,TSA平板(含2%新生牛血清)上,这些菌株均形成稍隆起于培养基表面、边缘整齐、半透明、直径为0.5~1.5 mm的圆形小菌落,经斜射光观察可见淡蓝色光泽;在麦康凯琼脂培养基上不生长;革兰氏染色镜检可见两端钝圆、单个或少数成对出现的革兰氏阴性短杆菌。在TSB液体培养基(含2%新生牛血清)内生长浑浊,底部有沉淀。
2.2 细菌的PCR鉴定结果
以RA 16S rDNA特异性引物进行PCR扩增,49株细菌均可扩增出与预期960 bp大小相近的单一条带,部分菌株的扩增结果见图1。测序获得的序列进行BLAST分析,结果显示,与鸭疫里默氏杆菌相似性均超过99%,确定所分离的49株菌株均为鸭疫里默氏杆菌。

图1 鸭疫里默氏杆菌的16S rDNA扩增结果Fig. 1 Electrophoretogram of 16S rDNA amplification of R. anatipestifer
2.3 细菌的耐药表型分析
49株鸭疫里默氏杆菌对9类28种抗菌药物的药敏试验结果见表2。按药物类别分析,分离菌株对氨基糖苷类和磺胺类全部耐药,对大环内酯类、多肽类和利福霉素类药物的耐药性也很高,对酰胺醇类、四环素类和β-内酰胺类药物的敏感性较高。按具体药物分析,49株菌株中,90%以上菌株敏感的药物有:头孢唑林、头孢曲松、头孢西丁、头孢他啶、头孢克肟、头孢吡肟、四环素、强力霉素和氟苯尼考等。本研究中,对利福平敏感的菌株只有5株,耐药的有44株,高达89.80%。
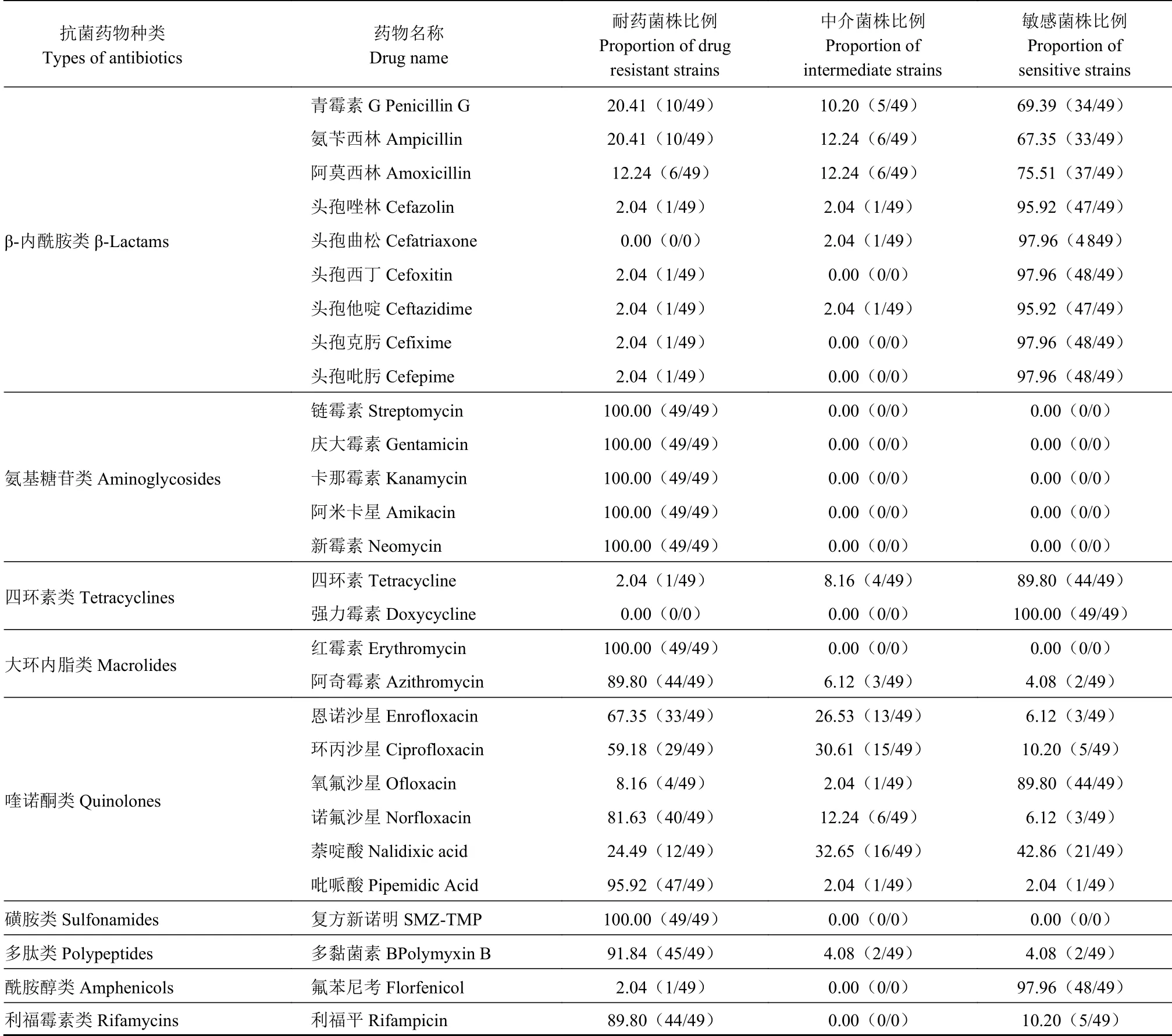
表2 49株鸭疫里默氏杆菌分离株对28种抗菌药物的药敏试验结果Table 2 Test results on drug sensitivity of 49 R. anatipestifer isolates to 28 antibiotics %
49株鸭疫里默氏杆菌分离株的多重耐药性情况见表3,所有分离株均表现为多重耐药性,耐药谱介于11~21种药物,主要集中在12~14种药物,对13种抗菌药物耐药的菌株最多,达34.69%。

表3 49株鸭疫里默氏杆菌分离株的多重耐药性Table 3 Multidrug resistance of 49 R. anatipestifer isolates
2.4 rpoB基因突变分析
以rpoB基因的特异性引物进行PCR扩增,49株分离菌均扩增出单一条带,位于783 bp处,如图2所示。测序后与RA参考序列rpoB基因氨基酸序列进行比对,发现48株分离株的利福平耐药决定区氨基酸出现了单点突变,突变类型有2种,分别为R494K、H491N;1株分离株的利福平耐药决定区氨基酸出现了双点突变,为V382I和R494K。R494K的单点突变最多见,共44株,占89.80%,其中43株耐利福平,1株对利福平敏感;H491N的单点突变有4株,占8.16%,均为利福平敏感菌;V382I和R494K的双点突变仅有1株,为利福平耐药菌(表4)。

表4 49株鸭疫里默氏杆菌耐药株rpoB基因突变位置Table 4 Mutation locations of rpoB gene in 49 resistant strains of R. anatipestifer

图2 鸭疫里默氏杆菌rpoB基因PCR电泳Fig. 2 Electrophoretogram of rpoB gene amplification of R. anatipestifer
3 讨论
近年来,养殖场鸭疫里默氏杆菌的感染发病呈不断上升趋势,番鸭的感染情况也在逐年增长[11-12]。本研究采集福建省莆田市番鸭养殖场(户)疑似发生鸭传染性浆膜炎死亡番鸭的脑、心脏、肝脏进行细菌分离纯化,并经16S rDNA的PCR鉴定,共分离鸭疫里默氏杆菌49株。
鸭疫里默氏杆菌血清型众多,但各血清型间缺乏有效的交叉保护,使得鸭疫里默氏杆菌疫苗免疫效果不佳,临床上常用药物来防治鸭传染性浆膜炎,但药物的不规范使用造成RA耐药菌株增多,多重耐药性的情况经常可见[13-15]。本研究发现,分离的49株鸭疫里默氏杆菌呈明显的广谱耐药性,耐药谱介于11~21种药物之间。程龙飞等[6]对2006-2012年间福建省及邻近省份分离的423株鸭疫里默氏杆菌的药敏试验结果表明,50%以上菌株对多黏菌素B、卡那霉素、复方新诺明、林可霉素、四环素、克林霉素、利福平和氟哌酸耐药,50%以上菌株对氟苯尼考、头孢拉定、头孢氨苄、阿莫西林、头孢唑啉和壮观霉素敏感。本研究分离的菌株,对多黏菌素B、卡那霉素、复方新诺明、利福平、诺氟沙星也是耐药的,但对四环素敏感。左春生等[16]对分离自河南省的14株鸭疫里默氏杆菌分离株的药敏试验结果表明,分离株对氟苯尼考、阿莫西林、磺胺异噁唑、多黏菌素B和多西霉素耐药性较高,对阿米卡星、链霉素和头孢曲松较为敏感。本研究分离的菌株,对多黏菌素B也是耐药的,但对氟苯尼考、强力霉素、头孢曲松的敏感性高,对阿米卡星、链霉素耐药。朱元军等[17]对分离自福建省的25株鸭疫里默氏杆菌的药敏试验结果表明,分离株对链霉素、庆大霉素、卡那霉素、阿米卡星、红霉素、环丙沙星等高度耐药,对四环素、强力环素和氟苯尼考的敏感性较强,本研究结果与其基本相近。由此可见鸭疫里默氏杆菌的耐药性已普遍存在,且由于时间和地点的不同,耐药性也存在一定的差异,警醒临床上应谨慎、合理地使用抗菌药物。
程龙飞等[6]对2006-2012年间福建省及邻近省份分离的423株鸭疫里默氏杆菌的利福平药敏试验发现,51%的菌株对利福平耐药。孙嘉凯[7]等对110株鸭疫里默氏杆菌的利福平耐药性测定发现,89%的菌株对利福平有不同水平的耐药性。而本研究对49株鸭疫里默氏杆菌的利福平药敏试验发现,89.80%的菌株对利福平耐药,表明鸭疫里默氏杆菌对利福平的耐药性已普遍存在且有所增强。现有研究表明,细菌的rpoB基因编码细菌RNA聚合酶β亚基,利福平能与RNA聚合酶β亚基结合,干扰细菌的RNA合成,而rpoB基因发生突变后,使得利福平无法与突变后的RNA聚合酶β亚基结合,从而导致细菌对利福平耐药,这是细菌对利福平的主要耐药机制之一[8]。鸭疫里默氏杆菌也存在这种情况,刁东雪[18]发现,4株利福平耐药鸭疫里默氏杆菌中,3株存在rpoB基因的单碱基突变,1株存在碱基的插入导致利福平耐药决定区氨基酸的突变。SUN等[19]对18株鸭疫里默氏杆菌rpoB序列的比较分析和利福平最低抑菌浓度的测定,发现利福平耐药决定区氨基酸的5个突变类型V382I、H491N、G502K、R494K和S539Y均与利福平耐药有关,而3个突变类型T930A、A937T和T993A与利福平耐药无关。刘玲俐等[20]将一株对利福平耐药的鸭疫里默氏杆菌(RA-WH9)rpoB基因与对利福平敏感的CH3、HXb2、Yb2进行多重序列比对,结果发现了5个利福平耐药决定区氨基酸的突变,即D481Y、S539Y、T930A、A937T、T993A,其中D481Y的突变是否与利福平耐药相关仍需进一步的研究。本研究中,44株利福平耐药菌的rpoB基因均没有出现缺失突变或插入突变,但其中43株出现了单点突变,利福平耐药决定区氨基酸的突变类型出现比例最高的为R494K(43/44);1株出现了双点突变,为R494K和V382I,这些突变均在SUN[19]等的报道中出现。但是本研究中,R494K和H491N两种单点突变类型也分别在1株和4株利福平敏感菌中发现,据此我们认为,利福平耐药决定区氨基酸的突变可能不是决定细菌对利福平耐药的唯一机制。根据突变类型的比例、耐药菌和敏感菌的数量,推测莆田市鸭疫里默氏杆菌对利福平耐药的主要机制之一是利福平耐药决定区氨基酸的R494K单点突变。
4 结论
本研究共分离到49株鸭疫里默氏杆菌菌株,呈明显的广谱耐药性,耐药谱介于11~21种药物之间,分离株对氨基糖苷类、大环内酯类、复方新诺明、多黏菌素B和利福平等药物的耐药性高,对四环素类、β-内酰胺类和氟苯尼考等药物的敏感性高。莆田市鸭疫里默氏杆菌对利福平耐药的主要机制之一是利福平耐药决定区氨基酸的R494K单点突变。

