T-2毒素激活活性氧/核转录因子-κB信号通路诱导猪空肠上皮细胞发生炎性反应
康瑞芬 王 猛 沈家鲲 金晓明 李春梅
(南京农业大学动物科技学院,南京210095)
霉菌毒素是由多种自然界中真菌产生的高度多样化的次级代谢产物,会污染食物和饲料,导致人和动物霉菌毒素中毒[1]。T-2毒素属于单端孢霉烯族A类化合物,主要由镰刀菌属产生,如梨孢镰刀菌、枝孢镰刀菌、拟孢镰刀菌和三线镰刀菌等[2]。在单端孢霉烯族霉菌毒素中,虽然T-2毒素的检出率较低,但其毒性最强,且广泛存在于大麦、小麦、燕麦和玉米等谷物中[3],严重危害家畜健康,影响畜牧业的发展,因此受到广泛关注。T-2毒素的产生及饲料和食品的污染程度与多种因素有关,如遗传因素、环境温湿度、底物温湿度和氧气含量[4]。作物在田间生长期间以及收割后储存不当均会产生T-2毒素。
T-2毒素在欧洲联盟国(EU)是谷物样品中常见的污染物,人和动物被暴露T-2毒素的风险大大增加,因此对人和动物的健康构成了威胁[5]。对来自22个欧洲国家的20 519个饲料和谷物样品进行检测,发现谷物中特别是燕麦和燕麦产品中存在T-2和HT-2毒素[6]。Gruber-Dorninger等[7]进行的10年全球饲料中真菌毒素含量调查中发现,19%的样品被T-2毒素污染。中国饲料样品中T-2毒素的污染率为79.5%,这些样品中T-2毒素的含量最高为735 ng/g[8]。Morcia等[9]报告指出,从2011年至2014年,意大利大麦样品中T-2毒素和HT-2毒素的阳性率在22%~53%。在对克罗地亚、波斯尼亚和黑塞哥维那的一项研究发现,在340个未加工燕麦样品中,T-2毒素的检出率为86.1%,T-2毒素的含量最高为304.2 μg/kg[10]。T-2和HT-2毒素也是英国有机和传统燕麦中最常检出的镰刀菌毒素,超标率分别为84%和92%[11]。
T-2毒素的主要毒性机制为通过与60S核糖体亚基上的肽基转移酶相互作用抑制蛋白质合成,诱导细胞发生核糖体应激反应,激活c-Jun N端激酶(JNK)/p38丝裂原活化蛋白激酶(p38 MAPK),参与机体的许多生理过程,如破坏细胞稳态,抑制细胞生长和分化,引起细胞凋亡[12]。小肠是营养物质主要的吸收部位,也是抵御外界物质的第1道物理屏障,对维持动物的健康至关重要[13]。猪空肠上皮细胞(intestinal porcine epithelial cells, IPEC-J2)是从没有喂食的新生仔猪空肠中分离的细胞系,保留了肠道上皮的性质,可作为研究肠上皮固有功能的简便模型[14]。该细胞系具备非转化、非致瘤的特点,可分泌黏液素,产生细胞因子和趋化因子[15],表达与免疫系统相关的蛋白质,例如粒细胞-巨噬细胞集落刺激因子(GM-CSF)和肿瘤坏死因子-α(TNF-α)[16]。因此,IPEC-J2被广泛用于研究外源物质对肠道免疫功能、通透性和创伤后愈合能力的影响[17-18]。Pinton等[19]发现动物摄入T-2毒素污染的饲料后,会诱发胃肠道发生坏死性病变。Goossens等[20]发现T-2毒素处理IPEC-J2,会降低细胞跨膜电阻(TEER)值,增加细胞通透性,破坏肠道屏障。Verbrugghe等[21]发现T-2毒素处理IPEC-J2,鼠伤寒沙门氏菌跨IPEC-J2单层的转运明显增加,说明细胞屏障被破坏。Romero等[22]发现T-2毒素降低结直肠腺癌细胞(Caco-2)的TEER值以及紧密连接相关基因的转录水平。
研究表明,大部分霉菌毒素的毒性由氧化应激介导[23- 24],氧化应激会引起肠上皮细胞凋亡,诱导肠道发生炎性反应[25]。N-乙酰-L-半胱氨酸(NAC)是一种含硫醇的抗氧化剂,能够有效清除活性氧(ROS),有助于维持细胞内的氧化和抗氧化平衡[26]。据报道,NAC可以保护细胞免受氧化应激,抑制肠道损伤,降低肠道脂质过氧化和自由基水平,促进抗氧化酶活性的恢复[27]。目前,关于T-2毒素诱导的肠屏障功能异常的确切机制尚不清楚,其毒性作用是否和氧化应激有关有待验证。因此,本试验以IPEC-J2为试验对象,旨在揭示T-2毒素对肠道的损伤机理,为防御T-2毒素对人和动物肠道损伤提供一定的理论依据。
1 材料与方法
1.1 细胞的来源与培养
IPEC-J2购买自北京北纳创联生物有限公司。细胞完全培养基由DMEM高糖培养基、10%胎牛血清(FBS)和1%抗生素(10 kU/mL青霉素、10 mg/mL链霉素和25 μg/mL两性霉素B)组成。将细胞在37 ℃的培养箱中培养,连续供应5%的CO2。
1.2 试验试剂及仪器
T-2毒素购自北京百灵威科技有限公司;DMEM高糖培养基、胎牛血清、抗生素购自美国GIBCO公司;NAC、四甲基偶氮唑盐(MTT)试剂盒、ROS试剂盒、过氧化氢酶(CAT)试剂盒、丙二醛(MDA)试剂盒和总超氧化物歧化酶(T-SOD)试剂盒均购自南京建成生物研究所;抗体核转录因子-κB(NF-κB)购自美国Abcam公司;反转录试剂盒、荧光定量PCR试剂盒购自南京擎科生物科技有限公司。
CO2细胞培养箱、全波长酶标仪购自美国Thermo公司;LSM700激光共聚焦显微镜购自德国Zeiss公司;梯度PCR热循环仪购自日本TaKaRa公司;荧光定量PCR仪购自美国ABI公司。
1.3 细胞活力测定
细胞传代后,待细胞融合度达到80%,将细胞消化下来,进行细胞计数并将细胞悬液进行稀释。细胞以1×105个/mL浓度接入96孔板,待细胞融合度达到80%,用不同浓度(0、0.5、1.0、1.5、2.0、3.0和4.0 ng/mL)的T-2毒素处理处理细胞12、24、48 h,参照MTT试剂盒说明书进行细胞活力测定,以确定适宜的T-2毒素浓度和处理时间。
1.4 试验设计与处理
以IPEC-J2为模型细胞,试验分为4个组,分别为对照组(Con组)、NAC组(4.0 mmol/L NAC)、T-2组(4.0 ng/mL T-2毒素)和T-2+NAC组(4.0 ng/mL T-2毒素+4.0 mmol/L NAC)。T-2毒素溶于二甲基亚砜(DMSO)并配制成1 mg/mL的贮存液于-20 ℃保存,用基础培养基稀释到4.0 ng/mL并于4 ℃保存。NAC用灭菌双蒸水配制成0.5 mmol/L的贮存液,置于4 ℃保存。将消化后的细胞以均等浓度接种到96孔板或6孔板(不同试验,接种板不同),当细胞融合度达到80%时,用含有相应试剂的培养基替代基础培养基,继续培养12 h,进行后续试验操作。
1.5 实时荧光定量PCR检测炎症相关基因的相对表达量
细胞以2×105个/mL浓度接入6孔板,待细胞融合度达到80%,用T-2毒素和NAC溶液处理细胞12 h后,吸掉培养基,PBS清洗3次,每孔加1 mL Trizol,将细胞裂解下来,裂解液和细胞一起装入2 mL离心管,离心机离心(4 ℃,3 500 r/min,15 min)。取上清液放入新的2 mL离心管,加0.2 mL氯仿混匀静置5 min,放入离心机离心(4 ℃,12 000 r/min,15 min),取上清液放入新的2 mL离心管,与上清液等体积加入异丙醇,混匀静置10 min,离心机离心(4 ℃,12 000 r/min,10 min)。弃去上清,加入1 mL 75%乙醇轻轻震荡洗涤沉淀,离心机离心(4 ℃,7 500 r/min,5 min)。弃去上清,将装有沉淀的离心管放入超净台,打开分机吹干沉淀,加入50 μL焦碳酸二乙酯(DEPC)水溶解沉淀并用枪轻轻吹打均匀。测定细胞RNA浓度后,按照2×TSINGKE Master Mix反转录试剂盒说明书对RNA进行反转录,获得cDNA;测得cDNA浓度后,将各样品cDNA浓度稀释到100 ng/μL,cDNA放于-20 ℃保存用于后续试验。按照2×T5 Fast qPCR Mix(SYBR Green I)试剂盒说明书加入各反应试剂,在实时荧光定量PCR仪上进行检测。试验数据采用2-△△Ct法进行相对定量计算,各个基因引物序列见表1。

表1 引物序列
1.6 细胞ROS水平测定
首先将细胞爬片放入12孔板,打入100 μL浓度为2×105个/mL的细胞悬液,待细胞贴壁后,再打入1 mL培养基,培养至细胞融合度达到80%,用T-2毒素和NAC溶液处理细胞12 h,测定细胞ROS水平,测定方法参照ROS检测试剂盒说明书。
1.7 细胞抗氧化指标检测
细胞以2×105个/mL浓度接入6孔板,待细胞融合度达到80%,用T-2毒素和NAC溶液处理细胞12 h后,用细胞刮板将细胞刮下来,和培养基一起放入新的2 mL离心管,离心机离心(4 ℃,1 500 r/min,5 min),收集上清液,放于-20 ℃保存。测定细胞T-SOD、CAT活性和MDA含量,测定方法参照相应的试剂盒说明书。
1.8 免疫荧光检测蛋白相对表达量
首先将细胞爬片放入12孔板,打入100 μL浓度为2×105个/mL的细胞悬液,待细胞贴壁后,再打入1 mL培养基,培养至细胞融合度达到80%,用T-2毒素和NAC溶液处理细胞12 h。吸出培养基,每孔加入1 mL磷酸盐缓冲液(PBS),置于摇床上清洗3次,每次5 min;移除PBS,加1 mL 4%多聚甲醛,室温固定1 h,吸掉多聚甲醛,加入PBS,摇床清洗,重复3次,每次5 min;加入100 μL TritonX-100(0.5%)通透10 min,PBS清洗3次,每次5 min;加入1 mL 1%牛血清白蛋白(BSA),室温封闭1 h;滴加50 μL一抗到盖玻片上,于湿盒中避光孵育(37 ℃,1 h);PBS清洗3次,每次5 min;滴加50 μL Alexa Fluor 488标记的二抗,于湿盒中避光孵育(37 ℃,1 h);吸掉二抗,加入PBS,摇床清洗,重复3次,每次5 min;滴加50 μL 4′,6-二脒基-2-苯基吲哚(DAPI),湿盒中避光孵育(室温,10 min),PBS清洗3次,每次5 min;载玻片上滴加荧光抗淬灭剂,将细胞爬片倒置在载玻片上进行封片,激光共聚焦显微镜检测荧光强度并拍照记录。
1.9 数据统计与分析
数据分析用GraphPad Prism 6.01软件完成。首先进行单因素方差分析(one-way ANOVA),然后进行Tukey多重比较检验,结果表示为平均值±标准误(mean ± SE)。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 T-2毒素对IPEC-J2活力的影响
为了确定T-2毒素对IPEC-J2的毒性,用不同浓度的T-2毒素(0、0.5、1.0、1.5、2.0、3.0和4.0 ng/mL)处理细胞12、24、48 h后检测细胞活力。如图1所示,随着T-2毒素浓度增加,细胞活力降低,且处理时间越长,细胞活力越低。与0 ng/mL T-2毒素相比,1.5、2.0、3.0和4.0 ng/mL T-2毒素处理细胞12、24、48 h后,细胞活力显著或极显著降低(P<0.05或P<0.01)。其中,4.0 ng/mL T-2毒素处理细胞12 h后,细胞活力为74.5%;处理细胞24 h后,细胞活力为49.5%;处理细胞48 h后,细胞活力低至45.5%。因此,本试验选择的T-2毒素浓度和处理时间分别为4.0 ng/mL和12 h。
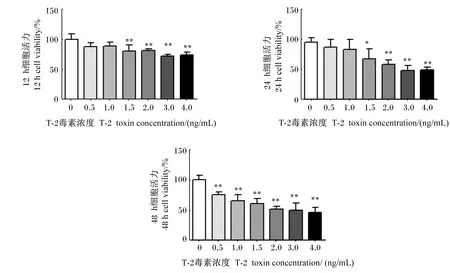
*表示与0 ng/mL T-2毒素相比差异显著(P<0.05),**表示与0 ng/mL T-2毒素相比差异极显著(P<0.01)。
2.2 抗氧化剂NAC浓度筛选
如图2所示,与对照组相比,T-2组细胞活力极显著降低(P<0.01);T-2+1 mmol/L NAC、T-2+2 mmol/L NAC、T-2+4 mmol/L NAC组细胞活力均无显著差异(P>0.05)。T-2+4 mmol/L NAC组细胞活力高于T-2+1 mmol/L NAC和T-2+2 mmol/L NAC组(P>0.05)。因此,本试验选择4 mmol/L NAC作为后续试验浓度。

1、2、4 NAC分别表示1、2、4 mmol/L NAC;**表示与对照组相比差异极显著(P<0.01)。
2.3 T-2毒素对IPEC-J2中炎症相关基因表达的影响
如图3所示,与对照组相比,T-2组IPEC-J2中TNF-α mRNA相对表达量显著升高(P<0.05),NAC、T-2和T-2+NAC组IPEC-J2中白细胞介素-6(IL-6)mRNA相对表达量极显著升高(P<0.01),T-2+NAC组IPEC-J2中白细胞介素-10(IL-10)mRNA相对表达量显著升高(P<0.05)。
2.4 T-2毒素对IPEC-J2中ROS水平的影响
如图4所示,与对照组相比,T-2组IPEC-J2中ROS水平极显著升高(P<0.01)。与T-2组相比,T-2+NAC组IPEC-J2中ROS水平显著降低(P<0.05)。
2.5 T-2毒素对IPEC-J2中抗氧化指标的影响
如图5所示,与对照组相比,T-2组IPEC-J2中CAT和T-SOD活性极显著降低(P<0.01),IPEC-J2中MDA含量极显著升高(P<0.01)。与T-2组相比,T-2+NAC组IPEC-J2中CAT和T-SOD活性极显著升高(P<0.01),IPEC-J2中MDA含量极显著降低(P<0.01)。

*表示与对照组相比差异显著(P<0.05),**表示与对照组相比差异极显著(P<0.01)。下图同。
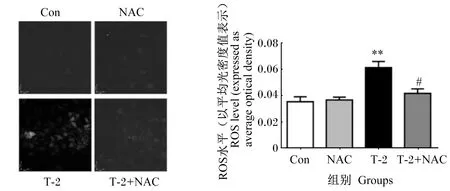
#表示与T-2组相比差异显著(P<0.05),##表示与T-2组相比差异极显著(P<0.01)。下图同。
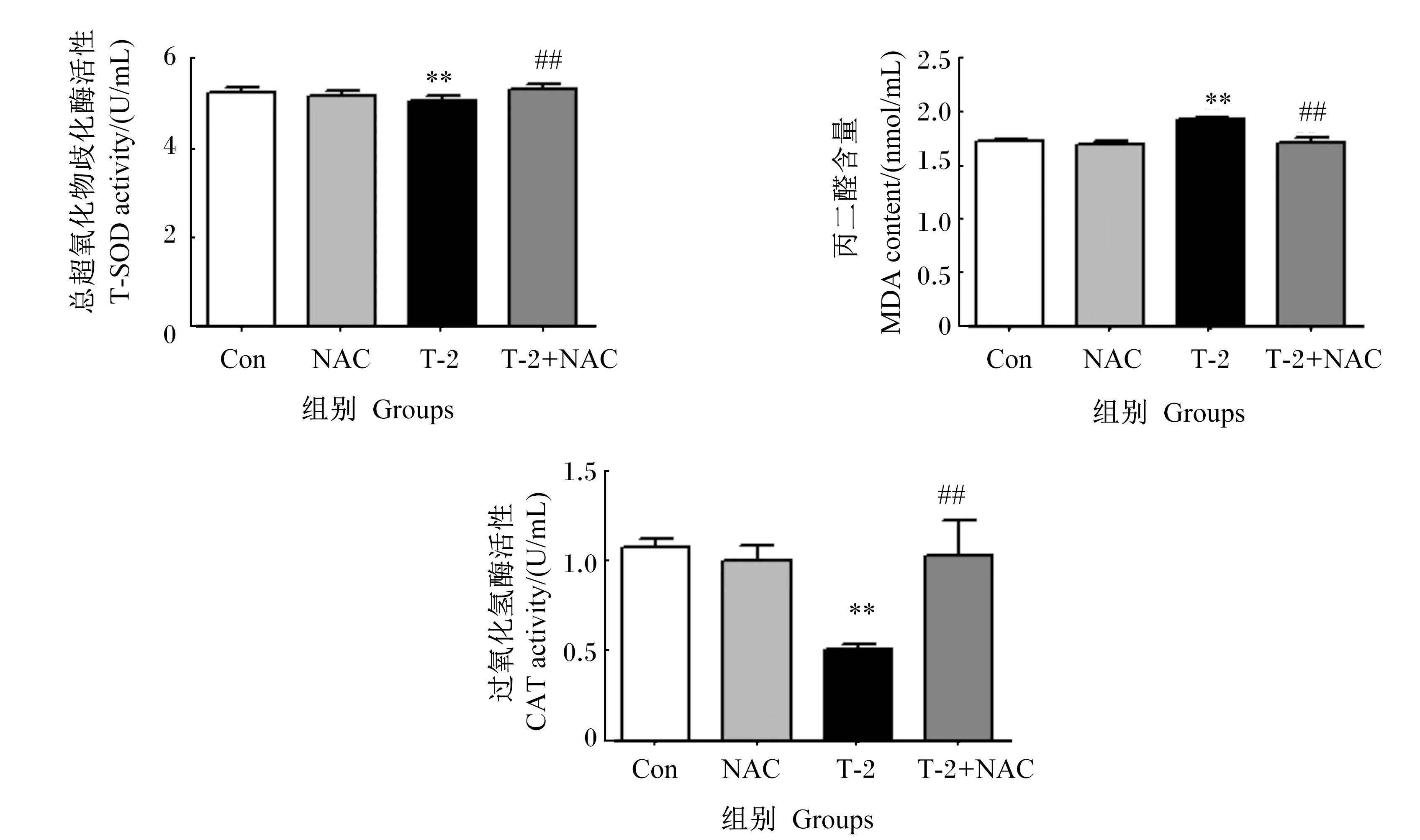
图5 T-2毒素对IPEC-J2中抗氧化指标的影响
2.6 T-2毒素对IPEC-J2中NF-κB蛋白表达的影响
如图6所示,与对照组相比,T-2组IPEC-J2中NF-κB蛋白相对表达量极显著升高(P<0.01)。与T-2组相比,T-2+NAC组IPEC-J2中NF-κB蛋白相对表达量极显著降低(P<0.01)。
3 讨 论
肠道是机体的第1道物理屏障,动物摄入被霉菌毒素污染的饲料后,胃肠道可能暴露于高浓度的霉菌毒素中,引起胃肠道损伤。IPEC-J2是一种永生的肠细胞系,可在体外保持分化特征,与原代肠上皮细胞高度相似[28]。此外,IPEC-J2保留了其上皮的性质,可模拟肠道上皮先天免疫功能,分泌黏蛋白,产生细胞因子和趋化因子[15],常被用于研究肠道病原体与宿主的相互作用、猪特异性病原体的生成以及先天免疫反应[16,29]。

图6 T-2毒素对IPEC-J2中NF-κB蛋白表达的影响
体外细胞活力测定在预测毒素毒性中起着核心作用。研究表明,不同浓度的T-2毒素处理IPEC-J2,细胞活力显著降低,而且T-2毒素浓度越高,细胞活力越低[20],这与本试验的研究结果一致。细胞氧化应激主要表现为细胞ROS水平增加,抗氧化能力降低,如T-SOD、CAT和谷胱甘肽过氧化物酶(GPx)等抗氧化酶活性降低,MDA含量增加,脂质过氧化程度增加[30]。在本试验中,T-2毒素极显著降低了IPEC-J2中CAT和T-SOD活性,极显著升高了IPEC-J2中MDA含量,极显著增加IPEC-J2中ROS水平,从而导致氧化应激并使细胞发生炎性反应。与T-2毒素单独处理相比,T-2+NAC处理可以极显著降低IPEC-J2中ROS水平,极显著升高IPEC-J2中CAT和T-SOD活性,极显著降低IPEC-J2中MDA含量,减缓细胞的氧化应激和炎性反应。上述结果表明,T-2毒素诱导IPEC-J2发生炎性反应主要通过诱导ROS的过量产生,破坏氧化平衡,导致肠上皮细胞发生氧化应激。
NF-κB参与诱导多种基因的表达,在调控肠道免疫和炎性反应的多种基因的表达中起着核心作用。细胞因子和病原体刺激细胞表面受体启动信号级联反应,从而激活NF-κB驱动细胞增殖以及抗坏死因子分子和细胞因子释放,以激活免疫应答[31]。同时,NF-κB调控不同类型的免疫细胞的分化,驱动单核细胞分化为巨噬细胞,M1巨噬细胞产生白细胞介素-1β(IL-1β)、IL-6、TNF-α和其他促炎细胞因子,M2巨噬细胞产生抗炎因子IL-10[32]。IL-6是典型的多效细胞因子,由淋巴样和非淋巴样细胞(包括上皮细胞、成纤维细胞和肌肉细胞)产生,参与调控免疫应答,在许多类型的肠道炎症和手术损伤中均观察到IL-6的过量表达[33-34]。在本试验中,T-2毒素处理IPEC-J2 12 h后,NF-κB蛋白相对表达量极显著增加,细胞中促炎细胞因子IL-6和TNF-α的mRNA相对表达量显著或极显著升高,这与其他霉菌毒素对IPEC-J2的研究结果[25]一致。与T-2组相比,T-2+NAC组的IPEC-J2中NF-κB蛋白相对表达量极显著降低,抗炎因子IL-10的mRNA相对表达量升高,TNF-α和IL-6的mRNA相对表达量降低。以上研究结果表明,T-2毒素诱导IPEC-J2产生过量ROS,从而激活NF-κB蛋白的表达,促进炎症因子的释放,引起炎性反应。如图7所示,T-2毒素通过ROS/NF-κB信号通路诱导IPEC-J2发生炎性反应。

IPEC-J2:猪空肠上皮细胞 intestinal porcine epithelial cells;NAC:N-乙酰-L-半胱氨酸 N-acetyl-L-cysteine;ROS:活性氧 reactive oxygen species;NF-κB:核转录因子-κB nuclear factor-κB;IL-6:白细胞介素-6 interleukin-6;IL-10:白细胞介素-10 interleukin-10;TNF-α:肿瘤坏死因子-α tumor necrosis factor-α。
4 结 论
T-2毒素通过诱导IPEC-J2产生过量的ROS,促进炎症相关基因和NF-κB蛋白的表达,导致IPEC-J2发生炎性反应。当利用NAC抑制细胞产生ROS,可明显抑制T-2毒素诱导的细胞炎性反应。

