氨氮胁迫下饥饿与复投喂对黄颡鱼肝脏中脂质代谢相关酶活性及相关基因表达的影响
刘嘉欣 张木子 黎 明 谢雨欣 钱云霞 王日昕
(宁波大学海洋学院,宁波315211)
集约化养殖模式下,饲料残渣和动物排泄物的大量积累,极易导致细菌增殖、缺氧、氨氮及亚硝酸盐胁迫[1]。其中,氨氮极难从养殖水体中除去,高浓度的氨氮将严重影响养殖动物的产量和品质。当鱼类处于低氨氮环境中,通常会在细胞和亚细胞水平上缓解氨中毒造成的不良反应,但环境中氨氮浓度达到较高水平时,由于外源氨氮的不断涌入,会造成血氨浓度持续(或瞬间)升高,继而表现出各种氨中毒症状[2],包括生长性能下降[3-4]、鳃组织增生、肝脏病变[5]、免疫应答受到抑制、病原易感性上升[6-7]、脑疝,甚至死亡。目前,有关氨中毒的研究在许多鱼类上已有报道,如许氏齿弹涂鱼(Periophthalmodonschlosseri)、薄氏大弹涂鱼(Boleophthalmusboddaerti)[2]、尼罗罗非鱼(Oreochromisniloticus)[8]、鳙鱼(Hypophthalmythysnobilis)[9]、草鱼(Ctenophynodonidellus)[10]和鲫鱼(Carassiusauratus)[11]等。
先前的研究发现,当环境氨氮浓度升高时,部分鱼类能够通过停止摄食或减少摄食量以降低内源性氨氮的产生[12]。正因为如此,企业采用减少投饲量或短期停止投食的策略,以降低养殖鱼类氨中毒造成的不利影响[13]。正常生理状态下,处于饥饿中的鱼类能够通过分解自身储存的营养物质以满足生存的需要,当食物充足时,则会表现出异于常态的补偿生长现象[14-15],包括超补偿生长[16]、完全补偿生长[17-18]和部分补偿生长[19]。然而,在氨氮胁迫下,饥饿后恢复摄食是否仍会表现出补偿生长效应,迄今尚不十分清楚。弄清这个问题,对于集约化养殖投喂模式的完善具有十分重要的意义。
脂质是生命活动主要的能源物质,在各项生理、发育和生殖活动中扮演着不可或缺的角色[20-21]。Li等[22]发现,氨氮胁迫导致黄颡鱼(Pelteobagrusfulvidraco)全鱼粗脂肪含量显著降低,表明氨氮胁迫动员了机体的能量储备,导致体增重减少;Zhang等[23]发现,氨氮胁迫导致黄颡鱼肝脏6-磷酸葡萄糖酸脱氢酶(6PGD)和脂肪酸合酶(FAS)活性显著降低,并与6PGD和FASmRNA的表达量结果是一致的,而肉碱棕榈酰转移酶2(CPT2)和脂蛋白脂酶(LPL)mRNA的表达量显著升高,表明能量需求的增加,提示氨氮胁迫影响了脂质代谢平衡;覃川杰等[24]发现,饥饿胁迫会降低瓦氏黄颡鱼(Pelteobagrusvachelli)机体脂肪含量,改变肌肉及肝脏等组织脂肪酸的组成模式;Tian等[25]发现,饥饿胁迫显著增强罗非鱼肝脏LPLmRNA的表达,复投喂后则出现显著下降,这是因为肝脏中LPL分解甘油三酯生成脂肪酸和甘油,以满足机体对能量的需求。上述研究表明,氨氮胁迫和饥饿胁迫均会提高鱼类脂质分解代谢,而复投喂则促进脂质合成代谢,那么,氨氮胁迫下饥饿复投喂对鱼类脂质代谢会造成怎样的影响,迄今尚未见到报道。
黄颡鱼是一种杂食性淡水鱼类,因其肉质鲜美、富含人体所需多种氨基酸而深受广大老百姓喜爱。据《2020中国渔业统计年鉴》权威发布,截止2019年,全国黄颡鱼总产量达536 964 t[26],已成为我国重要的淡水养殖品种之一。近年来,随着养殖规模的不断扩大,氨氮胁迫对黄颡鱼养殖产业造成的负面影响逐渐凸显,然而,迄今尚未找到有效的解决手段[27]。本试验以黄颡鱼为研究对象,评估氨氮胁迫下饥饿与复投喂对其肝脏中脂质代谢酶活性及相关基因表达的影响,以期为黄颡鱼养殖投喂管理提供理论依据。
1 材料与方法
1.1 试验设计
黄颡鱼幼鱼购自浙江省湖州市,暂养14 d后,随机挑选360尾健康活泼、大小均匀的黄颡鱼幼鱼[初始体重为(14.95±0.03) g]分配到12个300 L塑料养殖桶中,每桶30尾。参考Li等[28]报道的黄颡鱼氨氮暴露安全浓度,设置2个氨氮处理:低氨氮处理,总氨氮浓度<0.01 mg/L,非离子氨浓度<0.001 mg/L,该浓度下黄颡鱼未受氨氮胁迫;高氨氮处理,总氨氮浓度5.70 mg/L,非离子氨浓度0.10~0.12 mg/L,该浓度下黄颡鱼受到氨氮胁迫。表观氨氮浓度以新配的10 g/L氯化铵(NH4Cl)为母液,每隔7 h进行调整,水体中总氨氮浓度采用YSI ProPlus多参数水质测定仪进行检测。2个氨氮处理内各设置1个对照组和1个试验组,每组分配3桶试验鱼,采用人工饱食投喂的方式,对照组投喂商业饲料(粗蛋白质含量40.50%,粗脂肪含量7.15%,粗灰分含量8.16%,水分含量10.53%)42 d;试验组饥饿14 d后,复投喂商业饲料28 d。整个试验期间,养殖用水为除氯自来水,日换水量为总体积的1/3,水温24.5~29.5 ℃,pH 6.7~7.0,溶解氧浓度(7.83±0.12) mg/L,亚硝酸盐浓度<0.5 mg/L,保持自然光照。
1.2 样品采集
分别于试验开始后第14和42天时进行取样。每次取样前禁食24 h,采用120 mg/L MS-222麻醉,每个养殖桶中随机挑选3尾试验鱼,分别解剖取出肝脏,液氮速冻,-80 ℃储存,用于脂质代谢相关基因mRNA表达量分析,剩余肝脏混合后于-20 ℃储存,用于脂质代谢相关酶活性分析。
1.3 脂质代谢相关酶活性分析
称取0.5 g肝脏样品,按重量(g)∶体积(mL)=1∶9于预冷的磷酸缓冲液(50 mmol/L,pH 7.4)中匀浆,离心(4 ℃,2 000 r/min,10 min)分离上清。6PGD活性测定参考Barroso等[29]的报道,每毫克组织蛋白每分钟催化产生1 nmol还原型辅酶Ⅱ(NADPH)的酶量为1个6PGD活性单位;FAS活性测定参考Chang等[30]的报道,37 ℃条件下每毫克组织蛋白每分钟氧化1 μmol NADPH的酶量为1个FAS活性单位;肉碱棕榈酰转移酶(CPT)活性测定参考Bieber等[31]的报道,25 ℃条件下每毫克组织蛋白每分钟产生1 μmol产物的酶量为1个CPT活性单位;LPL活性测定参考Ballart等[32]的报道,每毫克组织蛋白每小时在反应系统中所产生1 μmol的游离脂肪酸为1个LPL活性单位。所有指标均采用商业试剂盒(南京建成生物工程研究所产品)进行测定,严格按照说明书操作步骤进行。
1.4 脂质代谢相关基因mRNA表达分析
冷冻的肝脏组织于RNAiso Plus试剂(TaKaRa)中匀浆,加入匀浆液1/5体积的氯仿后离心(4 ℃,12 000 r/min,15 min),取上清液与等体积异丙醇混合后离心(4 ℃,12 000 r/min,10 min),弃上清液后加入75%乙醇洗涤3遍,待干燥后溶于焦碳酸二乙酯(DEPC)水中。取1 μL总RNA,经2%琼脂糖凝胶电泳检测RNA完整性,依据260和280 nm处吸光度的比值(OD260 nm/OD280 nm)检测总RNA的浓度及纯度。

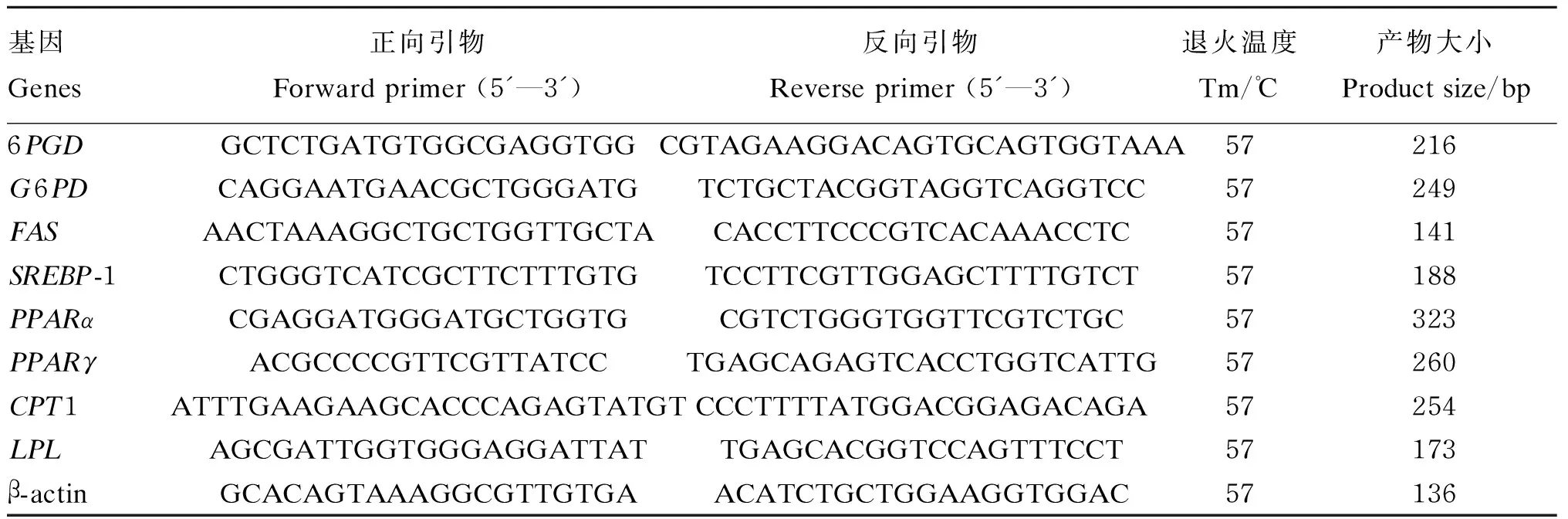
表1 用于黄颡鱼实时荧光定量PCR分析的引物
1.5 统计分析
试验数据采用双因素方差分析(two-way ANOVA)进行统计学处理,结果以平均值±标准差(mean±SD)表示,差异显著性水平设为P<0.05。所有分析均采用SPSS 20.0在Windows操作系统中进行。
2 结 果
2.1 氨氮胁迫下饥饿与复投喂对黄颡鱼肝脏中脂质代谢相关酶活性的影响
从表2可以看出,饥饿14 d后,高氨氮处理黄颡鱼肝脏中6PGD和FAS活性显著低于低氨氮处理(P<0.05),而肝脏中CPT和LPL活性显著高于低氨氮处理(P<0.05);在氨氮胁迫或正常养殖环境下,试验组黄颡鱼肝脏中6PGD和FAS活性显著低于对照组(P<0.05),而肝脏中CPT和LPL活性则显著高于对照组(P<0.05);黄颡鱼肝脏中6PGD(P=0.001)、FAS(P=0.001)、CPT(P=0.047)和LPL(P=0.038)活性受到氨氮胁迫和饥饿胁迫交互作用的显著影响。
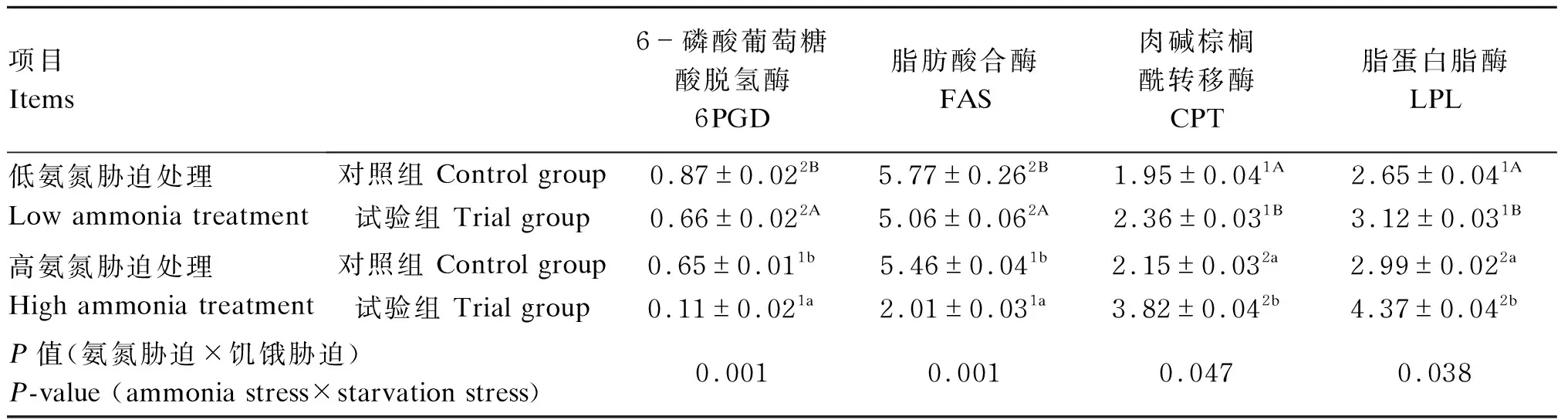
表2 氨氮胁迫下饥饿对黄颡鱼肝脏中脂质代谢相关酶活性的影响
从表3可以看出,恢复投喂28 d后,高氨氮处理黄颡鱼肝脏中6PGD和FAS活性显著低于低氨氮处理(P<0.05),而肝脏中CPT和LPL活性显著高于低氨氮处理(P<0.05);在氨氮胁迫或正常养殖环境下,试验组黄颡鱼肝脏中6PGD活性显著高于对照组(P<0.05),而LPL活性显著低于对照组(P<0.05);黄颡鱼肝脏中6PGD(P=0.001)、FAS(P=0.001)、CPT(P=0.034)和LPL(P=0.025)活性受到氨氮胁迫和复投喂交互作用的显著影响。
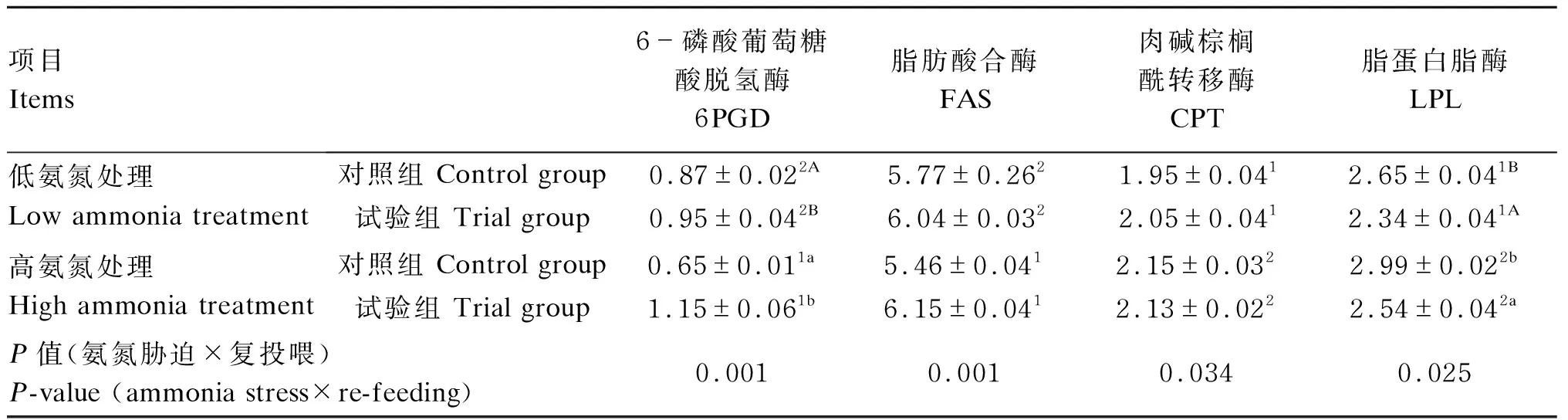
表3 氨氮胁迫下复投喂对黄颡鱼肝脏中脂质代谢相关酶活性的影响
2.2 氨氮胁迫下饥饿与复投喂对黄颡鱼肝脏中脂质代谢相关基因mRNA相对表达量的影响
从图1可以看出,饥饿14 d后,高氨氮处理黄颡鱼肝脏中6PGD、葡萄糖-6-磷酸脱氢酶(G6PD)、FAS、胆固醇调节元件结合蛋白-1(SREBP-1)、过氧化物酶体增殖物激活受体α(PPARα)和过氧化物酶体增殖物激活受体γ(PPARγ)基因的mRNA相对表达量显著低氨氮处理(P<0.05),而肝脏中肉碱棕榈酰转移酶1(CPT1)和LPL基因的mRNA相对表达量显著高于低氨氮处理(P<0.05);在氨氮胁迫或正常养殖环境下,试验组黄颡鱼肝脏中6PGD、G6PD、FAS、SREBP-1和PPARγ基因的mRNA相对表达量显著低于对照组(P<0.05),而PPARα、CPT1和LPL基因的mRNA相对表达量显著高于对照组(P<0.05)。
从图1可以看出,恢复投喂28 d后,高氨氮处理黄颡鱼肝脏中6PGD、G6PD、FAS和PPARα基因的mRNA相对表达量显著低于低氨氮处理(P<0.05),而肝脏中CPT1和LPL基因的mRNA相对表达量显著高于低氨氮处理(P<0.05);在氨氮胁迫或正常养殖环境下,试验组黄颡鱼肝脏中6PGD和G6PD基因的mRNA相对表达量显著高于对照组(P<0.05);氨氮胁迫下,试验组黄颡鱼肝脏中SREBP-1和PPARγ基因的mRNA相对表达量显著高于对照组(P<0.05),而肝脏中LPL基因的mRNA相对表达量显著低于对照组(P<0.05);正常养殖环境下,试验组黄颡鱼肝脏中FAS、SREBP-1、PPARα、PPARγ、CPT1和LPL基因的mRNA相对表达量与对照组无显著差异(P>0.05)。
3 讨 论
3.1 氨氮胁迫下饥饿对黄颡鱼脂质代谢相关酶活性及相关基因表达的影响
养殖生产过程中,通常采用减少投饲量或短期停止投食的策略来降低氨氮胁迫对养殖鱼类造成的伤害,但却会对鱼类正常的生理活动造成不同程度的影响,如影响蛋白质代谢和脂质代谢等[12]。脂质是鱼类生存的主要能量来源[14]。覃川杰等[24]研究发现,饥饿胁迫会降低瓦氏黄颡鱼体脂肪含量,改变肌肉和肝脏组织脂肪酸的组成模式;朱站英等[34]研究发现,随着饥饿胁迫时间的延长,草鱼血清中甘油三酯的含量呈先降低后升高再降低的变化趋势,推测可能是由于机体脂肪储存效率提高或者代谢速率降低所致。从上述研究可以看出,饥饿胁迫会对鱼类的脂质代谢造成负面影响,但作用机制至今尚不十分清楚,弄清脂质代谢相关酶活性的变化不失为较好的研究切入点。
6PGD和G6PD是磷酸戊糖途径的关键调控酶类,能够催化NADPH的合成,与能量平衡、生长速率和细胞活力等密切相关,其中,6PGD在机体应对环境胁迫的生理活动中可能发挥重要作用[35];FAS是脂肪酸合成的主要调节酶,能够催化乙酰辅酶A和丙二酰辅酶A生成长链脂肪酸[36];SREBP-1是重要的核转录因子,能够影响内源性胆固醇、甘油三酯和脂肪酸合成有关的几种酶的表达,在脂肪生成和脂质储存中发挥关键作用,以维持脂质动态平衡。Barroso等[37]研究发现,饥饿胁迫下虹鳟(Oncorhynchusmykiss)肝脏中G6PD和6PGD活性显著降低;Pérez-Jiménez等[38]研究发现,饥饿胁迫下欧洲鲈鱼(Dicentrarchuslabrax)肝脏中G6PD活性显著降低;Tian等[25]研究发现,饥饿胁迫下罗非鱼肝脏中FAS活性及其基因的mRNA相对表达量显著降低;Gosmain等[39]发现,饥饿胁迫下大鼠肝脏中SREBP-1基因的mRNA相对表达量显著降低,与肝脏中FAS基因mRNA相对表达量的变化趋势相同。本研究也发现了类似的现象,正常养殖环境下,饥饿14 d后,试验组黄颡鱼肝脏中6PGD和FAS活性显著低于对照组,通常酶的活性与其编码基因在转录(mRNA)水平上的表达有关,进一步的研究发现,黄颡鱼肝脏中6PGD、G6PD、FAS和SREBP-1基因的mRNA相对表达量受到饥饿胁迫的影响显著下调;在氨氮胁迫下,试验组黄颡鱼饥饿14 d后脂质代谢相关酶活性及其基因的mRNA相对表达量与正常养殖环境下的变化趋势相同;基于双因素统计进一步证实,氨氮胁迫和饥饿胁迫均会对黄颡鱼脂质代谢造成抑制。
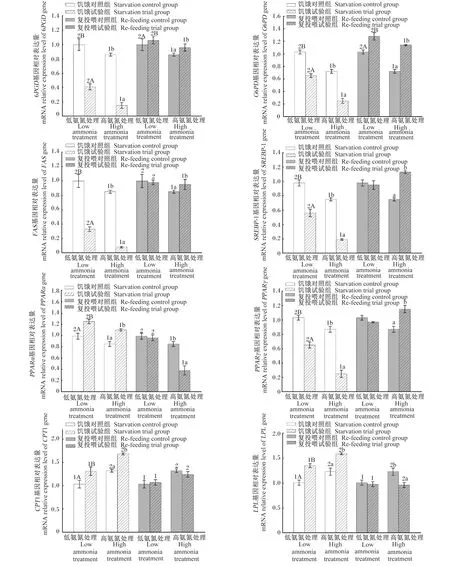
将β-肌动蛋白mRNA的表达量归一化为对照(对照=1)的比值。数据柱标注不同大写字母(A、B)表示低氨氮处理内组间差异显著(P<0.05),标注不同小写字母(a、b)表示高氨氮处理内组间差异显著(P<0.05),标注不同数字(1、2)表示低氨氮处理与高氨氮处理间差异显著(P<0.05)。
过氧化物酶体增殖物激活受体(PPAR)存在多种亚型,在脂质稳态中发挥中介作用,协调参与脂质代谢酶的基因转录[36]。其中,PPARα和PPARγ是与脂质代谢和脂肪生成密切相关的2个关键转录因子[40-42]。PPARα通过上调与脂肪酸分解有关的几种关键酶的表达,在脂肪酸的分解代谢中发挥关键作用[43-45],而PPARγ通过上调与脂肪酸合成有关的几种关键酶的表达,在脂肪生成和脂质储存中发挥关键作用[46]。Mohapatra等[47]发现,饥饿胁迫下真鲷(Pagrosomusmajor)肝脏中PPARα基因的mRNA相对表达量显著升高,与CPT1基因的mRNA相对表达量变化趋势相同,而PPARγ基因的mRNA相对表达量显著降低,与G6PD基因的mRNA相对表达量变化趋势相同。在本研究中,正常养殖环境下,饥饿14 d后,试验组黄颡鱼肝脏中PPARα基因的mRNA相对表达量显著高于对照组,而PPARγ基因的mRNA相对表达量显著低于对照组。此外,Zheng等[40]发现,急性和慢性锌暴露下PPARα基因的mRNA相对表达量与脂肪分解关键酶基因(CPT1和LPL)的mRNA相对表达量变化趋势相同,而PPARγ基因的mRNA相对表达量与脂肪合成相关酶基因(G6PD、6PGD和FAS)的mRNA相对表达量变化趋势相同。同样,在氨氮胁迫下,黄颡鱼饥饿14 d后,肝脏中PPARα和PPARγ基因的mRNA相对表达量与正常养殖环境下变化趋势相同。
3.2 氨氮胁迫下复投喂对黄颡鱼脂质代谢相关酶活性及相关基因表达的影响
本研究发现,正常养殖环境下,恢复投喂28 d后,试验组黄颡鱼肝脏中6PGD活性显著高于对照组,同时还发现,试验组肝脏中6PGD和G6PD基因的mRNA相对表达量显著高于对照组。这与前人的研究结果是一致的,Barroso等[37]研究发现,饥饿后复投喂,虹鳟肝脏中G6PD和6PGD活性显著升高;Amalia等[38]研究发现,饥饿后复投喂,欧洲鲈鱼肝脏中G6PD活性显著升高;Tian等[25]研究发现,饥饿后复投喂,罗非鱼肝脏中FAS活性及其基因的mRNA相对表达量显著升高。在本研究中,在氨氮胁迫下,恢复投喂28 d后,试验组黄颡鱼肝脏中6PGD活性以及6PGD、G6PD、FAS及SREBP-1基因的mRNA相对表达量显著高于对照组,提示氨氮胁迫下饥饿后复投喂能够提高黄颡鱼脂质合成代谢。
Mohapatra等[47]发现,饥饿后复投喂,真鲷肝脏中PPARα基因的mRNA相对表达量显著降低,而PPARγ基因的mRNA相对表达量变化趋势则相反;Ölmez等[55]研究发现,饥饿胁迫下斑马鱼肝脏中PPARα基因的mRNA表达显著下调,复投喂后恢复到正常水平。在本研究中,在正常养殖环境下,恢复投喂28 d后,试验组肝脏中PPARα和PPARγ基因的mRNA相对表达量与对照组无显著差异,而在氨氮胁迫下,恢复投喂后,试验组黄颡鱼肝脏中PPARα基因的mRNA相对表达量显著低于对照组,肝脏中PPARγ基因的mRNA相对表达量则显著高于对照组。
Oku等[51]研究发现,随着饥饿时间的延长,真鲷肝脏中LPL基因的mRNA相对表达量显著升高,复投喂6 h后,其mRNA相对表达量恢复到0 h时的水平;Tian等[25]发现,饥饿胁迫显著增强罗非鱼肝脏中LPL活性,复投喂后LPL活性出现显著下降,这是因为肝脏中的LPL被用于分解甘油三酯生成脂肪酸和甘油,以满足机体对能量的需求;马细兰等[53]研究发现,饥饿后复投喂,虎龙斑肝脏中CPT-1A活性及其基因的mRNA相对表达量显著下降。本研究中,在正常养殖环境下,恢复投喂28 d后,试验组黄颡鱼肝脏中CPT活性以及LPL和CPT1基因的mRNA相对表达量与对照组无显著差异;而在氨氮胁迫下,恢复投喂28 d后,试验组黄颡鱼肝脏中LPL活性及其基因的mRNA相对表达量显著低于对照组,提示氨氮胁迫下饥饿后复投喂能够降低黄颡鱼的脂质分解代谢。
4 结 论
综上所述,氨氮胁迫和饥饿胁迫均会促进黄颡鱼的脂质分解代谢,并抑制脂质合成代谢;氨氮胁迫下饥饿后复投喂能够恢复黄颡鱼的脂质代谢平衡。

