五味子-甘草配伍的含药血清对肝细胞脂质堆积的影响及机制研究
贾文汇,李伟霞,张 辉,张明亮,牛 璐,王 炎,泥文娟,王晓艳,唐进法
(1.河南中医药大学药学院,河南 郑州 450008;2.河南中医药大学第一附属医院药学部,中药临床评价技术河南省工程实验室,河南 郑州 450000)
五味子SchisandraeChinensisFructus系木兰科植物五味子Schisandrachinensis(Turcz.) Baill.的干燥成熟果实,具有收敛固涩,益气生津,补肾宁心等作用[1]。研究发现,五味子中活性最强的联苯环辛烯类木脂素—五味子素B(schisandrin B,Sch B)一次大剂量(0.1-2 g·kg-1)给药,在一定时间内(12-96 h)与临床高脂血症-脂肪肝-肝损伤的发病过程极为接近[2-4]。临床上所用五味子剂量较大,远远超出了五味子的推荐剂量,致使五味子存在诱发高脂血症及脂代谢紊乱相关疾病的潜在风险。甘草味甘、性平,可缓和诸药之偏性,还能缓急止痛,顾护肝脏之气血,有“解毒之王”的誉称[5]。临床上含五味子的中药方剂,多数亦含甘草,如桂苓五味甘草汤(五味子:甘草=1 ∶1)、小青龙汤(五味子:甘草=1 ∶1)、养阴益气汤(五味子:甘草≈1 ∶1.5)等,临床上应用上述方剂未发现脂代谢紊乱等现象,或与甘草的“解毒”作用有关。
动物实验证实,大剂量五味子(3.9 g·kg-1)可显著升高血清TG和TC含量,而配伍甘草后,可显著降低五味子升高的血清TG和TC含量,说明大剂量五味子配伍甘草可降低五味子致脂代谢紊乱、诱发高脂血症和脂肪肝的风险,但其机制尚不清楚。脂质代谢的调控是一个极其复杂的过程,肝脏的脂肪沉积与肝脏脂肪的摄取和分解失衡有关[6],涉及多个环节、多条通路、多个作用靶点,包括过氧化物酶体增生物激活受体α/γ(PPAR-α/γ)、脂肪酸结合蛋白1/2(Fabp1/2)、固醇调节元件结合因子-1(SREBF1)、脂肪酸合成酶(FAS)、乙酰辅酶A羧化酶(ACC)等,据此,本研究旨在通过体外细胞实验观察大剂量五味子含药血清及配伍甘草后含药血清对正常肝细胞内脂质堆积的影响,并初步探讨其相关机制,为五味子的临床合理应用提供数据支撑。
1 材料
1.1 仪器CO2恒温培养箱(Thermo赛默飞世尔科技(中国)有限公司,型号:3111);超净工作台(苏州净化设备有限公司);酶标仪(Thermo赛默飞世尔科技(中国)有限公司);倒置相差显微镜(Motic麦克奥迪实业集团有限公司,型号:AE31);-80 ℃超低温冰箱(Thermo赛默飞世尔科技(中国)有限公司,型号:Revco Value ULT1386-3-V42);荧光定量PCR仪(瑞士罗氏公司,型号:LightCycler 96);细胞培养瓶、细胞培养板(美国康宁公司);电热恒温水浴锅(上海森信实验仪器有限公司,型号:S11);离心机(Thermo赛默飞世尔科技(中国)有限公司,型号:Megafuge 8)。
1.2 药物与试剂五味子(批号:19060102),甘草(批号:19080101)均购自郑州瑞龙制药股份有限公司,经河南中医药大学第一附属医院陈天朝主任药师鉴定,符合《中国药典》2015版一部相关规定。PBS(批号:PYGOO21)购自博斯特生物技术有限公司;DMSO(批号:1213C0330)、青链霉素混合液(批号:20190320)购自北京索莱宝科技有限公司;胎牛血清(批号:NYMI1035)、胰酶(批号:J170003)、DMEM(批号:AL209346)均购自HyClone公司;CCK8(批号:NG703)购自东仁化学科技(上海)有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)测试盒(批号:20190425)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)测试盒(批号:20190615)、总蛋白定量测试盒(BCA法)(批号:20200411)均购自南京建成生物工程研究所。
1.3 动物与细胞SD大鼠80只,♂,体质量(200±20) g,SPF级,购自北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2016-0006。本实验通过河南中医药大学第一附属医院实验动物伦理委员会批准(批准号:YFYDW2019006)。饲养环境恒温控制,温度(22±1) ℃,湿度0.6,12 h暗/光周期,自由摄食饮水。动物操作过程均按照《实验动物管理条例》的规定由专职饲养员严格执行。人正常L02肝细胞由河南中医药大学第一附属医院中药药理实验室惠赠。
2 方法
2.1 动物分组、给药及含药血清制备根据小青龙汤和养阴益气汤中五味子和甘草的比例,设置五味子-甘草(1 ∶1)和五味子-甘草(1 ∶1.5)组,将SD大鼠80只随机平均分为空白对照组(Control)、五味子组(SchisandraeChinensisFructus,SF)、五味子-甘草(1 ∶1)和五味子-甘草(1 ∶1.5)组(SchisandraeChinensisFructus-GlycyrrhizaeRadixEtRhizoma,SG,1 ∶1,1 ∶1.5),空白组给予羧甲基纤维素钠溶液,各给药组给予各提取物含五味子生药3.9 g·kg-1,每天灌胃一次,连续7 d,末次给药1 h后,0.1水合氯醛(3 mL·kg-1)麻醉,腹主动脉采血,室温静置2 h后,3 500 r·min-1离心10 min(4 ℃),分离血清,将同组含药血清合并,56 ℃热处理30 min进行灭活,0.22 μm微孔滤膜过滤,分装冻存。
2.2 L02细胞培养复苏后用含0.1胎牛血清的DMEM培养液悬浮接种,置于37 ℃、0.05 CO2细胞培养箱中培养,当细胞融合度占0.8时,用0.002 5胰蛋白酶消化,按1 ∶3比例传代培养,取对数生长期细胞用于实验。
2.3 CCK-8法确定大鼠血清加入量取对数生长期的L02细胞制成细胞悬液,以1×104个/孔(100 μL)接种于96孔培养板,用无血清的培养液同步化细胞16 h后,分别加入含0.05、0.1、0.15、0.2、0.25、0.3空白大鼠血清和0.1胎牛血清的培养液,每个浓度6个复孔。继续培养24、48 h后,每孔加入60 μL CCK-8溶液,培养箱中孵育1 h左右,使用酶标仪测定450 nm光吸收值。
2.4 LDH法检测含药血清对细胞的毒性按照上述步骤接种并同步化细胞后分为以下五组:0.1胎牛血清组、0.25空白大鼠血清组、0.25 SF含药血清组、0.25 SG(1 ∶1)含药血清组和0.25 SG(1 ∶1.5)含药血清组。干预24 h和48 h后,吸取各培养液上清,用酶标仪450 nm处测定吸光度。
2.5 分组待细胞融合分布0.7-0.8后,采用无血清培养液同步化细胞16 h,将细胞分为以下4组:①Control组(含0.25大鼠空白血清培养液);②SF组(含0.25大鼠SF含药血清培养液);③SG(1 ∶1)组(含0.25大鼠SG(1 ∶1)含药血清培养液);④SG(1 ∶1.5)组(含0.25大鼠SG(1 ∶1.5)含药血清培养液)。各组细胞给予相应血清培养液培养干预48 h后进行后续指标检测。
2.6 TG、TC含量测定细胞分组同“2.5”项,含药血清培养作用48 h后,采用0.02 Triton-X100冰上裂解细胞,离心取上清,参照试剂盒说明书步骤检测细胞内TG、TC的含量。
2.7 RT-PCR法检测脂代谢相关指标(PPAR-α、PPAR-γ、Fabp1/2、SREBP1c、ACCα、FAS)mRNA的表达情况各组细胞无血清同步化处理16 h,给药刺激48 h后,收集细胞按RNA提取试剂盒说明提取细胞总RNA,按逆转录试剂盒说明逆转录成为cDNA,再以此cDNA为模板按PCR试剂盒说明进行实时PCR反应。使用2-ΔΔct法分析目的基因的表达,其中Ct代表循环阈值。各基因引物序列见Tab 1。

Tab 1 Primer sequence
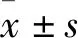
3 结果
3.1 大鼠血清加入量CCK-8结果显示,培养24 h的0.05、0.1、0.15、0.2、0.25、0.3空白大鼠血清组与0.1胎牛血清组吸光度值(OD)比较无明显差异。培养48 h的0.1、0.25和0.3空白大鼠血清组与0.1胎牛血清组OD值比较无明显差异,而0.25的空白大鼠血清组与0.1胎牛血清组OD值最为接近。综合考虑后续分组实验选择0.25大鼠血清为实验终配比。
3.2 含药血清对细胞的毒性检测(LDH)活力LDH结果显示,与0.1胎牛血清组比较,Control、SF、SG (1 ∶1、1 ∶1.5)组大鼠含药血清对细胞LDH活性的影响均无显著差异,说明含药血清对细胞无毒性作用,见Tab 2。综合考虑,后续实验作用时间选择48 h。

Tab 2 Effect of serum containing drugs on LDH activity of L02 cells(,n=6)
3.3 TG和TC含量作用48 h后,与空白组比较,SF组TG、TC含量显著增加(P<0.05);与SF组比,SG(1 ∶1)组的TG、TC均显著降低(P<0.05),SG(1 ∶1.5)组TC含量显著降低(P<0.05),SG(1 ∶1.5)组TG含量有降低的趋势,但无统计学差异,见Fig 2。

Fig 1 Effects of different concentrations of rat serum on proliferation of L02 cells(,n=6)*P<0.05 vs 0.1 FBS

Fig 2 Effects of serum containing drugs on contents of TG and TC in L02 cells(,n=6)*P<0.05 vs control;#P<0.05 vs SF
3.4 含药血清对L02细胞脂代谢相关指标(PPAR-α、PPAR-γ、Fabp1/2、SREBP1c、ACCα 、FAS)mRNA表达的影响与空白组比较,SF可显著降低PPAR-α、PPAR-γ的mRNA表达,升高SREBP1c、ACCα的mRNA表达(P<0.05,P<0.01);与SF比较,SG(1 ∶1)可显著降低Fabp1/2、FAS的mRNA表达,升高SREBP1c的表达(P<0.05,P<0.01);SG(1 ∶1.5)可显著升高PPAR-γ、SREBP1c的mRNA表达,降低Fabp1/2、FAS的mRNA表达(P<0.05,P<0.01),见Fig 3。

Fig 3 Effects of serum containing drugs on mRNA expression of lipid metabolism related protein in L02 cells(,n=6)*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs SF
4 讨论
中医素有“不传之秘在于量”的说法,中药剂量是影响疗效的关键因素之一,也是中药是否产生不良反应的重要因素。许多统计数据发现临床处方中很多药物存在超剂量使用收获良效的验案,但同时超大剂量及长期使用而引起的中药不良事件时有发生。张文东[7]整理某院乌头类中药的不良反应,因超剂量使用乌头类药物导致患者出现不良反应,约占不良反应总数的0.26。此外,部分中药的功效会随着应用剂量的不同而发生改变,甚至作用完全相反,即所谓的“双向调节”。如川芎小剂量可使子宫张力增高,收缩力增强、形成挛缩;大剂量反而使子宫麻痹而收缩停止[8]。
现代研究表明,五味子在中枢系统、心血管系统、肾脏和生殖系统等方面应用广泛,具有保护肝脏、抗氧化、抗肿瘤、抑菌、降血脂和抗炎等作用,并有研究表明五味子具有“适应原”样作用[9]。药典中规定五味子用量2-6 g,有文献报道建议成人五味子剂量为0.5-1.5 g,每天2次[10],相当于五味子中含量最高的Sch B每天20-60 mg[11]。研究发现,低剂量五味子醇提物可降低高胆固醇血症小鼠血清和肝脏TG含量[12],高剂量五味子可升高正常小鼠血TG和TC含量,说明五味子在调节血脂方面存在“双向调节”作用。
高脂血症进一步可诱发脂肪肝[13],脂肪肝主要表现为脂质的堆积,即TG和TC含量的升高。课题组前期证实五味子提取物大剂量可显著升高正常小鼠的血清和肝脏中TG和TC含量,诱发高脂血症,本次研究结果表明,SF含药血清组TG、TC含量较对照组均显著上升,而与SF组比,SG组的TG、TC的含量均有所下调,进一步证实了甘草与五味子配伍可显著降低大剂量五味子诱发的脂质堆积,但未呈剂量依赖性。
与脂质代谢相关的基因PPAR-α是参与过氧化物酶体和线粒体β-氧化、脂肪酸转运和肝葡萄糖生成的转录调节因子,主要通过影响脂蛋白及长链脂肪酸的代谢,进而调控脂质代谢。PPAR-γ可以调控脂肪酸从头合成、延长、去饱和、酯化过程的每一个步骤,并已证实脂肪肝发生与PPAR-γ的表达呈正相关[14]。肝细胞特异性高表达PPAR-γ可促进甘油三酯的蓄积。研究结果表明,SF、SG均能抑制脂肪酸转运的转录调节因子和脂肪生成基因的表达,可能是五味子及配伍甘草降低TG、TC的机制之一。
FABP是一类脂肪酸结合蛋白,肝细胞特异性的FABP形式是Liver FABP(L-FABP),其负责部分脂肪酸的摄取,不过最主要的功能是和细胞内游离脂肪酸结合[15],它高表达也会促进甘油三酯及磷脂的合成。另外,L-FABP还可激活胆固醇脂酰辅酶A酰基转移酶,促进细胞内胆固醇酯的合成。本实验结果显示,SF组Fabp1/2基因的表达有升高趋势,高剂量五味子可能通过上调Fabp1/2基因,导致了TG、TC含量升高,而配伍甘草后,下调Fabp1/2基因的表达,从而降低了TG、TC的合成。
SREBP1c可激活脂肪酸合成途径,FAS和ACC是脂肪酸从头合成的酶,都是调节肝脏脂肪生成的关键基因。文献报道[16],沉默SREBP1c的表达可降低脂肪肝的发生率,同时抑制FAS和ACC基因的表达。SREBP1c表达增加会促进脂肪生成基因的表达,使脂肪酸合成增加并且加速甘油三酯的蓄积;据研究证明[17],FAS可通过催化脂肪再生使肝脏产生大量游离脂肪酸,FAS的活性和数量增加会使动物机体内脂质的生成与沉积;ACC表达量升高会使肝脏脂肪酸的从头合成与摄取增加。本研究结果显示,与对照组比较,SF组SREBP1c、ACCα的表达显著升高,说明高剂量五味子可能通过上调SREBP1c、ACCα基因的表达,导致脂肪蓄积,配伍甘草后仍呈上升趋势,但TG、TC含量呈显著下降;与对照组比,SF组FAS的表达呈下降趋势,而加入甘草配伍后显著抑制了FAS的表达,降低了脂质合成堆积,充分说明中药通过多成分、多靶点、多通路作用的特点。
本研究通过比较高剂量五味子与加入甘草配伍后的含药血清对肝细胞脂质堆积的影响,证实了高剂量五味子含药血清可显著升高肝细胞中TG、TC含量,造成脂质堆积,而配伍甘草后能显著降低TG、TC的含量,降低脂质堆积,其机制可能与调控PPAR-α、PPAR-γ、Fabp1/2、SREBP1c、ACCα、FAS基因的表达有关。因此,临床应用五味子时需对其用药剂量慎重考虑,建议配伍同等剂量的甘草,避免其在脂肪代谢方面的“双向调节”作用,为五味子的临床合理应用提供参考依据。
(致谢:本实验在河南中医药大学第一附属医院中药临床评价技术河南省工程实验室、中药药代动力学实验室开展,感谢各位老师和同学的帮助。)

