网络药理学挖掘丹参-苦参药对提取物的抗炎药效及分子机制研究
成 鹏,黄 帅,杨 宇,吴佳伟,陈文星,王爱云,陆 茵
(南京中医药大学药学院,江苏省中药药效与安全性评价重点实验室,江苏 南京 210023)
炎症反应是机体抵御外界刺激的重要过程,其中多种促炎细胞因子是炎症反应发生发展的最重要参与者。心血管疾病的病因与炎症有密不可分的关系,如动脉粥样硬化。炎症出现在动脉粥样硬化的每个阶段——从疾病的发生发展到并发症:导致斑块破裂和重要器官的血流量的减少。炎症主要影响几种细胞的功能,比如特定于血管壁的细胞(如内皮细胞和平滑肌细胞)及响应特定刺激而募集到血管壁的细胞(如免疫细胞和血小板)[1]。
丹参SalviamiltiorrhizaBge.是唇形科鼠尾草植物丹参的干燥根及根茎[2],其提取物中主要含有脂溶性二萜类和水溶性酚酸类成分,主要药理作用为降血脂,抗炎,改善微循环和抗肿瘤等[3-5]。苦参Kushencens Ait.为豆科槐属植物苦参的干燥根茎,其活性成分主要为生物碱类和黄酮类,具有抗菌和抗炎作用,并且对心血管系统和免疫系统相关疾病都有不同程度的改善及治疗作用[6]。临床上丹参和苦参药对配伍已广泛应用到心血管疾病,慢性肝炎,以及肿瘤免疫治疗中[7-9],然而药对配伍中的主要活性成分发挥具体药效的机制尚不明确。
中医药有丰富的临床经验,在治疗心血管及炎症相关疾病显示出良好的效果。然而中药复方的多成分、多靶点特征,使中医药现代化发展道路艰难重重。而网络药理学的逐步完善,生物信息学、系统生物学和计算生物学等学科的融合,“成分-靶点-疾病”多层次网络的构建,都便于我们从整理到局部,有逻辑有层次的研究药物与疾病的关联,进而预测药物的靶点,探索药物作用机制。
本研究首先利用中草药系统药理学平台(TCMSP)和上海有机所中药天然产物数据库寻找丹参苦参药对的主要活性成分,并使用STITCH和TCMSP数据库对其靶点进行预测,随后借助DAVID及g:Profiler数据库对其进行通路富集分析,发现结果显示,丹参-苦参提取物作用机制与免疫过程中促炎因子及血管内皮生长因子(VEGF)通路相关。最后利用二甲苯致小鼠耳肿胀模型以及炎性因子渗出模型评价药效。并且从降低促炎细胞因子水平,减少促炎细胞因子渗漏两方面验证丹参苦参药对的抗炎作用机制。
1 材料与方法
1.1 实验动物ICR小鼠,122只,体质量(18-22) g,雌性,购自浙江省实验动物中心,合格证编号:No.201512683。72只ICR小鼠用于炎性耳肿胀实验和细胞因子检测,50只ICR小鼠用于炎症渗出实验。
1.2 药品与试剂丹参、苦参均购自安徽省毫州市中医药有限公司,经南京中医药大学药学院刘圣金副教授鉴定均为正品。丹参、苦参按照3 ∶1碾碎成细粉,按照M ∶V=1 ∶10的比例加水提取,经浓缩、减压干燥后得干膏粉备用,每1 g干膏等于5.102 g生药量;酞丁安(北京协和药厂,141002);伊文思蓝(BIOSHARP,Ameresco E2129);脱毛膏(加拿大奈尔Nair公司男士专用脱毛膏,Cat.No.MZ-5);Mlliplex MAP Mouse Cytokine/Chemokine Magnetic Bead Panel.Cat#:MCYTPMAG-70K,Kit Lot#:2761476;二甲苯(永华化学科技有限公司,Lot.20141220)
1.3 实验仪器电子天平:赛多利斯有限公司;注射器;高速冷冻离心机:eppendorf centrifuge 5417R;酶标仪:Thermo Scientific Multiskan GO;GJ28402热板测痛仪(浙江宁海白石电子医药仪器厂);美国Millipore,Luminex 100。
1.4 方法
1.4.1网络药理学预测丹参-苦参提取物的抗炎机制 药对包括丹参和苦参,通过检索查询上海有机所中药天然产物数据库(http://www.organchem.csdb.cn/)、TCMSP(http:/lsp.nwu.edu.cn/)收集成分,为了筛选活性成分,我们测试了成分的ADME特性(吸收Absorption、分布Distribution、代谢Metabolism和排泄Excretion),包括口服生物利用度(OB),药物相似性(DL),Caco-2渗透性(Caco-2),血脑屏障(BBB)和药物半衰期(HL)使用OB%≥30%,DL≥0.18,Caco-2≥-0.4,BBB≥-0.3和HL≥4的标准进行筛选。
通过STITCH(http://stitch.embl.de/)和TCMSP(http://lsp.nwu.edu.cn/)中虚拟对比结果,预测丹参-苦参药对中活性成分的靶标集。在标靶集中,采用随机森林(Random Forest)和支持向量机(Support Vector Machine)于计算机中有效地大规模整合化学、基因组和药理学信息,以进行大规模药物靶向。确定药物靶标时,选取向量机大于0.7或随机森林>0.8的蛋白是潜在靶标。通过Uniprot(http://www.uniprot.org/)数据库,将靶标蛋白名转换成基因名(均为人源靶点)。使用Cytpscape3.2.1软件绘制丹参-苦参药对-靶点图。
继续通过TTD(https://db.idrblab.org/ttd/),PharmGkb(https://www.pharmgkb.org/)等数据库,以“inflammation”疾病名为关键词进行检索,得到相关疾病靶点,转换成基因名。
利用Cytpscape3.2.1软件中插件BisoGenet将上述得到的有效成分靶点及疾病靶点进行蛋白质相互作用(PPI)网络的拓扑分析,分别得到两个网络,取两者交集。继续使用Cytpscape3.2.1软件中Network Analyzer和CytoNCA进行分析,通过分析取度值(degree)、介数(betweenness centrality,BC)等筛选核心靶点。
筛选核心靶点后,利用DAVID(https://david.ncifcrf.gov/)及g:Profiler(https://biit.cs.ut.ee/gprofiler/gost)数据库,对筛选的核心靶点进行基因本体(geneontology,GO)分类富集分析及KEGG通路富集分析,并进行可视化结果处理。分析所得到的结果,设计相关实验加以验证。
1.4.2实验分组与给药方案 将小鼠随机分成对照组,丹参-苦参提取物剂量组(2.5、5、10 mg·kg-1)及酞丁安药物组。
优秀的建筑设计方案可以在保证房屋结构具有实际使用价值的同时,大幅度提高建筑物的环保价值和经济效益。因此,优秀的建筑结构设计方案不仅可以最大限度地节约建筑成本,还可以给建设方带来巨大的经济效益,并且不会破坏周围环境,在一定程度上与当地的生态环境相融合,实现经济效益与自然环境的可持续发展。由此看来,科学合理地对建筑进行结构优化设计有利于体现建筑的综合价值。
给药方案:每只动物外部受试部位涂抹给药1 cm,连续给药7 d。空白组涂抹0.9 μL 75%乙醇,实验组涂抹0.9 μL含丹参-苦参提取物的75%乙醇溶液,酞丁安药物组涂抹0.1 g·10 g-1。
1.4.3小鼠炎性肿胀模型 将60只ICR小鼠分别随机分成5组(n=12),给药前24 h使用脱毛膏对腹部进行脱毛处理,脱毛面积为2 cm×2 cm,给药方式见“1.4.1”。末次给药后30 min,将30 μL二甲苯(2%)涂在小鼠右耳处,左耳作对照,致炎处理1 h后,小鼠进行眼眶取血,并脱颈处死,并剪下双耳片用8 mm打孔器分别在耳同一部位钻取两耳圆片用电子天平称重[10]。
1.4.4液相芯片检测小鼠血清中细胞因子的分泌 血清获取:对耳肿胀模型小鼠以及剩余空白小鼠(n=12)进行眼眶取血,并脱颈处死。将全血于室温静置3-4 h至血清分层,随即1 000g离心10 min,吸取上层血清分装,每管30 μL。
血清样品检测前准备:-80 ℃冰箱取出,室温融化。按照Mlliplex MAP Mouse Cytokine/Chemokine Magnetic Bead Panel 说明书进行检测,所检测炎性因子包括IL-4(白细胞介素-4)、IFN-γ(干扰素γ)、IL-12(白细胞介素-12)、IL-6(白细胞介素-6)、TNF-α(肿瘤坏死因子α)、CXCL-1(趋化因子-1)、G-CSF(粒细胞集落刺激因子)、IL-10(白细胞介素-10)[11-12]。
1.4.5小鼠腹腔毛细血管通透性实验 将50只ICR小鼠分别随机分成5组(n=10)。给药前24 h用脱毛膏对小鼠腹部进行脱毛处理,脱毛面积为2 cm×2 cm。于末次给药后30 min,以0.1 mL·10 g-1对所有小鼠尾静脉注射0.5%伊文思蓝氯化钠溶液,随后在小鼠腹部去毛皮肤上滴加二甲苯(2%)0.05 mL。20 min后脱颈处死小鼠,剥下腹部脱毛处的兰染皮肤,用直径1.5 cm打孔器打下兰染皮肤圆片,并投入装有5 mL丙酮-100 mL生理盐水溶液(带塞)试管内,密封置暗处,每天轻轻摇动试管2-3次。3 d后1 000转离心5 min,吸上清液用分光光度计在630 nm处测吸光度(A)值,用A值衡量动物腹腔渗出液的伊文思蓝染料的含量,作为检测毛细血管通透性的指标[13]。
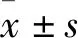
2 结果
2.1 网络药理学分析揭示丹参-苦参提取物的作用机制与促炎因子分泌及外渗相关通过检索查询上海有机所中药天然产物数据库、TCMSP数据库查找检索丹参-苦参药对中成分,发现丹参中包含202个成分,苦参中成分为113个。经ADME特性筛选后,丹参活性成分为38个,苦参为33个。通过STITCH和TCMSP数据库预测丹参、苦参潜在靶点。删除重复项后,发现丹参活性成分靶点为70个,主要为丹参酮类化合物和酚酸类化合物,苦参为110个,主要为生物碱类化合物。随后利用Cytpscape 3.2.1软件绘制丹参-苦参药对成分靶点网络图。
将丹参-苦参药对靶点及炎症靶点分别通过BisoGenet插件进行蛋白互作网络(protein-protein interaction network,PPI)的拓扑分析。得到丹参-苦参药对潜在靶点的PPI网络,包括4 748个节点;炎症潜在靶点的PPI网络,包括902个节点。将两者网络进行交集(Merge),得到交集网络,并使用CytoNCA插件分析,取得770个节点。取Degree值大于58的基因作为核心靶点,得到肿瘤坏死因子(TNF),丝裂原活化蛋白激酶1(MAPK1),NFKB1,信号传导与活化转录因子3(STAT3)等基因。这些蛋白与炎症密切相关,说明丹参-苦参药对可能通过这些蛋白发挥抗炎作用。
DAVID中的GO分析显示,丹参-苦参药对预测的核心靶点在生物学过程中靠前的有肿瘤坏死因子,NF-κB信号通路和免疫相关过程的调控等,说明丹参-苦参药对可能针对这些途径发挥抗炎作用;在分子功能中排名靠前的有ATP的结合,转录因子的结合和细胞与细胞的黏附等。随后进行KEGG通路分析,选取P值相对较小且基因富集的20条通路,主要有:TNF信号通路,免疫相关通路,VEGF信号通路和趋化因子信号通路等。说明丹参-苦参药对发挥抗炎作用的机制与免疫相关过程和VEGF信号通路相关。
使用g:Profiler(https://biit.cs.ut.ee/gprofiler/gost)数据对核心靶点同样进行GO分析及KEGG分析,同时补充Reactome和WikiPathways分析,分析结果与DAVID数据库基本一致,两者结果相互佐证。
随后设计实验确定丹参-苦参药对的抗炎药效,并以预测的炎症相关靶点如STAT3通路,VEGF通路和免疫过程中的促炎因子开展实验。
2.2 丹参-苦参提取物对炎性肿胀的影响实验结果结果如Tab 1以及Fig 3所示,与对照组相比,丹参-苦参提取物10 g·L-1的浓度下可明显抑制二甲苯所致的小鼠耳肿胀(P<0.05)。
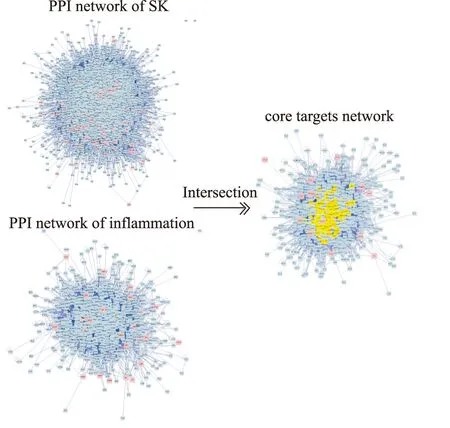
Fig 1 Construction of core target network
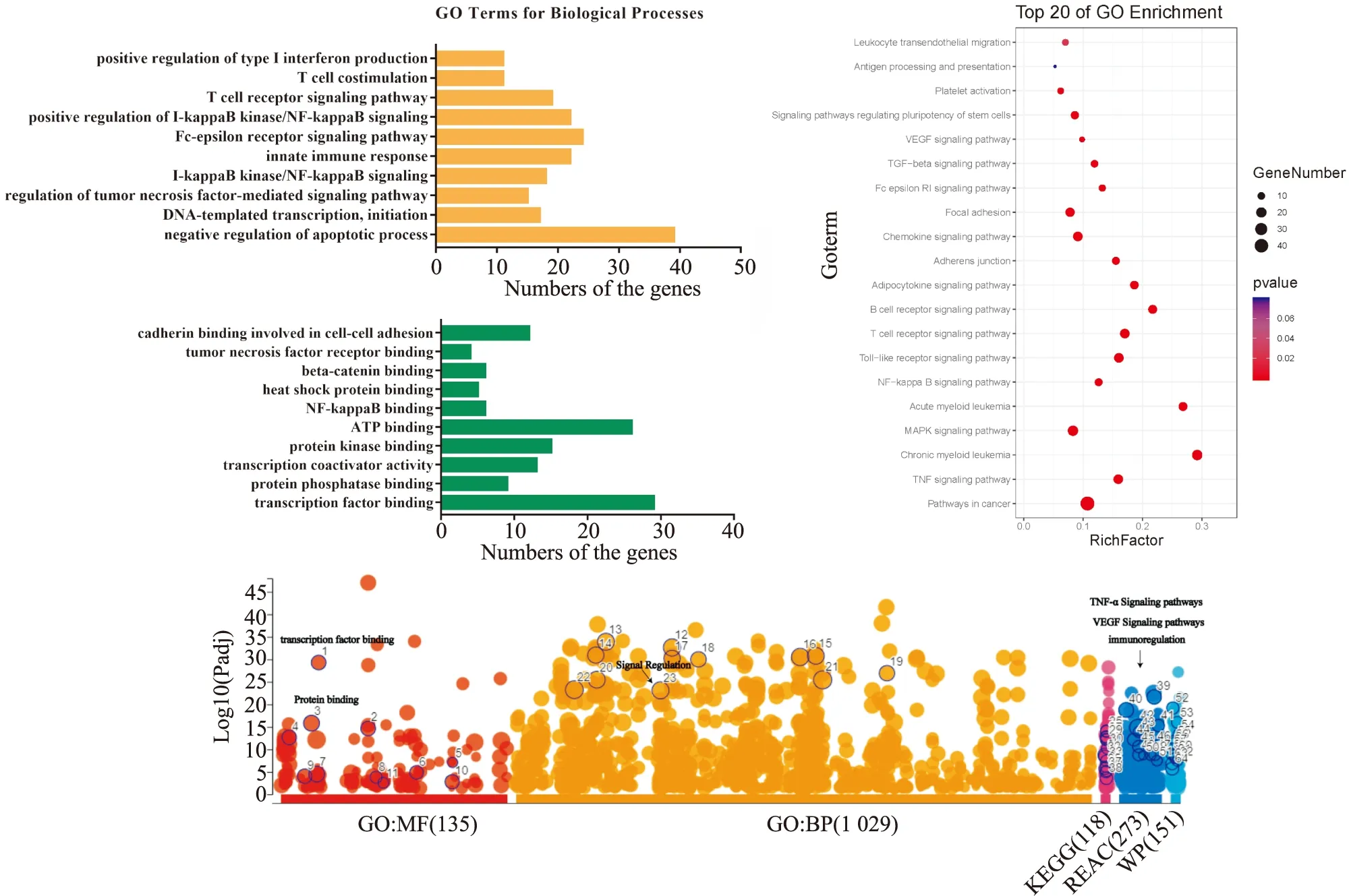
Fig 2 Analysis of biological process,molecular function and KEGGpathway enrichment
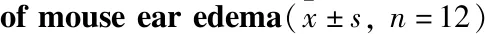
Tab 1 Effect of SK on inflammation
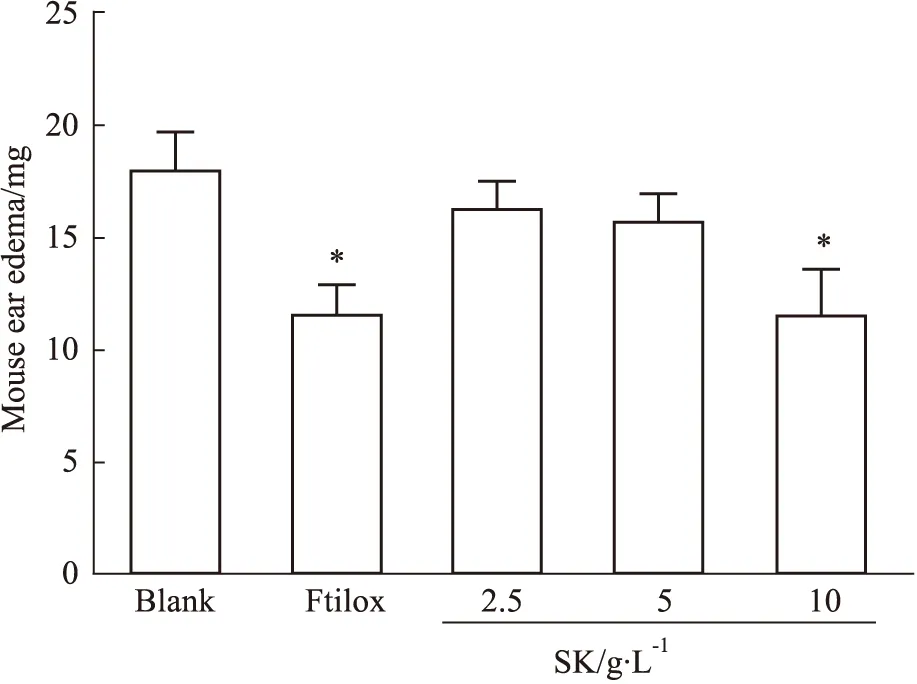
Fig 3 Effect of SK on inflammation of mouse ear edema
2.3 丹参-苦参提取物对小鼠外周血清细胞因子分泌的影响实验结果利用luminex液相芯片检测技术,研究丹参-苦参提取物对促炎细胞因子IFN-γ、IL-4、IL-6、IL-12、CXCL-1、TNF-α、IL-10、G-CSF表达水平的影响进行分析,结果如Tab 2所示,丹参-苦参提取物对外周血清中IL-12、IL-4、TNF-α、IFN-γ、IL-10、CXCL-1的表达无明显作用,而在2.5 g·L-1浓度下IL-6的表达受到了明显的抑制,5 g·L-1浓度下抑制效率达到最高,10 g·L-1的抑制效率有所下降,但仍然呈现显著性抑制效应。同时丹参-苦参提取物在5、10 g·L-1浓度下明显抑制G-CSF的分泌。结果显示,丹参-苦参提取物的抗炎作用可能与抑制IL-6和G-CSF的分泌相关。
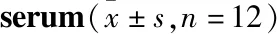
Tab 2 Effect of SK on expression of different inflammatory cytokines in peripheral
2.4 丹参-苦参提取物对炎症渗出的影响实验结果与对照组相比,丹参-苦参提取物在5 g·L-1的浓度下对二甲苯所致的小鼠腹部毛细血管通透性增加产生明显抑制(P<0.05),结果如Tab 3和Fig 4所示。
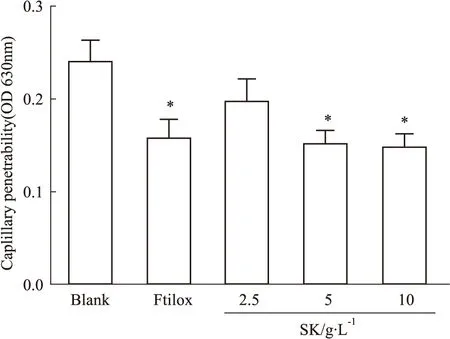
Fig 4 Effect of SK on capillary permeability in mice
Tab 3 Effect of SK on capillary permeability
3 讨论
中药复方配伍是中医药文化的精髓,而药对配伍则是复方的核心[14-15]。丹参是活血化瘀药的典型代表药物,临床上被广泛用于心脑血管系统等疾病的治疗。苦参在临床上则主要用来消炎、抑菌以及肿瘤的联合治疗,并且有相关文献表明苦参的有效成分,如苦参碱和氧化苦参碱等,丹参中丹酚酸IIA等具有明显的抗炎功效[16]。丹参苦参配对,可发挥明显抗炎功效。本实验结果显示,10 g·L-1丹参-苦参提取物能明显减少小鼠耳肿胀模型的肿胀系数,升高急性热刺激引发的疼痛阈值。此外,西药受试药物酞丁安,也发现具有明显抗炎镇痛作用。
促炎细胞因子主要是由免疫细胞分泌的内源性多肽,是炎症反应的主要参与者[17],其中IL-6可以在慢性炎症中通过调控T淋巴细胞的分化和激活,维持调节性T细胞核辅助性T细胞间的平衡而发挥重要作用[18]。丹参-苦参药对核心靶点GO分析与通路分析显示,其发挥药效的途径与免疫过程中细胞因子调控相关。在本研究结果中发现,5 g·L-1和10 g·L-1的浓度下丹参-苦参提取物能明显降低G-CSF和IL-6的水平,从而发挥与酞丁安类似的抗炎作用。
此外,从结果上来看,二甲苯刺激产生的急性炎症反应并未明显改变细胞因子IFN-γ、IL-4、CXCL-1、IL-10、IL-12P70、TNF-α的水平,且受试药物也不能改变其基础水平。而药物对于IL-6,G-CSF的具体作用机制,是通过抑制STAT3通路中何种环节还需进一步研究。除此之外,在5和10 g·L-1的浓度下,丹参苦参提取物能够明显降低炎性组织毛细血管的通透性,减少炎性渗出,进而减少组织的炎性损伤,这与抑制VEGF水平相关。符合网络药理学预测。
最后,通过文献调研发现,丹参中丹参酮不仅能抑制STAT3通路,还可以抑制VEGF通路;同样,苦参中苦参碱及氧化苦参碱均可抑制STAT3通路和VEGF通路。本文基于网络药理学预测潜丹参苦参药对发挥抗炎药效与STAT3通路和VEGF通路相关,而其中丹参酮、苦参碱和氧化苦参碱等可能是发挥药效的主要成分。这为我们接下来研究指明了道路,本文后续将基于STAT3通路和VEGF通路,以丹参苦参药对中主要成分丹参酮、苦参碱和氧化苦参碱为代表,研究其配伍比例,进一步研究丹参-苦参提取物发挥抗炎作用的具体机制。

