栀子有效部位的溃疡性结肠炎活性及其化学成分研究
杨 超,刘 婧,钟 瑞,吴志瑰,2,裴建国,陈 瑶,黄 潇,高 莎,阚 瑞,付小梅,2
(1.江西中医药大学药学院,江西 南昌 330004;2.范崔生全国名中医传承工作室,江西 南昌 330006)
伴随着物质生活的日益改善,不良的生活饮食习惯导致消化系统疾病频发,慢性非特异性疾病溃疡性结肠炎(ulcerative colitis,UC)在国内的发病率也在逐年升高,UC发病后将严重降低患病者的生活质量,病变蔓延将会危及患者生命。在临床诊断上,UC主要表现为腹痛伴严重腹泻、大便浓脓伴血便,患者体重明显减轻、精神萎靡,而且该病情易复发,治疗难度较大[1]。目前,UC的治疗药物主要是柳氮磺胺吡啶水杨酸制剂、皮质类固醇、免疫抑制剂等,由于这些药物的治疗多以缓解症状为主,并且存在停药后易复发、耐药性增加或不良反应多等诸多问题,因此寻找新的治疗药物以及治疗方法迫在眉睫。中国传统中药多为植物源性天然药物,通常副作用较少,对慢性病疗效更佳,所以可能成为UC的重要补充治疗手段。
栀子为临床常用中药,是茜草科栀子属植物栀子GardeniajasminoidesEllis的成熟干燥果实,性寒、味苦,具有泻火除烦、清热利尿、凉血解毒的功效,现代药理研究表明栀子及其中主要成分具有较好的抗炎活性[2-3]。本课题组在前期预实验研究中发现栀子35%及70%乙醇提取部位均具有较好的抗炎作用,但其对UC的研究却未见报道。因此本实验以TNBS诱导的大鼠UC,以栀子35%及70%乙醇提取部位对UC大鼠进行灌胃给药,并对给药后的大鼠进行体重测定,疾病活动指数(DAI)评分,观察给药前后结肠病理学改变及髓过化物酶 (MPO)、超氧化物歧化酶(SOD)、丙二醛(MDA)、一氧化氮(NO)、肿瘤坏死因子-α(TNF-α)、炎症因子白细胞介素-6(IL-6)、白细胞介素-1β (IL-1β)变化,以找寻对溃疡性结肠炎作用的有效部位,同时采用UPLC-ESI-Q-TOF/MS对有效部位中的化学成分进行鉴定研究,明确其活性成分,以期为栀子进一步开发奠定基础。
1 材料
1.1 药物与试剂栀子购自江西省樟树GAP基地,经江西中医药大学范崔生教授鉴定为栀子GardeniajasminoidesEllis 的干燥果实,凭证标本存于江西中医药大学中药鉴定学科组。乙腈和甲醇均为质谱级别(德国Merck公司);TNBS(Sigma aldrich,批号:SLBT1675);柳氮磺吡啶肠溶片(上海信谊天平药业有限公司);NO检测试剂盒(批号:S0021)、MDA检测试剂盒(批号:S0131)、总SOD活性检测试剂盒(批号:S0109)均购买于上海碧云天生物技术有限公司;髓过氧化物酶(MPO)检测试剂盒(南京建成生物科技有限公司);大鼠IL-1β酶联免疫吸附测定试剂盒(批号:A301B81043)、大鼠IL-6酶联免疫吸附测定试剂盒(批号:MM-0190R1)、大鼠TNF-α疫吸附测定试剂盒(批号:A38280855)均购买于杭州联科生物技术股份有限公司;粪便隐血定性检测试剂盒(邻联甲苯胺法)(北京百奥莱博科技有限公司,批号:0311A19)。
1.2 实验动物SPF 级♂ SD 大鼠,体质量(180±20)g,由湖南斯莱克景达实验动物有限公司提供,动物许可证号 SCXK(湘)2016-0004。实验动物伦理委员会所属单位为江西中医药大学,使用许可证号SYXK(赣)2017-0004。
1.3 实验仪器KZ-Ⅱ高速组织研磨仪(武汉赛维尔生物科技有限公司),多功能酶标仪(Thermo Fisher Scientific,USA),Millipore超纯水制备器(美国Millipore公司);KQ-250超声清洗器(昆山市超声仪器有限公司),HH-4型数显恒温水浴锅(国华电器有限公司),BS224S电子天平(北京赛多利斯有限公司);Neofuge 13R型高速冷冻离心机(上海力申科学仪器有限公司);LC-C18SPE固相萃取小柱(上海安谱实验科技股份有限公司);超高效液相色谱串联四级杆飞行时间质谱仪(ABSCIEX Triple TOF 5600+),配有电喷雾离子源(ESI)、Analyst 1.6 色谱工作站和 PeakView 等质谱分析软件(AB SCIEX 公司);Nexera UPLC LC-30A超高效液相色谱仪(日本岛津公司)。
2 方法
2.1 栀子样品制备栀子药材1 010 g,用8倍量70%乙醇回流提取2次,每次2 h,合并滤液,减压浓缩至无醇味,得到栀子浸膏共242 g。取栀子浸膏加水成混悬液,上HPD-600大孔树脂柱,依次用水、35%乙醇、70%乙醇、95%乙醇洗脱,得4个部分洗脱液,浓缩后冷冻干燥,其中35%乙醇洗脱部位(G-35)68.89 g,70%乙醇洗脱部位(G-70)46.62 g。
2.2 动物分组、造模及给药适应性喂养1周后,将35只SD ♂大鼠随机分为5组,即对照组、模型组、阳药(柳氮磺吡啶)组、G-35组,G-70组。采用文献报道方法[4]制备大鼠UC模型,大鼠禁食24 h后一次性将TNBS/50%乙醇溶液混合溶液(1 ∶1混合)用橡胶输液管缓慢注入肛门约8 cm处肠腔内,捏紧肛门,倒置数分钟,造模剂量为50 μL·g-1,对照组注入相同体积生理盐水。造模后d 2开始给药,阳性药柳氮磺吡啶组按200 mg·kg-1剂量给药,35%乙醇和70%乙醇提取部位组均按生药量(2.1g·kg-1)给药,对照组和模型组均予以蒸馏水,以上各组每天给药1次,共给药7 d。
2.3 一般体征观察自建立大鼠UC模型之日起直至灌胃给药结束,每天观察各组大鼠状态(包括精神、活动以及体毛等),每天在同一时间称大鼠质量并记录,观察各组大鼠的粪便情况(包括颜色、性状),并蘸取粪便通过隐血试剂盒测定有无隐血情况,根据以上指标对大鼠进行疾病活动指数(disease activity index,DAI)评分,参照文献[5]所描述的评分标准进行评分。
2.4 结肠黏膜组织病理学观察治疗7 d后处死大鼠,取近肛门8 cm处结肠组织后,将其用甲醛固定后,脱水、浸蜡、包埋、切片,HE染色,显微镜下观察结肠病理情况,并参照文献[6]所描述的评分标准对大鼠结肠溃疡情况进行评分。
2.5 结肠组织的生化指标测定将各组大鼠结肠组织称重,根据试剂盒要求制备组织匀浆液,离心后提取上清液,置于-80 ℃冻存。按照试剂盒说明书的步骤测定各组大鼠结肠MPO、NO、SOD、MDA、IL-1β、IL-6、TNF-α水平。
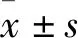
2.7 采用UPLC-ESI-Q-TOF-MS/MS技术分析活性部位化学成分
2.7.1供试品溶液的制备 药效最好的洗脱部位的浸膏约0.01 g,加10 mL甲醇超声溶解,溶液经0.22 μm微孔滤膜过滤,备用。
2.7.2色谱-质谱条件 ACE Excel 1.7 SuperC18 色谱柱(2.1 mm×50 mm,1.7 μm),流动相0.1%甲酸水(A)-乙腈(B),梯度洗脱(0-10 min,5%-15% B;10-12 min,15%-21% B;12-15 min,21% B;15-18 min,21%-23% B;18-20 min,23%-50% B;20-30 min,50%-95% B),流速0.3 mL·min-1;进样量3 μL;柱温40 ℃。离子源:电喷雾离子源(ESI),母离子质量扫描范围:m /z 100-1 000,二级离子碎片质量扫描范围:m/z 50-1 000,IDA 设置响应值超过 100 cps 的峰优先进行二级质谱扫描,开启动态背景扣除(DBS),其它各参数以及参数设置如下:负离子源喷雾电压为-4500 V,离子源温度为500 ℃,去簇电压(DP)-100 V,碰撞能量(CE)为 -45 eV,碰撞能量扩展(CES)为15 eV。雾化气体为N2,辅助气1(GS1)为50 PSI,辅助气2为50 PSI,气帘气(CUR)为40 PSI。
3 结果
3.1 大鼠一般体征观察对照组的大鼠饮水、进食正常,无明显体质量下降,无腹泻、便血等异常改变。模型组的大鼠出现饮食减少,出现不同程度的腹泻、便血、肛门血染等症状,体质量下降趋势高于对照组(P<0.01),模型组DAI评分明显高于对照组(P<0.01)。药物治疗后,阳药组、G-35组以及G-75组饮食饮水状态逐渐恢复,大便腹泻、便血现象逐渐消失,与模型组相比,阳药组、G-35组以及G-75组的大鼠体质量逐渐恢复(P<0.01),DAI评分明显降低(P<0.05,P<0.01),见Fig 1。
3.2 结肠组织病理学观察光镜下观察各组大鼠结肠组织切片发现:对照组结肠表面上皮、隐窝、黏膜肌层、黏膜下层和杯状细胞完整;模型组可见大量上皮破坏,杯状细胞丢失和隐窝脓肿,大量炎性细胞浸润、充血;阳药组和G-35组结肠组织局部损伤,可见部分完整组织结构,炎性细胞浸润程度减弱,显微损伤明显改善,而G-70组肠组织结构损伤较为严重,无明显改善。按病理组织学诊断指标对染色结果进行评分,与对照组相比,模型组病理组织学评分升高(P<0.01);与模型组相比较,G-35组病理组织学评分显著性下降(P<0.01),G-70组与模型组相比差异无显著性,表明栀子G-35能够有效改善TNBS诱导的大鼠肠黏膜损伤、炎症细胞浸润,G-70对大鼠结肠病理损伤无明显改善作用,见Fig 2。
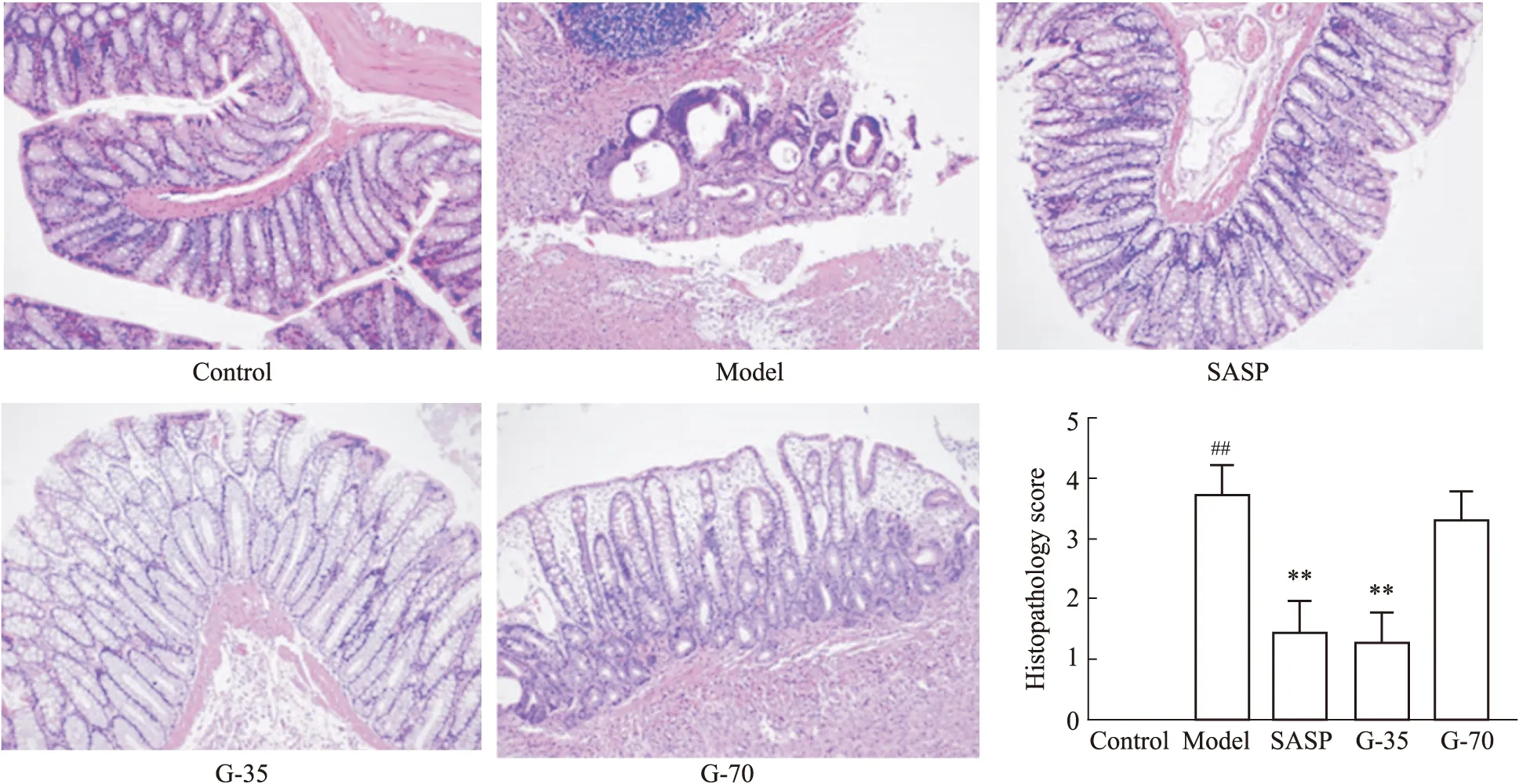
Fig 2 The pathological observation on colon tissues of rats in each group(×200)##P<0.01 vs control group;**P<0.01 vs model group
3.3 结肠组织的生化指标变化
3.3.1栀子不同醇提部位对结肠组织中MPO、NO、SOD、MDA的影响 与对照组相比,模型组大鼠结肠组织MPO、NO、MDA水平升高(P<0.01),SOD水平降低(P<0.01)。与模型组相比,阳药组、G-35组的MPO、NO、MDA水平降低(P<0.01),SOD水平升高(P<0.01)。而G-70组与模型组相比,除SOD水平明显高于模型组外(P<0.05),其它指标与模型组差异无显著性,见Fig 3。
3.3.2栀子不同醇提部位对结肠组织中IL-1β、IL-6、TNF-α的影响 与对照组相比,模型组IL-1β、IL-6、TNF-α水平升高(P<0.01)。与模型组相比,阳药组、G-35组的IL-1β、IL-6、TNF-α水平降低(P<0.01)。而G-70组与模型组相比各项指标差异均无显著性,见Fig 4。
3.4 质谱信息数据库的建立与化学成分鉴定采用UPLC-ESI-Q-TOF-MS/MS对G-35进行化学成分鉴定,通过与对照品比对、保留时间对比、母离子质量数对比、母离子裂解规律分析、查询相关文献信息[7-10]共鉴定出了19个化合物,其总离子流图见Fig 5,化合物的具体信息见Tab 1,包括化合物名称、保留时间(TR)、分子式、质量偏差、离子碎片等。
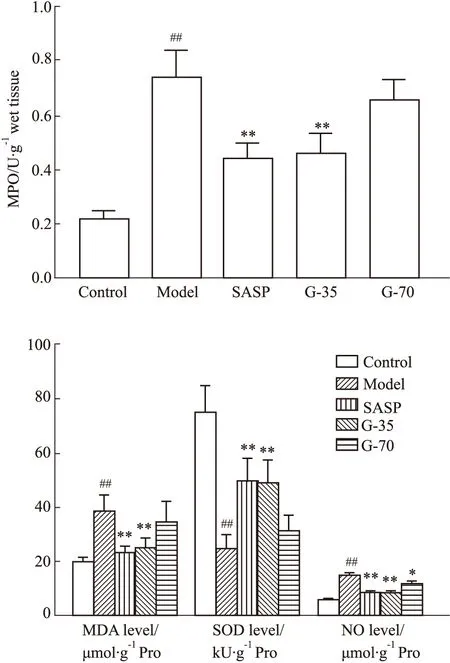
Fig 3 Contents of MPO,NO,SOD and MDA in colon tissues of rats in each group##P<0.01 vs control group;*P<0.05,**P<0.01 vs model group
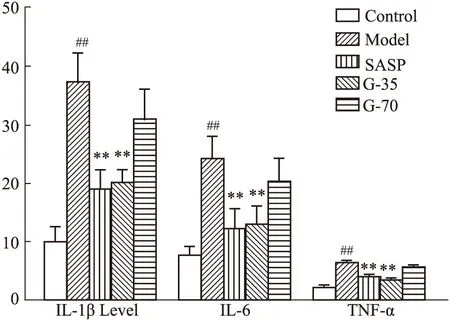
Fig 4 Contents of IL-1β,IL-6 and TNF-α in colon tissues of rats in each group##P<0.01 vs control group;**P<0.01 vs model group
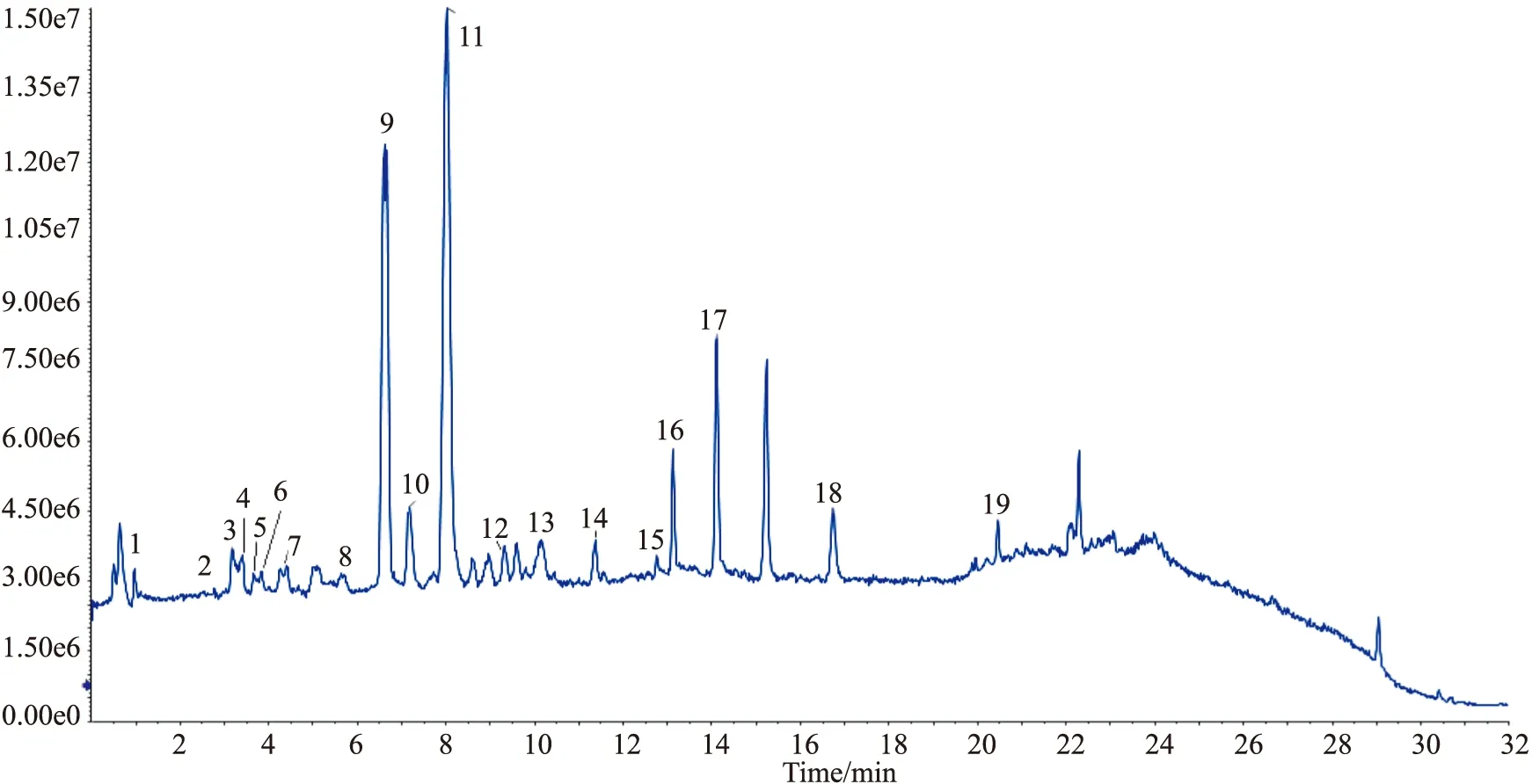
Fig 5 Total ion current under negative ion mode of 35% ethanol extraction siteTab 1 UPLC-ESI-Q-TOF-MS/MS analysis of chemical compositions in G-35 under negative ion mode
4 讨论
本实验采用TNBS混合50%乙醇灌肠诱导的UC大鼠模型,该模型在发病进程、病理表现等方面与人体发病较为类似,是目前最为常用的溃疡性结肠炎动物模型[11]。模型组的大鼠在造模后出现腹泻、稀便、脓血便,活动、进食、体质量均明显减少,镜下观察肠黏膜破损,大量炎性细胞浸润,溃疡形成。与对照组相比,DAI和组织学评分升高,表明造模成功。在给予栀子35%醇提部位治疗后,结肠炎症状减轻,其对应的DAI值和组织学评分优于模型组,表明栀子35%醇提部位对TNBS诱导大鼠形成的UC症状具有明显的治疗作用。
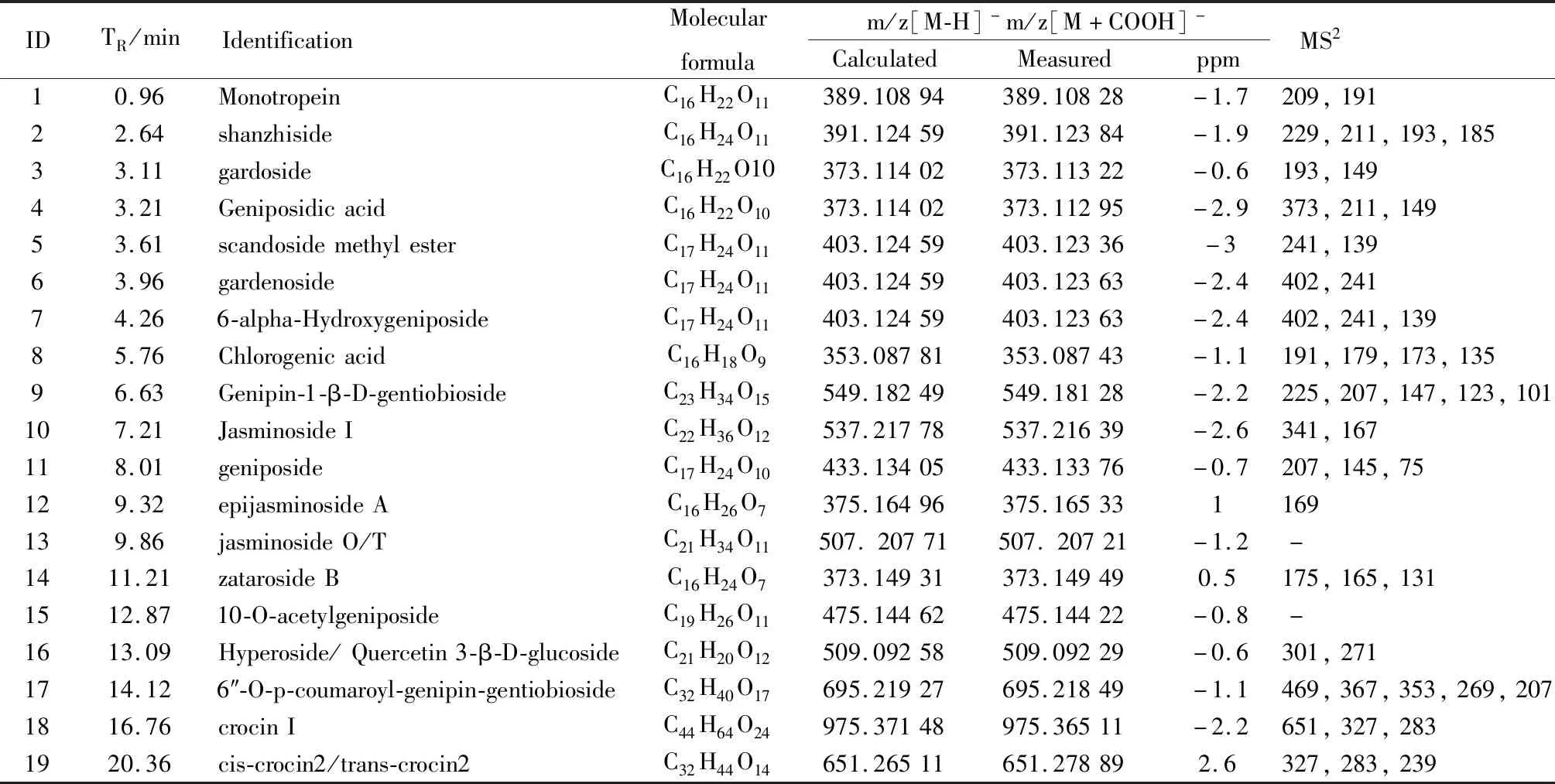
IDTR/minIdentificationMolecularformulam/z[M-H]-m/z[M+COOH]-CalculatedMeasuredppmMS210.96MonotropeinC16H22O11389.10894389.10828-1.7209,19122.64shanzhisideC16H24O11391.12459391.12384-1.9229,211,193,18533.11gardosideC16H22O10373.11402373.11322-0.6193,14943.21GeniposidicacidC16H22O10373.11402373.11295-2.9373,211,14953.61scandosidemethylesterC17H24O11403.12459403.12336-3241,13963.96gardenosideC17H24O11403.12459403.12363-2.4402,24174.266-alpha-HydroxygeniposideC17H24O11403.12459403.12363-2.4402,241,13985.76ChlorogenicacidC16H18O9353.08781353.08743-1.1191,179,173,13596.63Genipin-1-β-D-gentiobiosideC23H34O15549.18249549.18128-2.2225,207,147,123,101107.21JasminosideIC22H36O12537.21778537.21639-2.6341,167118.01geniposideC17H24O10433.13405433.13376-0.7207,145,75129.32epijasminosideAC16H26O7375.16496375.165331169139.86jasminosideO/TC21H34O11507.20771507.20721-1.2-1411.21zatarosideBC16H24O7373.14931373.149490.5175,165,1311512.8710-O-acetylgeniposideC19H26O11475.14462475.14422-0.8-1613.09Hyperoside/Quercetin3-β-D-glucosideC21H20O12509.09258509.09229-0.6301,2711714.126″-O-p-coumaroyl-genipin-gentiobiosideC32H40O17695.21927695.21849-1.1469,367,353,269,2071816.76crocinIC44H64O24975.37148975.36511-2.2651,327,2831920.36cis-crocin2/trans-crocin2C32H44O14651.26511651.278892.6327,283,239
由于机体的氧化应激失衡与UC的发病密不可分,过氧化反应作为发生UC的重要因素,氧自由基水平的升高会激发炎症反应,活性氧自由基的产生超过了机体对过氧化物的清除能力就会导致机体的氧化系统及抗氧化系统失去平衡,过多的活性氧自由基会导致脂质过氧化、蛋白质变性及诱发基因突变,最终导致细胞的氧化损伤[12-13]。酶抗氧化防御体系和脂质过氧化是反应氧化应激的经典指标,SOD作为酶抗氧化防御体统中主要抗氧化酶,MDA作为脂质过氧化的主要产物,而在UC结肠组织中,SOD活性往往下降,MDA含量升高。本研究结果显示栀子35%醇提部位能提高SOD活性,降低MDA含量,表明该部位改善结肠损伤的原因可能与其抗氧化作用有一定联系。
过量的NO产生会导致结肠黏膜损伤,并与结肠炎的发病机制有关,因此NO可作为炎症性肠病的重要生物标志物。中性粒细胞浸润炎症黏膜是炎症性肠病最突出的组织学表现之一,MPO活性作为中性粒细胞浸润的一个重要生物标志物,其常在临床和实验研究中作为评价结肠炎症的程度的指标[14]。在UC的病理发展中,促炎细胞因子如NF-α、IL-6和IL-1β同样也起到重要作用[15-16],TNF-α作为一种多效细胞因子,可诱导广泛的生理和致病现象,如细胞增殖、分化、死亡、基因转录和炎症的调节;IL-1β可通过促进血管因子生成发挥抗皮质素作用,使内皮细胞存活、增殖和产生基质金属蛋白酶;IL-6可在UC和CD的炎症样本中被检测到,其水平与肠道炎症程度相关。在本研究中,TNBS诱导的大鼠结肠MPO、NO、IL-6、TNF-α及IL-1β水平升高,提示肠黏膜出现炎症反应,栀子35%醇提部位能降低组织MPO、NO、IL-6、TNF-α及IL-1β水平,表明该部位对TNBS诱导的UC起保护作用可能是通过抑制中性粒细胞浸润作用,抑制炎症因子释放,从而起到限制炎症的发生和发展作用。
为了进一步确定栀子35%乙醇洗脱部位的成分,明确治疗UC的物质基础,本实验采用UPLC-ESI-Q-TOF-MS/MS技术对该部分进行了分析鉴定。通过一级质谱提供的分子量和二级质谱给出的碎片信息,结合文献数据对于该部分进行鉴定,共鉴定出19个化合物,主要包括环烯醚萜及其苷类成分、有机酸类、黄酮类、西红花苷类等成分,其中化合物8(绿原酸)和化合物11(京尼平苷)均已被证明具有治疗UC的作用[17-18]。而该部位中其它单体成分是否具有治疗作用,成分与成分之间是否有相互作用,成分是否通过抗氧化及抗炎的共同作用将进一步深入研究。

