类叶升麻苷调节AKT/NFκB通路改善APP/PS1双转基因小鼠的认知障碍作用
王冬青,高 莉,孔 征,闫 明
(1.新疆医科大学药学院,2.新疆维吾尔自治区维吾尔医药研究所,新疆维吾尔医方剂学重点实验室,新疆 乌鲁木齐 830011)
阿尔茨海默病(Alzheimer’s disease,AD)是一种神经变性病,以进行性记忆力减退和获得性知识丧失,直至日常生活活动能力完全丧失为特征,给社会和家庭带来沉重负担,成为严重的社会和医疗卫生问题[1]。因此,在AD的药物治疗中,疗效较高且毒副作用小的新型创新药物研究成为当前有效干预治疗AD的重要措施。但是AD的发病机制比较复杂,越来越多的证据显示,细胞凋亡、细胞周期失调与AD有密切关系,影响着神经元的易损性和神经变性的途径。AKT、NF-κB与细胞内多种调节机制环节密切相关,影响细胞凋亡和细胞周期调控[2]。众多研究结果也表明,许多细胞的繁殖和生存均受到AKT、NF-κB调控的影响,通过配体与受体之间的相互作用,激活下游信号级联介质[3]。一些研究发现,AD患者脑神经元的凋亡率显著高于正常人,众多相关凋亡基因体现为高表达,故认为由凋亡基因介导的神经元凋亡是导致AD的主要原因[4]。目前研究的热点在于对凋亡基因的调控,大量研究发现PI3-K/AKT信号通路是促细胞存活的通路之一,PI3-K在生长因子受体等胞外信号活化后,激活下游蛋白激酶AKT,活化的AKT可以磷酸化凋亡基因,进凋亡基因失活,从而抑制神经元凋亡以及促进神经元的存活。NFκB作为信号传导途径的枢纽,与免疫、肿瘤的发生、发展以及细胞凋亡的调节等联系密切,是一种重要的核转录因子,而NFκB活化过度是引起神经细胞凋亡的主要原因。本课题的研究对象,类叶升麻苷(acteoside,AS)是苯乙醇苷类主要药效成分之一,课题组前期对其改善脑损伤、改善学习记忆障碍、抗氧化、保护神经细胞等方面也进行了研究[5]。AS能有效减轻神经元损伤,起到神经元功能保护作用、调控细胞凋亡和细胞周期,进而减轻神经元损害发挥改善学习记忆能力的作用[6-7]。为了进一步探讨AS增强学习记忆的作用和机制,本实验从AKT、NF-κB抑制细胞凋亡而产生神经细胞保护作用的角度,探究AS对APP/PS1双转基因小鼠模型学习记忆的改善作用。
1 材料与方法
1.1 药物及试剂AS(新疆维吾尔自治区维吾尔医药研究所自制,纯度 ≥98%,批号 201708),盐酸多奈哌齐片[卫材(中国)药业有限公司制造,批号1704062],Anti-NF-κB p65(abcam,ab16502),Anti-NFκB p65 phoshpo S536(abcam ab76302),AKT Rabbit PolyAb (Proteintech,10176-2-AP),p-AKT(Ser473)(ST,4060s),phospho-AKT(Thr308)(ST,4056s)。
1.2 仪器IVC-Ⅱ型独立送风隔离笼具(苏州市冯氏实验动物设备有限公司),XR-XY1032旷场视频分析系统(上海欣软信息科技有限公司),Go1510全波长酶标仪(Thermo Fisher Scientific Oy RatAStie 2.FL-01620 Vantaa.Finland),Allegra 64R 离心机(BECKMAN),TL2010S高通量组织研磨仪(SOP-EQ036),SQP电子天平(赛多利斯科学仪器(北京)有限公司),L92-1温度及湿度黑匣子(杭州路格科技有限公司),FJY2002-UV基因研究型超纯水机(青岛宫勒姆科技有限公司),IMS-40全自动雪花制冰机(杭州三永德仪器仪表有限公司),LDZM-80KCS-Ⅱ型立式压力蒸汽灭菌锅(上海申安医疗器械厂),电泳仪(OMKS001,伯乐生命医学产品(上海)有限公司),摇床(1704625,海门市其林贝尔仪器制造有限公司,凝胶成像系统(20150168,伯乐生命医学产品(上海)有限公司)。
1.3 实验动物本实验所需的SPF级小鼠共60只(C5710只,APP/PS1模型鼠50只♀♂各半),许可证号:SCXK(京)2019-0008,单位名称:北京华阜康生物科技股份有限公司。购买4月龄小鼠,体质量(17-24) g。饲养于新疆维吾尔自治区维吾尔医药研究所SPF级动物房,单笼饲养。室温(21-25) ℃,相对湿度50%-60%,12 h明暗交替饲养,自由摄食饮水。
1.4 分组及给药根据北京华阜康生物科技股份有限公司出具的基因证明对动物进行基因筛选,并通过Y迷宫筛选行为异常的小鼠,筛选出60只合格动物,♀♂各半,随机分成6组。连续60 d每天灌胃给药1次,每组给药剂量为0.1 mL·10 kg-1,配制方法如下:正常对照组:(C57小鼠),超纯水;模型组:(APP/PS1小鼠),超纯水;多奈哌齐组:称取盐酸多奈哌齐片 56 mg,混悬于10 mL超纯水后以2 mg·kg-1给药;AS低剂量组:称取AS 25 mg,混悬于10 mL超纯水以25 mg·mg·kg-1给药;AS中剂量组:称取AS 50 mg,混悬于10 mL超纯水以50 mg·mg·kg-1给药;AS高剂量组:称取AS 100 mg,混悬于10 mL超纯水以100 mg·mg·kg-1给药。
1.5 筑巢实验筑巢实验考察动物的社会活动及日常行为能力,分别于给药前、给药d 30、60进行筑巢实验。将已裁剪好的大小相同的32块5 cm × 5 cm的正方形纸屑均匀的散布在小鼠笼内,使小鼠自由在笼内自由活动12 h后,按照以下评分法对小鼠筑巢行为进行盲评,以此作为小鼠筑巢的成绩,并进行统计学检验。1分,纸张仍然散落在笼子里,没有咬痕;2分,纸张聚集到笼子的一侧,但松散,没有形状明显的巢和显著的咬或折;3分,纸张聚集在一起但为相对扁平的巢穴,没有明显的咬痕;4分,纸张聚集形成一个深窝,并有明显的咬痕。
1.6 新物体识别实验新物体识别实验(novel object recognition task,NORT),用于考察小鼠非空间认知行为能力。整个实验分为3个阶段,适应期是让小鼠适应环境,将小鼠背对操作者轻轻放入新物体识别实验箱正中格,使其在开阔的箱体中适应环境20 min,之后放回饲养笼;学习期是让小鼠接触适应3 d。在箱体的一侧壁的左右两端放置两个完全相同的物体a1及物体a2,使其熟悉探究物体及环境10 min。最后一阶段为测试期:a1不变,a2跟换为b,新物体于旧物体等高等直径,再次放入小鼠探索5 min,测试全过程视屏录像,记录小鼠探查新物体总时间Tb、总次数和探查旧物体总时间Ta、总次数以及优先指数Preferential index(P.I)等指标,(P.I=[Tb/(Ta+Tb)×100%]检验小鼠的认知能力,评价小鼠对事物的辨认及记忆能力。
1.7 标本采集及处理摘眼球取血,取小鼠大脑,冰上剥离脑组织,迅速分离出皮层和海马,分别装于已知重量的EP管中,称质量后通过差减法计算质量,置于-80 ℃冰箱备用。
1.8 Western blot检测AKT、NFκB及相关蛋白的表达,首先用PBS磷酸盐缓冲液洗涤,经组织研磨仪裂解,离心,酶标仪蛋白定量,最后用聚丙烯酰胺凝胶电泳分离,60 V电压转膜后封闭,孵育一抗4 ℃过夜,孵育二抗,显色,曝光。
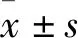
2 结果
2.1 AS对小鼠筑巢实验的影响筑巢实验结果显示(Fig 1,Tab 1)。在给药前及给药30 d各组并未出现显著差异,总体评分在3分左右,给药60 d结果显示,与正常组相比,模型组评分显著降低(P<0.01);与模型组相比,AS低、中、高剂量组的评分均显著提升(P<0.05),阳性药多奈哌齐组评分也有提升,但未出现显著性差异。这表明长期给药,AS可以改善模型小鼠的筑巢行为能力。
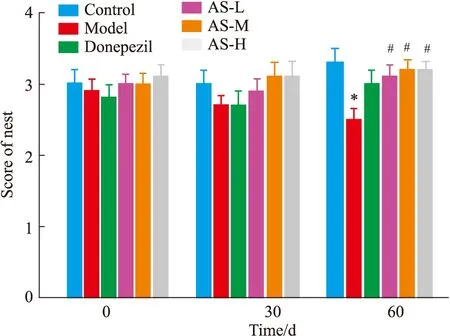
Fig 1 Effect of AS on nesting experiments in APP/PS1 mice (,n=10)*P<0.05 vs control group;#P<0.05 vs model group

Tab 1 Effect of AS on nesting scores of APP/PS1 mice (,n=10)
2.2 AS对小鼠新物体识别实验的影响NORT结果显示(Fig 2,Tab 2),在NORT测试期间,与正常组相比,模型组PI值降低(P<0.01);与模型组相比,阳性药组及AS给药组PI值均显著提升(P<0.05)。同时,模型组在新物体停留的时间较正常组显著降低,正常组在新物体停留时间为模型组的2.71倍;与模型组相比,AS中、高剂量组在新物体的停留时间显著增加,分别为模型组停留时间的2.60、2.75倍(P<0.01),AS低剂量组与多奈哌齐组相比虽没有显著性差异,但均有提高的趋势,在新物体的停留时间为模型组的1.98倍。其次,与正常组相比,模型鼠对新旧物体的总探索时间显著减少(P<0.01),正常组的总探索时间是模型组的2倍,与模型组相比,AS各给药组同的阳性药多奈哌齐一致,均有显著提升。而各组小鼠在旧物体的停留时间没有显著性差异。

Tab 2 Effect of AS on object recognition memory of APP/PS1 mice (,n=10)
2.3 AS对APP/PS1模型鼠AKT及相关蛋白表达的影响经Western blot检测结果显示(Fig 3),在海马中,与正常组比较,模型组小鼠p-AKT-308/AKT、p-AKT-473/AKT比值显著降低(P<0.01);与模型组比较,多奈哌齐组及AS低、中、高剂量组小鼠p-AKT-308/AKT、p-AKT-473/AKT比值均显著升高(P<0.01)。同时,在皮层中,与正常组比较,模型组小鼠p-AKT-308/AKT、p-AKT-473/AKT比值显著降低(P<0.01);与模型组比较,AS低、中、高剂量组同多奈哌齐结果一致,p-AKT-473/AKT比值均有不同程度的升高(P<0.01或P<0.05),对于p-AKT-308/AKT,AS低剂量组作用明显,中、高剂量虽未出现显著性差异,但有上升的趋势。
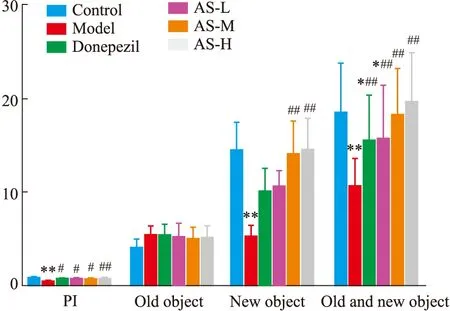
Fig 2 Effect of AS on object recognition memory in APP/PS1 mice (,n=10)*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs model group
2.4 AS 对APP/PS1模型鼠NF-κB及相关蛋白表达的影响NFκB蛋白表达结果显示(Fig 4),在海马组织中,与正常组相比,模型组NFκB p-p65/NFκB p65表达量明显升高(P<0.01)。与模型组相比,阳性药多奈哌齐及AS各给药组均可显著降低NFκB p-p65/NFκB p65的表达(P<0.01),其中AS低剂量作用最明显,比值降低21.95%。同时,在皮层中,与正常相比,模型组中的NFκB p-p65/NFκB p65比值显著升高(P<0.01);与模型组相比,阳性药多奈哌齐及AS低中高剂量均可显著降低NFκB p-p65/NFκB p65的表达(P<0.01),这说明AS能下调NFκB的表达,从而发挥其神经保护作用。
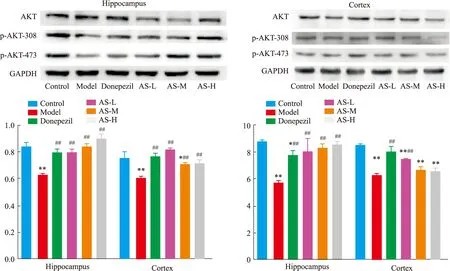
Fig 3 AS expression of AKT and phosphorylation sites Thr308,Ser473 proteins in mice(,n=3)*P<0.05,**P<0.01 vs control group;##P<0.01 vs model group.
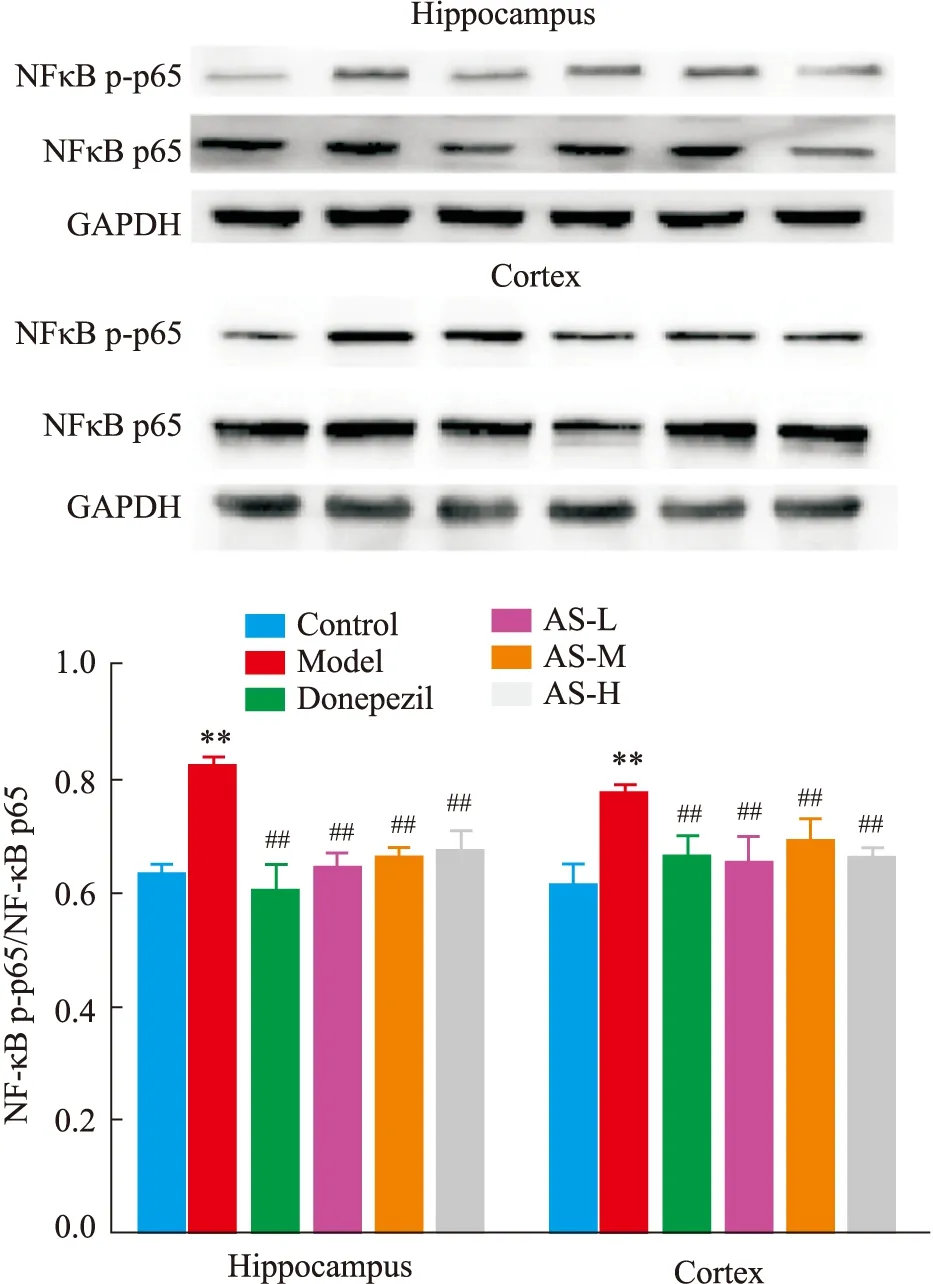
Fig 4 Effect of AS on NFκB p-p65/NFκB p65 protein expression in mice ±s, n=3)**P<0.01 vs control group;##P<0.01 vs model group.
3 讨论
筑巢实验方法简单易行,无太大的应激刺激,可反映小鼠的社会行为和日常生活能力,已被作为动物行为学的一种新的手段与方法。给药60 d发现,与正常组相比,模型组评分显著降低,模型组小鼠多表现为无形状明显的巢或者巢相对扁平,纸张无明显的咬痕;而AS给药组评分显著提升。这表明长期给药,AS可以改善模型小鼠的筑巢行为能力。NORT实验对动物来说无任何压力,也不要求空间定位。它长期以来被用来衡量各种AD模型动物的学习和记忆能力。在NORT测试期间,模型组PI值降低,在新物体停留的时间降低,对新旧物体的总探索时间减少;而AS可以提升PI值,增加痴呆小鼠在新物体的停留时间和探索时间。说明阿尔茨海默症小鼠对新物体探索兴趣较低,AS可提高AD小鼠探索新物体的能力,使其在新事物处保持更长的停留时间,改善APP/ PS1痴呆小鼠的记忆,提升其对新物体的探索兴趣。
APP/PS1双转基因小鼠认知功能障碍出现的月龄一般在6-8月龄,故本实验选取6月龄小鼠进行早期干预[8]。此时段动物模型正处于 Aβ 沉积的早期阶段,出现的行为学障碍与AD患者病程早期认知功能障碍相似,能较好的模拟疾病状态。AKT为丝氨酸苏氨酸蛋白激酶,是PI3K信号转导途径中一个重要的下游靶激酶,是重要的抗凋亡调节因子,在维持细胞正常生理功能及细胞凋亡方面发挥重要作用[9]。AKT是强有力的下游底物Bad激酶,活化的AKT可以使Bad的Ser136位点磷酸化,从而阻断Bad诱导的细胞凋亡,而磷酸化位点Thr308和Ser473可以使AKT激活,从而抑制凋亡,促进增殖[10]。本次实验中发现,在海马及皮层中,模型组小鼠p-AKT-308/AKT、p-AKT-473/AKT比值较正常组显著降低;AS 可以显著升高p-AKT-308/AKT、p-AKT-473/AKT。说明AS的神经保护作用可能与其对PI3K/AKT信号通路的激活有关,恢复了部分凋亡细胞的功能,减少了细胞凋亡的系列反应,从而起神经保护作用。
AKT的活性变化与核转录因子NFκB密切相关,在诸多生物学效应中,活化态的AKT可磷酸化IкB激酶(IкB kinase,IKK),IKK活化而降解NFκB,而NFκB在执行和控制细胞凋亡的过程中发挥重要作用,它能够促进促凋亡基因如天冬氨酸特异的半耽氨酸蛋白激酶家族等的表达,从而促进组织细胞凋亡[11]。NFκB是一个由复杂的多肽亚单位组成的蛋白家族,以各种同源或异源的NFκB/Rel构成的一种二聚体蛋白,其中p65/p50异源二聚体发挥主要作用[12]。NFκB的激活可以使胶质细胞中炎症介质产生、自由基生成增多、诱发细胞凋亡,Aβ的增多和沉积、形成、神经元损伤及丢失,所以神经细胞中NFκB活化过度是引起神经细胞凋亡和包括AD在内的退行性病变的主要原因[13]。温蒲圆[14]研究表明,Aβ通过激活NFκB通路对体外培养神经元产生毒害作用,导致神经元凋亡。本次实验结果显示,在海马及皮层组织中,模型组NFκB p-p65/NFκB p65表达量显著升高,AS可显著降低NFκB p-p65/NFκB p65的表达。这说明AS能下调NFκB的表达,提示AS可能通过抑制NFκB的活性来减少Aβ的毒性作用,发挥其神经保护作用,为后续实验提供了一定的依据,而明确的作用机制,有待于进一步深入研究。

