黄芩苷对脂多糖致内皮细胞炎症反应的保护作用及机制研究
路青瑜,郭 丽,张启云,杨付梅,李 娇,孙黔云
(贵州医科大学省部共建药用植物功效与利用国家重点实验室,贵州省中国科学院天然产物化学重点实验室,贵州 贵阳 550014)
内皮细胞作为机体重要的代谢和内分泌器官,在调节血管功能方面起着重要作用[1],其活化和损伤与动脉粥样硬化、高血压、糖尿病血管病变等多种心脑血管疾病的发生和发展密切相关[2]。在损伤细胞的诸多因素中,脂多糖(lipopolysaccharides,LPS)是一个重要因素。LPS作为刺激内皮细胞产生炎症反应的强效物质,在脓毒症、中毒性休克、全身性炎症反应综合征和多脏器功能障碍综合征中扮演了重要的角色。干预LPS的炎症损伤一直是研究的热点。黄芩苷(Baicalin)是传统中药黄芩中的重要活性成分,具有清热解毒、抗肿瘤、降糖降脂、保肝及抗炎等作用[4]。近年来研究表明黄芩苷对LPS诱导的细胞炎症损伤具有干预作用[5-7],但其保护作用及机制仍有待进一步深入研究。本研究基于前期的筛选,开展了黄芩苷对脂多糖诱导的微血管内皮细胞炎症反应的作用及机制研究,以进一步认识和挖掘黄芩苷的药理活性。
1 材料
1.1 试剂胎牛血清(fetal bovine serum,FBS)购于阿根廷Natocor-Industria Biológica公司;RPMI 1640培养基购自美国Gibco公司;Toll-like Receptor 4(TLR4)抗体购自美国Santa Cruz Biotechnology公司(货号:sc-293072);NF-κB p65、p-NF-κB p65、β-actin抗体均购自美国CST公司,货号分别为8242S、3033S、4970S;双荧光素酶报告基因检测试剂盒购自美国Promega公司;感受态细胞DH5α购自北京康为世纪生物科技有限公司;质粒小量提取试剂盒、Lipo6000TM脂质体转染试剂、BCA蛋白定量试剂盒、BCA蛋白浓度测定试剂盒(增强型)、ECL超敏显影液、NF-κB激活-核转运试剂盒、钙离子荧光探针Fluo-4 AM均购自于江苏碧云天生物技术研究所;黄芩苷标准品购自于北京索莱宝生物科技有限公司(货号:SB8020);肿瘤坏死因子重组蛋白TNF-α购自北京义翘神州生物科技有限公司(货号:10602-HNAE);细胞间黏附分子1(intracellular adhesion molecule 1,ICAM-1)、白细胞介素6(interleukin 6,IL-6)、单核细胞趋化因子1(Monocyte chemoattractant protein 1,MCP-1)ELISA检测试剂盒均购自武汉博士德生物工程有限公司;吡咯烷二硫氨基甲酸(pyrrolidinedithiocarbamate,PDTC)、脂多糖(lipopolysaccharides,LPS)均购自美国Sigma公司,货号分别为P8765、L6529;其他试剂均为分析纯。
1.2 仪器NanoDrop 2000C 超微量分光光度计(美国Thermo公司);TS2-S-SM倒置相差显微镜、TS2-FL倒置荧光显微镜(日本Nikon公司);NovoCyte 2040R流式细胞仪(美国ACEA公司);连续波长酶标仪Gen5(美国Bio Tek公司);高内涵筛选系统CellInsight CX5(美国Thermo公司);ESCO CLM-170B-8-NF CO2培养箱(新加坡ESCO公司);GloMax 96化学发光检测仪(美国Promega公司);Fusion Fx Spectra化学发光成像分析系统(法国Vilber Lourmat公司);Milli-Q Integral 超纯水系统(美国Milipore公司);电泳、转印系统(美国Bio-Rad公司)。
2 方法
2.1 内皮细胞培养人微血管内皮细胞株(human microvasular endothelial cell,HMEC)HMEC由本实验室传代培养,用含10%胎牛血清的RPMI 1640培养基于37 ℃,5% CO2条件下培养,收集对数生长期细胞进行实验。
2.2 LPS对HMEC黏附分子及炎症介质表达的影响将对数生长期的HMEC以1×104个/孔接种于96孔培养板,培养24 h后弃上清,加入90 μL不含血清的RPMI 1640培养基,再加入10 μL LPS(终浓度为5 mg·L-1),同时设置正常对照组,分别培养0、6、12、24 h取上清用于测定ICAM-1、IL-6、MCP-1,上述各指标的测定均按照说明书进行。
2.3 黄芩苷对LPS刺激HMEC表达黏附分子及炎症介质的影响
2.3.1黄芩苷样品溶液的配制 准确称取适量的黄芩苷,用DMSO完全溶解,配制成0.1 mol·L-1的溶液,分装,于-80 ℃保存,临用前化冻后用无血清培养基按10倍逐级稀释至1.0×10-6、1.0×10-7、1.0×10-8mol·L-1。
2.3.2黄芩苷对LPS刺激HMEC表达MCP-1、ICAM-1、IL-6的影响 将对数生长期的HMEC以1×104个/孔接种于96孔培养板,培养24 h后弃上清,分别加入含不同浓度(基于前期筛选,黄芩苷的终浓度分别为1.0×10-6、1.0×10-7、1.0×10-8mol·L-1)黄芩苷的RPMI-1640培养基90 μL预处理细胞3 h,再加入10 μL LPS(终浓度为5 mg·L-1),37 ℃培养12 h取培养上清进行MCP-1检测,培养24 h取培养上清进行ICAM-1、IL-6检测,同时分别设置模型组、正常对照组、阳性药物组PDTC(1.0×10-5mol·L-1)
2.4 Ca2+内流的检测
2.4.1荧光观察Ca2+内流 将对数生长期的HMEC以1×104个/孔接种于96孔培养板,培养24 h后各组(组别设置同“2.3.2”)参照“2.3.2”进行相应处理,加入LPS刺激1 h,PBS洗3次,加入Ca2+荧光探针Fluo-4 AM于37 ℃孵育30 min,PBS洗3次,于37 ℃继续孵育20 min,用荧光显微镜观察Ca2+内流变化。
2.4.2流式细胞仪检测钙离子内流 将对数生长期的HMEC以2×104个/孔接种于48孔培养板,培养24 h后各组参照“2.3.2”进行相应处理(组别设置同“2.3.2”),加入LPS刺激1 h,PBS洗1次,胰酶消化,离心收集细胞,PBS洗3次,加入钙离子荧光探针Fluo-4 AM于37 ℃孵育30 min,PBS洗3次,于37 ℃继续孵育20 min,然后加入PBS将细胞混匀成细胞悬液,于流式细胞仪上检测,结果用相对荧光强度表示。
2.5 NF-κB p65入核的检测将对数生长期的HMEC按1×104个/孔接种于96孔培养板,培养24 h后各组参照“2.3.2”进行相应处理,同时分别设置模型组、正常对照组、阳性药物组(PDTC,终浓度为1.0×10-5mol·L-1)、阳性对照组(TNF-α,终浓度为100 μg·L-1),加入LPS刺激3 h,采用免疫荧光法检测NF-κB p65入核,操作按照NF-kB激活-核转运试剂盒说明书进行,入核信号强度用内源性p65的细胞核荧光强度/细胞浆荧光强度(nuc/cyt fluorescence intensity)来计算,荧光强度采用Cellinsight Cx5软件进行分析。共进行3次独立实验,每次实验每个组别分别设置2个平行孔,每孔随机选取9个视野进行拍摄和数据分析。
2.6 NF-kB转录活性的检测
2.6.1质粒制备 质粒的制备及浓度检测方法参照文献[8]。
2.6.2双荧光素报告基因检测 将对数生长期的HMEC以1×104个/孔接种于不透光的96孔细胞培养板,培养24 h后进行转染,弃去上清,换液,加入90 μL含血清的RPMI 1640培养基进行转染,转染16 h后弃上清,各组参照“2.3.2”进行相应处理,组别设置同2.3.2,加入LPS刺激6 h后进行荧光强度的检测。具体方法和计算公式参照文献[8]。
2.7Western blot检测NF-κB p65、p-NF-κB p65及TLR4的表达 将HMEC按1×106个/瓶接种,培养24 h后各组(组别设置同“2.3.2”,其中黄芩苷的终浓度为1.0×10-6mol·L-1)参照“2.3.2”进行相应处理,加入LPS分别刺激6 h、24 h,弃去细胞培养液,用PBS进行冲洗,刮下细胞进行离心,按照蛋白抽提试剂盒进行蛋白抽提,BCA法测定蛋白浓度。进行10% SDS-PAGE电泳、转膜、封闭,一抗孵育过夜,二抗孵育1 h,用化学发光成像系统进行曝光和显影并进行量化分析。
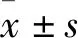
3 结果
3.1 LPS对HMEC黏附分子及炎症介质表达的影响
3.1.1LPS对HMEC表达黏附分子ICAM-1的影响 LPS刺激HMEC后ICAM-1的表达在12 h出现上调(Fig 1),在24 h与对照组的差异有显著性(P<0.01)。

Fig 1 Expression of ICAM-1 after HMEC **P<0.01 vs control
3.1.2LPS对HMEC表达炎症介质的影响 LPS刺激HMEC后,IL-6、MCP-1在各时间点的表达均有不同程度的增加(Fig 2),其中,IL-6的表达持续上调,在12 h、24 h与对照组的差异有显著性(P<0.01)。MCP-1的表达也呈上调趋势,在12 h达到峰值。
3.2 黄芩苷对HMEC黏附分子及炎症介质表达变化的影响
3.2.1黄芩苷对LPS刺激HMEC表达ICAM-1的影响 黄芩苷对LPS刺激HMEC表达ICAM-1具有干预作用(Fig 3),且抑制作用呈现一定的量效关系。

Fig 2 Expression of IL-6 and MCP-1 after HMEC exposure to A:IL-6;B:MCP-1.**P<0.01 vs control
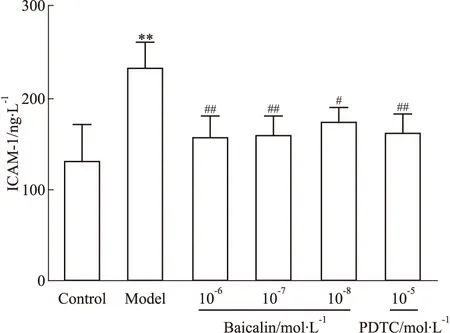
Fig 3 Effect of baicalin on expression of ICAM-1 after HMEC exposure to **P<0.01 vs control;#P<0.05,##P<0.01 vs model
3.2.2黄芩苷对LPS刺激HMEC表达炎症介质的影响 黄芩苷对LPS刺激HMEC表达IL-6、MCP-1具有干预作用(Fig 4),且作用具有量效关系,其中中高剂量组与模型组的差异有统计学意义(P<0.05,P<0.01)。

Fig 4 Effect of baicalin on expression of IL-6 and MCP-1 after HMEC exposure to A:IL-6;B:MCP-1.**P<0.01 vs control;#P<0.05,##P<0.01 vs model
3.3 黄芩苷对Ca2+内流的影响HMEC受LPS刺激后,发生了明显的Ca2+内流,细胞内的Ca2+与Fluo-4结合后产生绿色荧光,黄芩苷对Ca2+内流有抑制作用(Fig 5)。采用流式细胞仪定量测定结果表明,模型组的Ca2+内流与对照组相比,差异有显著性(P<0.05)。3个浓度的黄芩苷对Ca2+内流均有抑制作用(Fig 6),其中高浓度组与模型组相比,差异有显著性(P<0.05)。
3.4 黄芩苷对NF-κB p65入核的影响HMEC受到刺激后,其核内荧光强度增加(Fig 7),模型组细胞核荧光强度/细胞质荧光强度(nuc/cyt fluorescence intensity)比值高于对照组(Fig 8),差异有统计学意义(P<0.05)。高剂量组黄芩苷的荧光强度比值降低,与模型组相比,差异有显著性(P<0.05)。
3.5 黄芩苷对NF-κB核转录活性的影响LPS刺激HMEC后,NF-κB p65核转录活性上调(Fig 9),而黄芩苷对LPS所致的核转录活性增强有干预作用,结果呈现量效关系,其中高剂量组与模型组的差异有显著性(P<0.05)。

Fig 5 Effect of baicalin on influx of calcium observed by fluorescence after HMEC exposure to LPS(×100)A:Control group;B:Model group;C:PDTC group;D:Baicalin high dose group;E:Baicalin middle dose group;F:Baicalin low dose group

Fig 6 Effect of baicalin on relative fluorescence intensity of influx of calcium ion measured by flow cytometry after HMEC exposure to *P<0.05 vs control;#P<0.05 vs model
3.6 黄芩苷对蛋白NF-κB p65、p-NF-κB及TLR4表达的影响Western blot检测结果表明,p-NF-κB p65、TLR4及NF-κB p65的表达均上调(Fig 10),其中模型组p-NF-κB p65、TLR4的表达与对照组相比,差异有显著性(P<0.05,P<0.01)。而采用高剂量的黄芩苷干预后,p-NF-κB p65、TLR4及NF-κB p65的表达明显下调,与模型组相比,差异有统计学意义(P<0.05或P<0.01)。

Fig 7 Effect of baicalin on the nuclear translocation of NF-κB p65 after HMEC exposure to LPS(×200,n=3)nuclei with DAPI staining,blue;NF-κB p65 with Cy3 staining,red

Fig 8 Effect of baicalin on nuc/cyt fluorescence intensity of NF-κB p65 after HMEC exposure to *P<0.05,**P<0.01 vs control;#P<0.05 vs model
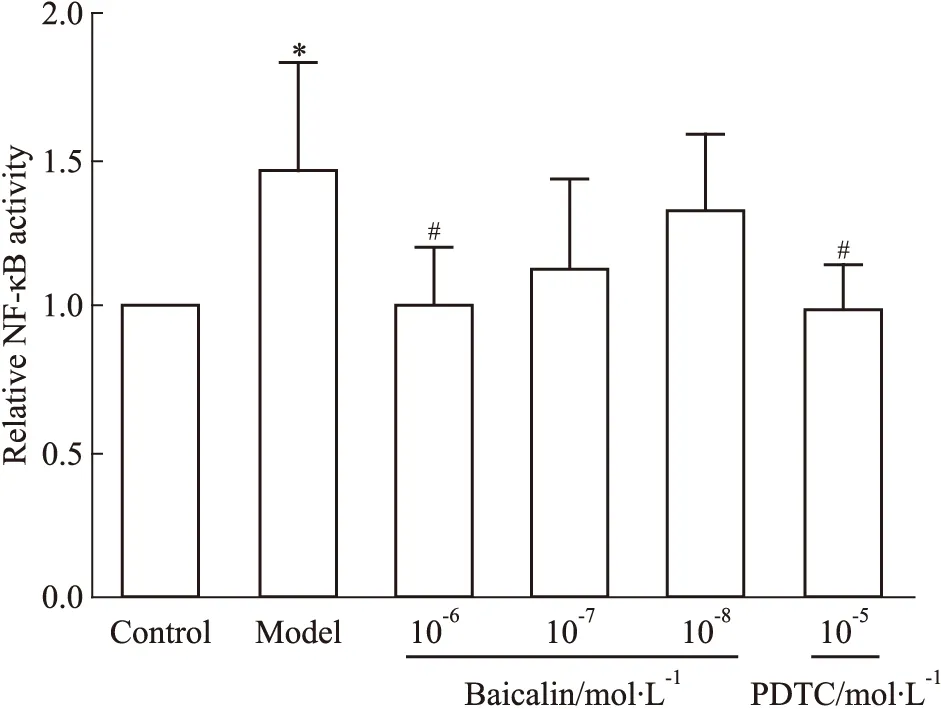
Fig 9 Effect of baicalin on transcriptional activity of NF-κB p65 after HMEC exposure to *P<0.05 vs control;#P<0.05 vs model

Fig 10 Effect of baicalin on expression of p-NF-κB p65,TLR4 and NF-κB p65 after HMEC exposure to *P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs model
4 讨论
LPS是革兰阴性菌细胞壁的正常结构成分,在严重创伤、感染等应激状态下,大量LPS释放入血,从而启动炎症和损伤[9]。当内皮细胞受到LPS刺激时,TLR4被激活,进而通过信号转导系统激活内皮细胞,合成和释放多种细胞因子和炎性介质,从而引起严重的炎症反应[10],这与心血管疾病的发生和发展密切相关,故对血管内皮细胞炎症的抑制成为近年来心脑血管疾病防治的热点。中药黄芩是我国的大宗中药材,主要具有清热燥湿、泻火解毒、凉血止血等功效[11]。黄芩苷是黄芩中的主要活性成分,近年来研究发现其具有广泛的药理特性,如抗炎[5-7,12]、抗肿瘤、抗氧化、抗菌和抗病毒等[4]。为了进一步认识和挖掘黄芩苷的药理活性,本研究着眼于LPS诱导的早期炎症反应启动阶段的干预,采用微血管内皮细胞开展黄芩苷对炎症反应的干预研究。
在本研究中,LPS刺激HMEC后,发生了明显的炎症反应。Ca2+发生明显内流,NF-κB通路活化,NF-κB p65磷酸化,NF-κB p65入核,核转录活性上调,黏附分子ICAM-1及炎症介质IL-6、MCP-1的表达均上调,蛋白NF-κB p65、p-NF-κB p65及TLR4的表达上调。在给予黄芩苷预处理后,Ca2+内流、NF-κB p65入核受到抑制,黏附分子、炎症介质的表达,核内转录活性,TLR4和NF-κB蛋白的表达均下调,此结果表明黄芩苷能抑制LPS诱导的HMEC炎症反应。NF-κB是炎症中关键的转录因子,在静息状态下由P50 /P65 /IKB三聚体组成而处于非活化状态。当内皮细胞受到脂多糖刺激后,LPS首先通过结合TLRs,从而在机体内被先天免疫系统识别,激活TLR4-MyD88信号转导,进而活化NF-κB诱导激酶形成活化的IKKs复合体,使IKB发生磷酸化、泛素化及相关蛋白酶的水解,激活NF-κB信号通路,NF-κB p65转移至细胞核内,从而诱导炎症因子的活化表达,引发炎症反应[13]。Ca2+作为介导细胞内多种生物学反应的第二信使,在维持细胞正常生理功能方面具有重要作用,此外,Ca2+稳态在维持细胞的增殖、分化和调控凋亡中发挥极其重要的作用[14-15]。研究表明,血管内皮细胞外的Ca2+经细胞膜上的钙通道流入细胞内,导致细胞内游离Ca2+超载,从而造成血管内皮细胞损伤。本工作提示黄芩苷对LPS引起的HMEC炎症反应作用的机制涉及到炎症相关信号通路及Ca2+内流的变化。基于黄芩苷通过抑制NF-κB p65磷酸化、NF-κB p65入核及核内转录活性,从而降低后续相关炎症分子及蛋白的表达,这一系列事件具有时间上的逻辑关系,提示黄芩苷是通过抑制NF-κB p65的磷酸化或更早阶段的干预发挥保护作用;而在LPS刺激HMEC后1 h检测到明显的Ca2+内流,Ca2+内流与NF-κB信号通路活化这二者之间是否存在相互影响或调控的关系,仍待进一步深入研究。
综上,本研究表明黄芩苷对LPS诱导的微血管内皮细胞炎症具有保护作用,其机制涉及到Ca2+内流和NF-κB信号通路的活化。进一步深入研究其作用机制,将有助于认识和挖掘黄芩苷的药理活性,为临床应用及相关新药的研究提供参考依据。
(致谢:本实验在贵州省中国科学院天然产物化学重点实验室药理与生物活性研究中心实验室完成,在此感谢课题组全体成员的支持和帮助。)

