新型吡唑并[4,3-d]嘧啶衍生物的合成和抗炎活性
余佩静,胡阳生,陈刘赠,石静波,刘新华
(安徽医科大学1.第一附属医院药剂科、2.国家中医药管理局中药化学三级实验室、3.药学院,安徽 合肥 230032)
炎症是机体对抗伤害或感染时的一种保护性行为。但是,当炎症变为慢性时,则会损害组织、引发多种疾病,例如常见的心血管疾病、自身免疫性疾病和恶性肿瘤等[1]。目前市场上的抗炎药,不论是甾体抗炎药,还是非甾体抗炎药,都有诸多副作用。因此,研发新型抗炎化合物就显得十分迫切。
吡唑并[4,3-d]嘧啶这种母核结构与嘌呤的结构非常相似,是其生物电子等排体[2]。因此,吡唑并[4,3-d]嘧啶类母核具有很高的研究价值,对其进行结构优化,有望设计合成出新型先导化合物。
NLRP3炎症小体的活化与很多疾病有关联,多种小分子化合物可以凭借调控NLRP3炎症小体的活化进而起到治疗疾病的效果[3]。例如,3,4-methylenedioxy-β-nitrostyrene小分子化合物和砷酸等物质能够有效抑制了NLRP3炎症小体活化[4];小鼠败血症、CAPS综合症和实验性脑脊髓炎等疾病可借助小分子化合物MCC950抑制NLRP3炎症小体活化从而起到改善作用[5];格列本脲靶向ATP敏感的钾离子通道选择性抑制NLRP3炎症小体[6]。因此,本课题组基于吡唑并[4,3-d]嘧啶的母核结构改造出的新型小分子化合物,通过计算机分子对接,发现其可能具有抗炎活性。进一步对其进行药理机制的研究发现,该化合物是通过NF-κB/NLRP3炎症小体信号通路来改善体外炎症反应,这可能是治疗炎症相关疾病很有前景的先导化合物。
1 材料
1.1 细胞与试剂RAW264.7细胞株购于北京贝纳科技有限公司;一氧化氮检测试剂盒(批号NO.S0021)购于碧云天生物技术公司;DMEM高糖培养基(批号2019044)购于Hyclone公司;荧光定量PCR试剂盒购于TAKARA公司(批号AJ12457A);噻唑蓝(MTT,批号No EZ5679C133)购于Sigma公司;TRIzol试剂(批号No1382737)购于Invitrogen公司。
1.2 仪器细胞培养超净工作台(安泰空气技术公司);电泳仪、半干转仪(美国伯乐公司);倒置显微镜(日本OLYMPUS公司);CO2细胞培养恒温箱(美国杜邦公司);酶标仪(Bio-Tek,USA);万分之一电子天平(美国赛豪斯公司)。
2 方法
2.1 吡唑并嘧啶衍生物的合成化合物E合成的路线:试剂和条件:(a):1.呋喃丙烯酸,CH2Cl2,(COCl)2和二甲基甲酰胺(催化量),25 ℃,3 h;2.CH2Cl2,三乙胺,25 ℃,2 h (b):乙醇钠,乙醇,回流,12 h;(c):三氯氧磷,回流,12 h;(d):邻氯苄胺,异丙醇,回流。
2.2 分子对接环氧化酶-2(cyclooxygenase-2,COX-2(PDB:3LN1))的晶体结构作为分子对接的受体,并将与之结合的配体周围的氨基酸残基定义为对接的活性位点。通过Discovery Studio 2018中的Prepare Ligands和Full Minimization程序,将化合物转换成正确的三维结构并进行能量最小化。最后进行对接程序,将目标化合物对接进入COX-2的活性位点中。
2.3 细胞培养RAW264.7细胞对刺激很敏感,培养不需要用胰酶消化,传代的时候直接用移液枪吹打,但需注意吹打频率。考虑到该细胞生长速度快,本研究在实验过程中每天传代1次。
2.4 化合物的细胞毒性实验通过MTT实验分析评估化合物的细胞毒性。将细胞接种在96孔板上,次日加梯度浓度的化合物。持续24 h的培养之后,加入噻唑蓝溶液,再培养4 h,弃去上清后将DMSO加入。摇床上摇10 min后在酶标仪上测OD值。
2.5 细胞的形态学变化收集RAW264.7细胞接种在细胞培养皿(6 cm)中,设置正常组、炎症模型组及加梯度浓度化合物的实验组(5、10、20 μmol·L-1)共5个皿,每皿种约150万细胞,加3 mL培养基,放在培养箱过夜,d 2实验组加化合物,弃去旧培养基,加入新的配制好的含浓度梯度化合物的培养基,正常组换上3 mL新鲜培养基即可。将培养皿放回培养箱,1 h后取出,模型组和实验组的细胞培养皿中加脂多糖(lipopolysaccharide,LPS),LPS的工作液浓度为1 mg·L-1。培养24 h后,利用显微镜观察该细胞的形态学变化。
2.6 化合物对NO含量的影响将RAW264.7细胞接种在96孔板上过夜。d 2,在LPS刺激之前1 h,将梯度浓度的化合物添加到孔中。24 h后,使用一氧化氮试剂盒测量培养基中的NO。
2.7 Western blot 检测蛋白表达将细胞接种在培养皿中,d 2与上述相同的方式处理细胞。将细胞在270 μL RIPA中裂解。本实验中的蛋白浓度则通过BCA试剂盒进行测量。采用电泳分离蛋白样品再转到PVDF膜,封闭2 h。一抗中4 ℃下孵育过夜,d 2在对应的二抗中孵育1 h。用TBST洗干净膜后,涂上适量的显影液,即可放进显影仪进行显影,拍照保存。用ImageJ软件和GraphPad Prism7.0软件来分析结果并作图,实验重复3次。
2.8 荧光定量Real-time PCR 实验将细胞接种在6孔板中。然后将LPS添加到经过梯度浓度化合物处理过的细胞中,用TRIzol试剂从每组中提取总RNA。根据逆转录试剂盒相关要求,将RNA反转录为cDNA,再按荧光定量PCR试剂盒要求进行扩增。上下游引物(正向和反向):TNF-α:5′ TGTCCCTTTCACTCACTGGC 3′ 和5′ CATCTTTTGGGGGAGTGCCT 3′;IL-6:5′ GAGGATACCACTCCCAACAGACC 3′和5′ AAGTGCATCATCGTTGTT CATACA 3′;IL-1β:5′ TGGCAATGAGGATGACTTGT 3′和5′GTGGTGGTCGGAGATTCGTA 3′;COX-2:5′ ACCTGGTGAACTACGACTGC 3′和5′ TGGTCGGTTTGATGTTACT 3′;GAPDH:5′ GGACCTCATGGCCTACATGG 3′和5′TAGGGCCTCTCTTGCTCAGT 3′。
2.9 动物实验C57BL/6小鼠30只,生产许可证号为SCXK(皖)2017-001,♂,体质量(20±2)g,随机分为5组,正常组,炎症模型组通过尾静脉注射同体积生理盐水,实验组用不同剂量化合物,还设置一组只用高剂量化合物给药。1 h后,除了正常组和只加高剂量化合物组给等体积生理盐水外,其它各组尾静脉注射LPS(20 mg·kg-1)来造急性肺损伤模型。48 h后处死小鼠,取肺组织,石蜡包埋切片,HE染色,在显微镜下观察。
2.10 统计学分析实验重复至少3次。借助GraphPad Prism7.0处理数据和绘图;并采用单因素方差分析或t检验比较样本均数。
3 结果
3.1 分子对接基于靶标COX-2进行初步分子对接,发现以吡唑并嘧啶结构为基本母核的衍生物具有良好的抗炎活性,吡唑并嘧啶母核与靶标COX-2的氨基酸残基Val335和Ala513形成了π-σ相互作用。进一步分析发现目标化合物上的呋喃环和苯环分别进入结合口袋的两个部分,并和口袋内周围的氨基酸残基产生了相互作用。这种结合模式与塞来昔布中的苯环和三氟甲基相似,具体相互作用如Fig 2所示。这些相互作用或许使得目标化合物与靶标COX-2稳定结合,产生抗炎活性,因此,本文以该化合物进行下一步的抗炎活性研究。

Fig 1 Synthesis route of compounds E
3.2 化合物对细胞活力的影响通过MTT法评估新型化合物的细胞毒性。将细胞与不同浓度的化合物或LPS一起孵育。如Fig 3所示,低于40 μmol·L-1的新型化合物没有明显的细胞毒性。
3.3 细胞的形态学变化RAW264.7细胞正常状态在显微镜下看应该是圆圆的亮晶晶的,没有伪足,当受到LPS的刺激时,细胞会发生炎症反应,细胞明显会发生形态学上的改变,细胞会伸出伪足,变得膨胀,细胞由圆形长出触角,变成梭形或多边形。如Fig 4所示实验组C、D、E跟炎症模型组B相比,细胞的变异程度得到了明显的改善,随着化合物浓度的增加,细胞变异改善的越明显,据此可以推测出该化合物能够缓解LPS引起的RAW264.7细胞的变异程度,而这可能由于炎症反应受到抑制产生的结果。

Fig 2 Docking result of title compound and COX-2
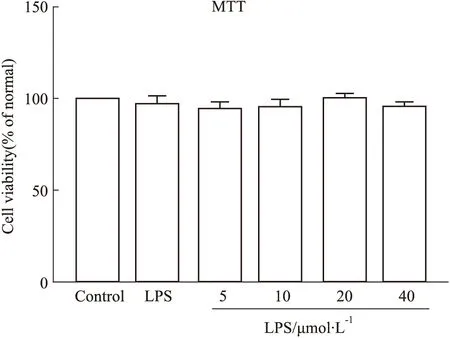
Fig 3 Effect of title compound on cell

Fig 4 Morphological changes of cells(×20)A:The Control group;B:LPS group;C:LPS +title compound (5 μmol·L-1);(D) LPS +title compound (10 μmol·L-1);(E) LPS +title compound (20 μmol·L-1)
3.4 化合物对NO的产生和COX-2表达的影响NO在炎症中起关键调节作用。当受到LPS刺激时,NO明显增加。与LPS炎症模型组相比,实验组浓度依赖性地抑制LPS诱导的NO生成,如Fig 5所示。COX-2介导的前列腺素的产生与多种炎性疾病有关,而COX-2在多种炎性疾病中过度表达。如Fig 6A和B所示,从蛋白质和mRNA的水平来看,当受LPS刺激时,COX-2的表达增加。与LPS炎症模型组相比,实验组(10,20 μmol·L-1)也抑制LPS诱导的COX-2表达。

Fig 5 LPS-induced NO generatio ninhibited ##P<0.01 vs control group,**P<0.01 vs LPS-stimulated cells.

Fig 6 COX-2 protein and mRNA expression inhibited ##P<0.01 vs control group,*P<0.05,**P<0.01 vs LPS-stimulated cells.
3.5 化合物抑制TNF-α、IL-6、IL-1βmRNA的表达TNF-α、IL-6、IL-1β都是炎症反应中的重要促炎因子,抑制促炎因子的产生可以抑制炎症反应的进程。我们通过荧光定量 Real-time PCR 实验,从mRNA的水平来看促炎因子TNF-α、IL-6和IL-1β表达的变化。如Fig 7所示,模型组的促炎因子与正常细胞组相比明显增高,而实验组与炎症模型组相比,TNF-α、IL-6和IL-1β mRNA的水平都明显降低,说明该化合物能够从基因水平抑制促炎因子TNF-α、IL-6和IL-1β的产生,进而抑制炎症反应的进程。
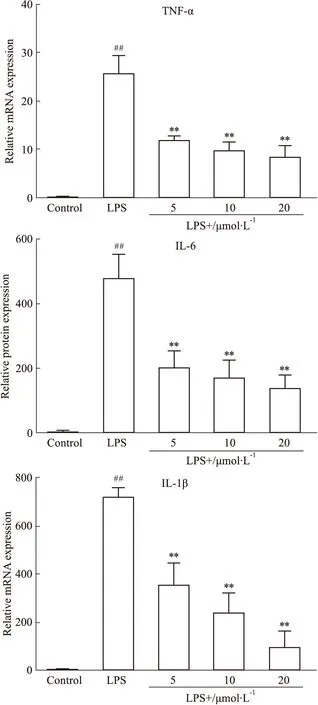
Fig 7 Effect of title compound on gene transcription of TNF-α,IL-6 and IL-1β in RAW264.7 cells by ##P<0.01 vs control group,**P<0.01 vs LPS-stimulated cells.
3.6 化合物抑制NF-κB通路为了探讨新型化合物对NF-κB通路的作用,通过Western blot实验分析了p-p65、p65、IκB、p- IκB的蛋白表达,如Fig 8所示,与正常组相比,炎症模型组中p65的磷酸化明显增加。而实验组与炎症模型组相比,可以看出化合物抑制了IκB蛋白的磷酸化和降解。同时,当实验组中化合物浓度为20 μmol·L-1时,p65的磷酸化也受到了抑制。

Fig 8 LPS-induced NF-κB pathway suppressed #P<0.05,##P<0.01 vs control group,*P<0.05,**P<0.01 vs LPS-stimulated group.
3.7 化合物抑制NLRP3炎症小体的活化炎症小体是一种多蛋白复合物,在炎症类的疾病中发挥着非常关键的作用。由Fig 9可知,炎症模型组与正常细胞组相比,NLRP3、ASC、caspase-1蛋白明显增多,而给了不同浓度化合物的实验组与炎症模型组相比,蛋白表达量下降,说明NLRP3炎症小体的活化受到了抑制,该化合物能够抑制NLRP3炎症小体的活化。

Fig 9 LPS-induced activation of NLRP3 inflammasome ##P<0.01 vs control group,**P<0.01 vs LPS-stimulated group.

Fig 10 LPS-induced acute lung injury relieved by title compound(n=6)
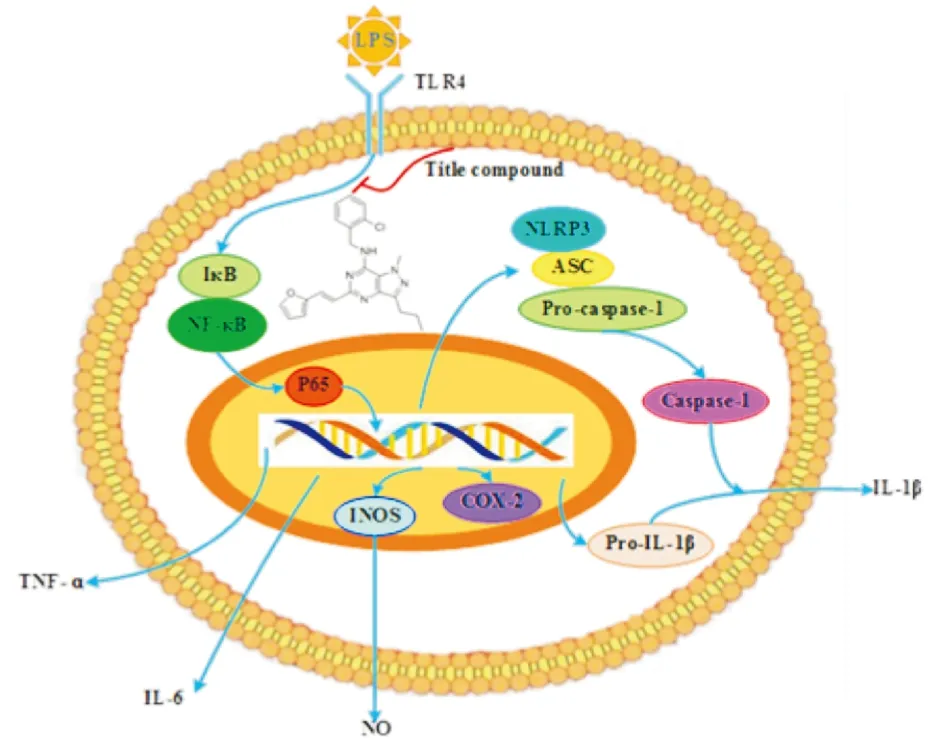
Fig 11 NF-κB/NLRP3 inflammasome pathway inhibited by title compound
3.8 化合物对小鼠急性肺损伤的影响在小鼠体内实验中,实验组与炎症模型组,相比,实验组LPS诱导的炎症细胞浸润,肺组织充血水肿,肺泡结构破坏都有所缓解,且20 mg·kg-1的剂量缓解效果比10 mg·kg-1的更好,初步说明该化合物有缓解小鼠实验中LPS诱导的急性肺损伤的作用。
4 讨论
炎性细胞因子是一类小分子蛋白质,具有广泛的生物学活性和复杂的功能[7]。当受到LPS刺激时,促炎因子TNF-α、IL-6、IL-1β明显增加[8]。在用LPS刺激的RAW264.7细胞中,该新型化合物可以下调TNF-α、IL-6、IL-1β的mRNA的表达量。NO作为一种气体信号分子,在体内通常以硝酸盐和亚硝酸盐的稳定形式存在,可以调节生物体中的很多种生理和病理反应[9]。在病理条件下,如当机体会受到TNF-α、LPS等的刺激,就会激活炎症反应途径并导致NO合成量增加、进一步加剧炎症反应[10]。而该化合物浓度依赖性地抑制了LPS诱导的NO生成。一般而言,在正常组织细胞中,COX-2活性较低,因为它只是一种诱生型酶;当细胞受到外界刺激时,它的表达水平可急剧增加,从而致使PGI2、PEG2和PGE1等含量的升高、产生炎症反应以及组织损伤[11]。通过Western blot实验和荧光定量Real-time PCR实验,表明该化合物抑制了LPS诱导的COX-2的表达。
NF-κB是一类与炎症反应紧密联系的转录因子,一般而言,它在细胞静止状态下,主要在细胞质中以IκB/p65/p50无活性三聚体的形式存在[12]。在LPS作用作用下,IκB蛋白容易出现磷酸化、解离、降解等现象。与此同时,游离的NF-κB将从细胞质转入至细胞核内,再与结合位点相结合、启动靶基因转录,产生相应的mRNA及蛋白质[13]。本实验结果显示,在LPS刺激的RAW264.7细胞中,该化合物显著抑制p65和IκB的磷酸化,同时抑制IκB的降解。因此,该化合物可能能够抑制NF-κB信号通路的活化。一般情况下,在双重信号协同作用下,NLRP3炎症小体将经历激活、转录、活化和释放等过程。本实验结果表明,该化合物能够抑制LPS刺激的RAW264.7细胞中NLRP3、ASC和caspase-1蛋白的表达,与此同时降低IL-1β mRNA的表达。在体内实验中,该化合物对LPS引起的小鼠急性肺损伤也具有缓解作用。这些结果提示该化合物可能通过NF-κB/ NLRP3炎症小体信号通路来发挥抗炎活性。其可能的作用机制如Fig 11所示。本论文的结果对高效抗炎小分子化合物的设计与优化具有参考意义。

