线粒体溶质载体蛋白SLC25A26诱导肝癌细胞衰老作用及分子机制
邵江娟,金 春,彭 珣,苏 莹,张 峰,郑仕中
(南京中医药大学药学院,江苏 南京 210023)
肝细胞癌(hepatocellular carcinoma,HCC)是目前严重危害人类健康的疾病之一,其发病率是世界前六名,死亡率是恶性肿瘤的前三名。由于HCC早期诊断率低,多数患者发现时已经是中晚期,目前并无有效方法治愈。因此寻找有效的治疗方式,阻断肝肿瘤细胞的恶性增殖,已成为迫切之需。为了遏制肿瘤细胞的增殖,有研究提出可以用某些手段将细胞周期永久性阻滞,即诱导肿瘤细胞衰老[5],并且衰老的肿瘤细胞可以被免疫系统识别从而被清除[5]。近年来,诱导肿瘤细胞衰老已成为治疗癌症的一种新思路和策略[5]。
研究表明,某些代谢活动可以调控细胞衰老。Li等[6]证实Sirt6可以通过影响细胞糖代谢调控细胞衰老;Yang等[7]发现线粒体谷氨酰胺代谢能够调控人胰腺导管腺癌(PDAC)细胞衰老。Maddocks等[8]研究证实蛋氨酸循环代谢为各种反应提供甲基单位,在HCC的增殖过程中发挥着重要作用。HCC具有蛋氨酸依赖,当这种依赖被阻断时,肝癌细胞不能增殖并且细胞周期停滞[9]。这些结果提示我们,可能通过调控蛋氨酸循环代谢来诱导肝癌细胞衰老。
为了研究蛋氨酸循环和细胞衰老之间的潜在机制,我们查阅资料发现,由线粒体溶质载体蛋白SLC25A26基因编码的线粒体S-腺苷蛋氨酸载体(SAMC)可以将S-腺苷蛋氨酸(SAM)摄取到线粒体,维持线粒体的甲基化反应,从而参与调控细胞生理活动[10]。同时,Menga等[12]研究发现,SLC25A26的下调可能促进肿瘤细胞的存活和增殖。综上所述,我们推测SLC25A26可能通过调控蛋氨酸循环代谢诱导肝癌细胞衰老。本研究重点探究SLC25A26、蛋氨酸循环代谢、细胞衰老以及HCC之间的关系,其研究结果为HCC的治疗提供新靶点和新思路,对发现HCC的新治疗手段具有重要的意义。
1 材料与方法
1.1 材料
1.1.1细胞株 人肝癌HepG2细胞株,购自南京科佰生物科技有限公司。
1.1.2主要试剂 胎牛血清FBS(BC-SE-FBS02)购自南京森贝伽生物科技有限公司;培养基DMEM(GibcoTM,11960044)购自上海佰晔生物科技中心;胰蛋白酶(T1300)、牛血清白蛋白BSA(A8020)、核糖核酸酶A(R4875)、碘化丙啶PI(P8080)、核染料DAPI(C0060)购自北京索莱宝科技有限公司;细胞裂解液RIPA(AP01L014)购自上海李记生物科技有限公司;PureLinkTMRNA提取试剂盒(12183018A)、DyNAmo HS SYBR Green qPCR 试剂盒(F410L)、Lipofectamine 2000转染试剂(11668027)购自赛默飞世尔科技(中国)有限公司;一抗p16(80772T)、p21(2947T)、HMGA1(7777T)、CDK4(12790T)、CDK6(13331T)、CyclinD1(55506T)、CyclinE1(20808S)、β-actin(4970T)以及二抗anti-rabbit IgG(7074P2)购自Cell Signaling Technology公司;ECL化学发光液(1122102)、PVDF膜(K1PA9019BK)购自Millipore公司;蛋白Marker(B2787)、苯甲基磺酰氟PMSF(10837091001)、TRIzol(93289)、TritonTMX-100(T8787)、氯仿CHCl3(C2432)、二甲基亚砜DMSO(D2650)、磺基水杨酸(S3147)、庚烷磺酸钠(H2766)、甘油醛-3-磷酸脱氢酶GAPDH(G5262)购自Sigma-Aidrich公司。
1.1.3仪器 超净工作台(苏州鸿基洁净科技股份有限公司);HERAcell 150i CO2细胞培养箱(美国Thermo Scientific公司);DM2000莱卡倒置显微镜(德国Leica公司);电泳仪、凝胶成像仪、实时荧光定量PCR仪(美国Bio-Rad公司);BioTek Synergy 2多功能酶标仪(美国Biotek公司);流式细胞仪、冷冻离心机(美国Beckman公司);BKQ-B50II全自动高压灭菌锅(山东博科科学仪器有限公司);微量移液器(芬兰BioHit公司);UPT®-Ⅰ-5/10/20TN超纯水机(四川优普超纯科技有限公司);BSA224S-CW电子天平(德国Sartorius公司);DW-86L728型-80 ℃超低温冰箱(青岛海尔股份有限公司);AF200AS制冰机(SCORTSMAN制冰机系统(上海)有限公司)
1.2 方法
1.2.1细胞的培养 人肝癌HepG2细胞在无菌培养皿/瓶中接种,加入适量1 ∶9的胎牛血清和DMEM培养液,用含5% CO2的37 ℃恒温、饱和湿度的培养箱培养。
1.2.2质粒构建与细胞转染 SLC25A26 plasmid与control plasmid购自汉恒生物科技(上海)有限公司。将适量HepG2细胞均匀接种于24孔板中,待其生长至50%左右时,加入构建的质粒,使用Lipofectamine 2000转染试剂促进质粒转染,具体操作方法参见转染试剂操作说明书,通过Western blot验证转染效率。
1.2.3Western blot实验 按照PMSF ∶磷酸酶抑制剂 ∶RIPA=1 ∶1 ∶100的比例提取总蛋白,每孔200 μL。用超微量分光光度计测蛋白浓度,根据浓度计算上样量。配制10%分离胶和4%浓缩胶,插入梳子形成上样槽,倒入电泳缓冲液,上样,每孔30 μg,进行电泳,电压100 V,75 min。转膜,电流350 mA,75 min。将膜置于牛奶中封闭2 h,并在摇床上慢速晃动。一抗封装,4 ℃冰箱孵育过夜。二抗孵育2 h,结束后用TBST洗3次。使用超敏ECL化学发光试剂曝光,ImageJ软件分析条带灰度值。
1.2.4Real-time PCR实验 使用PureLink RNA提取试剂盒提取细胞中总RNA,然后使用智能核酸蛋白检测仪测定样本RNA浓度。参照逆转录试剂盒说明书,进行逆转录反应,获得模板cDNA。使用DyNAmo HS SYBR Green qPCR 试剂盒对目标基因进行扩增,使用实时荧光定量PCR仪检测荧光信号,最终以GAPDH作为内参,采用2-ΔΔCt方法计算目标基因的mRNA相对表达水平,引物序列见Tab 1。

Tab 1 Primer sequences used for Real-time qPCR
1.2.5细胞周期检测 收集细胞(浓度约为1×109/L),取1 mL单细胞悬液,弃去上清,加70%乙醇(预冷)500 μL(固定2 h过夜),离心(1 000 r·min-1,3 min)。加入500 μL染色工作液(Rnase A ∶PI=1 ∶9,即配即用),染色30-60 min(避光)。用流式细胞仪检测并记录。
1.2.6免疫荧光检测 在24孔板中放入载玻片(75%乙醇提前浸泡30 min),然后每板500 μL 4%多聚甲醛孵育培养生长对数期细胞,当生长至50%-60%时,给药24 h,吸去含药培养液,重新加入培养液,继续培养24 h。先用预冷的PBS洗细胞3次,然后每板500 μL 4%多聚甲醛孵育30 min。每片用500 μL 0.1%的TritonTMX-100通透10 min,然后用200 μL含1% BSA的PBS在室温条件下封片1 h。用含1% BSA的PBS按1 ∶100的比例配置一抗(兔抗人),每片200 μL,于4 ℃孵育过夜。用含1% BSA的PBS按1 ∶200的比例配置二抗(兔抗人),每片100 μL,37 ℃孵育2 h(避光)。每片100 μL DAPI染色,洗涤。取出放在滴有一滴抗荧光淬灭封片液的载玻片上(有细胞一面和封片液接触),显微镜下观察并拍照。
1.2.7HPLC检测蛋氨酸代谢物水平 待测样品与4%磺基水杨酸1 ∶1混合,12 000 r·min-1离心15 min,取上清过0.22 μm滤膜,装入进样瓶。超高效液相色谱仪(美国Thermo公司)仪器型号为:UltiMate 3000。色谱柱:ACQUITY UPLC HSS T3(100 mm×2.1 mm×1.8 μm);流动相:A(含10 mmol·L-1庚烷磺酸钠的50 mmol·L-1NaH2PO4,pH 4.38) ∶B(甲醇)=80 ∶20;柱温30 ℃;波长260 nm;进样量2 μL;运行时间10 min。
2 结果
2.1 蛋氨酸循环代谢与肝癌细胞衰老的关系使用阳性药Etoposide(2 μmol·L-1)诱导HepG2细胞衰老,并加入蛋氨酸循环代谢补充物SAM(0.1 mmol·L-1)促进蛋氨酸循环,作用24 h。首先考察细胞衰老指标p16、p21、HMGA1的表达,Western blot检测结果表明,蛋氨酸循环代谢的增强降低了Etoposide诱导的HepG2细胞衰老水平(Fig 1A);Real-time PCR检测进一步验证了这个结果(Fig 1B)。细胞周期也是评价细胞衰老的指标之一[13],因此我们用流式细胞仪检测促进蛋氨酸循环对HepG2细胞周期的影响(Fig 1C),发现蛋氨酸循环代谢的增强使G1期在细胞周期中的比重降低,说明促进蛋氨酸循环代谢可以抑制肝癌细胞衰老。综上,蛋氨酸循环代谢可以调控肝癌细胞衰老。
2.2 SLC25A26能够介导肝癌细胞衰老首先通过Western blot检测过表达SLC25A26的转染效率(Fig 2A),然后检测过表达SLC25A26对HepG2细胞衰老指标(p16、p21、HMGA1)的影响(Fig 2B),结果表明SLC25A26可以诱导HepG2细胞衰老;进一步采用免疫荧光法检测过表达SLC25A26对HepG2细胞衰老指标的影响(Fig 2C),同样证实了这一结论。综上,SLC25A26能够诱导肝癌细胞衰老。
2.3 SLC25A26调控蛋氨酸循环代谢进而诱导肝癌细胞衰老采用高效液相色谱法(HPLC)构建了蛋氨酸循环代谢物 SAM、SAH(S-腺苷-L-高半胱氨酸)的检测方法,Fig 3A为 SAM、SAH 标准品以及样品的检测图谱。结果表明,过表达SLC25A26降低了胞质中蛋氨酸循环代谢物SAM、SAH 水平 (Fig 3B);由于蛋氨酸循环代谢过程需要ATP的参与才能生成 SAM,我们采用试剂盒检测了细胞ATP含量,结果表明过表达SLC25A26使得细胞内ATP含量下降(Fig 3C);这些结果均提示过表达SLC25A26抑制了HepG2细胞中蛋氨酸循环代谢的活性。最后,我们考察了SAM对SLC25A26诱导的HepG2细胞衰老的影响,通过Real-time PCR检测细胞衰老指标(p16、p21、HMGA1);结果提示,补充外源性SAM部分抵消了过表达SLC25A26诱导的HepG2细胞衰老作用(Fig 3D)。综上,SLC25A26能够通过调控蛋氨酸循环代谢诱导肝癌细胞衰老。
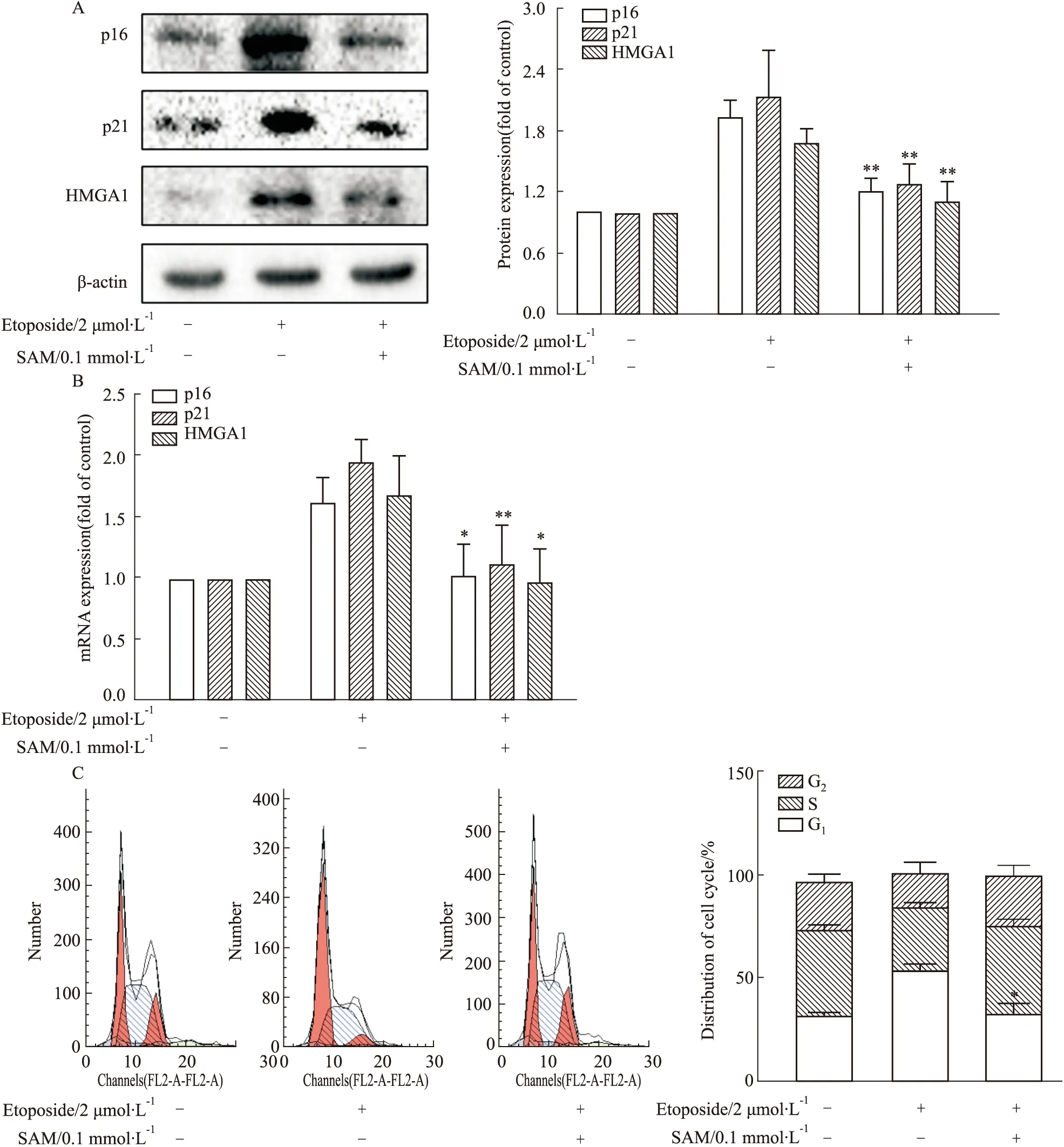
Fig 1 Regulation of methionine cycle on HCC cell senescence (,n=3)A:Effect of SAM on protein expression of senescence indicators (p16,p21,HMGA1) by Western blot;B:Effect of SAM on mRNA levels of senescence indicators (p16,p21,HMGA1) by Real-time PCR;C:Effect of SAM on cell cycle by flow cytometry.*P<0.05,**P<0.01 vs Etoposide.
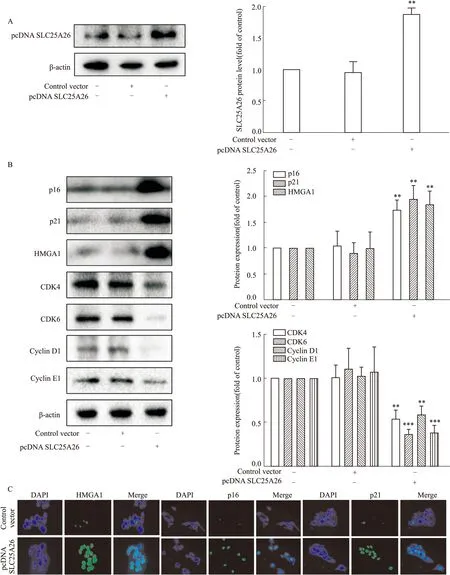
Fig 2 Effect of SLC25A26 on HCC cell senescence (,n=3)A:Transfection efficiency of SLC25A26 overexpression plasmid by Western blot;B:Effect of SLC25A26 overexpression on protein expression of senescence indicators (p16,p21,HMGA1) and cyclin (CDK4,CDK6,CyclinD1,CyclinE1) by Western blot;C:Effect of SLC25A26 overexpression on senescence indicators (p16,p21,HMGA1) by immunofluorescence.*P<0.05,**P<0.01 vs control vector.
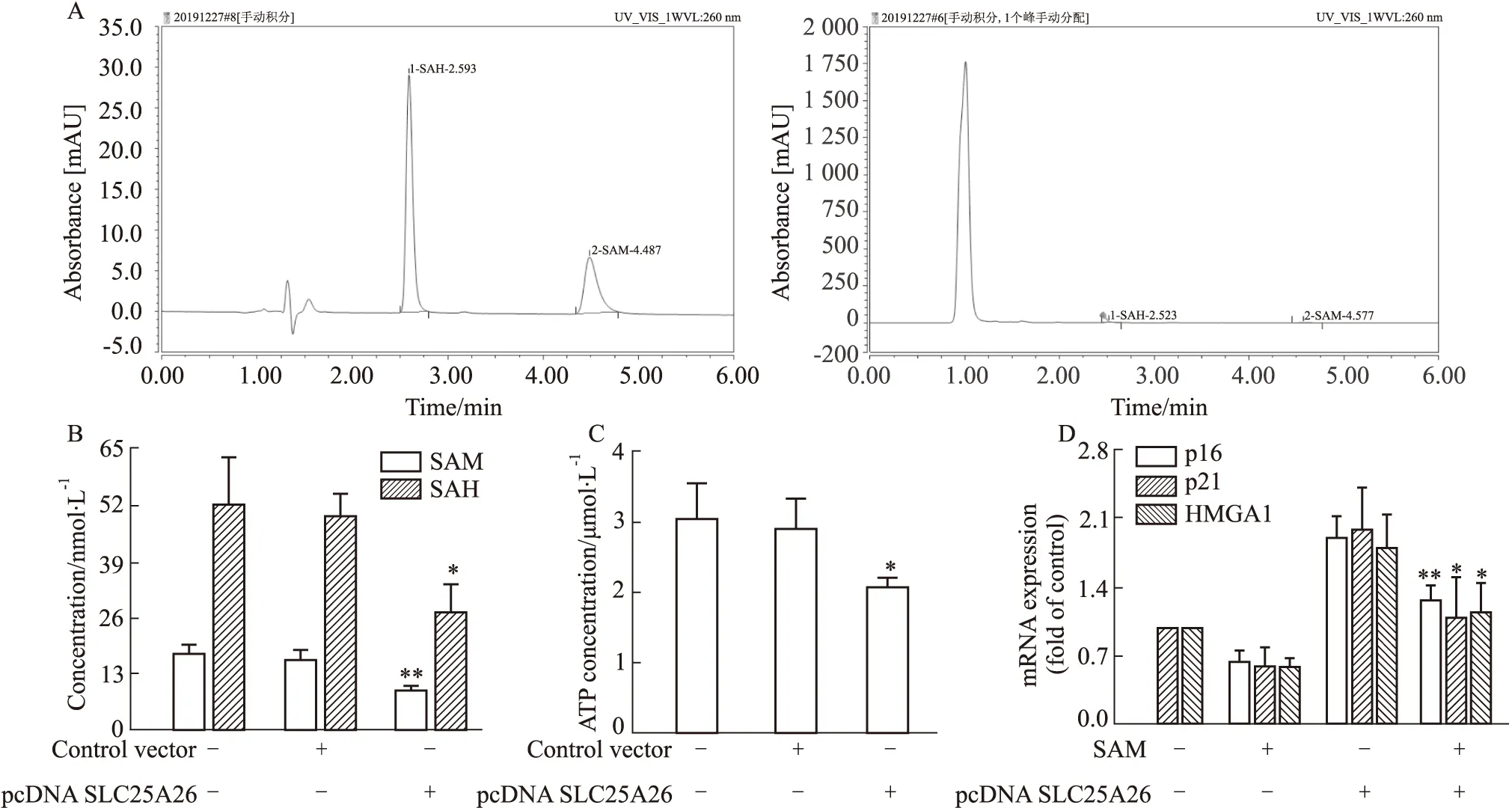
Fig 3 Effect of SLC25A26 on HCC cell senescence by regulating methionine cycle metabolism (,n=3)A:Detection on SAM and SAH concentration of standards and samples by HPLC;B:Effect of SLC25A26 overexpression on SAM and SAH levels by HPLC.*P<0.05,**P<0.01 vs control vector;C:Effect of SLC25A26 overexpression on mitochondrial ATP level by kit.*P<0.05 vs control vector;D:mRNA levels of cell senescence indexes (p16,HMGA1,p21) by real-time PCR.*P<0.05,**P<0.01 vs pcDNA SLC25A26.
3 讨论
HCC是最常见的原发性肝癌,预后差,目前尚无有效的治愈方案[14]。细胞衰老是一种细胞周期停滞的永久状态,是抑制肿瘤细胞增殖的方法之一[15]。很多研究表明,癌细胞内的某些代谢可以影响细胞衰老水平,如Yang等[7]研究发现,线粒体谷氨酰胺代谢调节人胰腺导管腺癌(PDAC)细胞的衰老。曾红静等[16]在探究蛋氨酸依赖和蛋氨酸代谢关系时,表明蛋氨酸依赖仅在肿瘤细胞中可见,蛋氨酸循环代谢在肿瘤细胞中也异常活跃。
首先,为了明确蛋氨酸循环代谢是否能够影响细胞衰老水平,我们用阳性药Etoposide诱导肝癌细胞衰老、加入SAM促进蛋氨酸循环代谢,用Western blot和Real-time PCR检测了肝癌细胞衰老指标(p16、p21、HMGA1),并用流式检测肝癌细胞周期变化,证实了促进蛋氨酸循环代谢可以削弱Etoposide诱导的肝癌细胞衰老,反向说明削弱蛋氨酸循环代谢可以诱导肝癌细胞衰老。
Cianciulli等[10]研究发现,线粒体溶质载体蛋白SLC25A26基因编码的SAMC可以将蛋氨酸循环产生的SAM转运至线粒体内,表明SLC25A26与蛋氨酸循环代谢密切相关。Menga等[12]的研究表明,SLC25A26的下调可以促进肿瘤细胞的存活和增殖,联系上文蛋氨酸循环代谢可以调控肝癌细胞衰老,我们推测SLC25A26可能介导肝癌细胞衰老。为了验证这一推论,在肝癌细胞中过表达SLC25A26,利用Western blot和免疫荧光法检测肝癌细胞衰老水平,结果表明过表达SLC25A26可以促进肝癌细胞衰老。
最后,为了证实SLC25A26可能通过蛋氨酸循环代谢调控肝癌细胞衰老,我们先用HPLC法检测过表达SLC25A26对胞质SAM、SAH水平的影响,结果发现过表达SLC25A26削弱了蛋氨酸循环代谢。接着又用Real-time PCR检测细胞衰老指标(p16、p21、HMGA1),结果证实了SLC25A26可以通过调控蛋氨酸循环代谢来诱导肝癌细胞衰老。
蛋氨酸循环代谢近年来引起学术界的高度重视,本文从蛋氨酸循环代谢与肝癌细胞衰老的角度出发,探究了SLC25A26通过调控蛋氨酸循环代谢诱导肝癌细胞衰老这一课题,为HCC的研究提供新靶点和新思路,对发现HCC的新治疗手段具有重要的意义。

