全国细菌耐药监测网2014—2019年胸腔积液标本细菌耐药监测报告
全国细菌耐药监测网
类肺炎性胸腔积液是目前临床上引起胸腔积液的常见病因之一,主要由细菌性肺炎累及胸膜所致,通过有效的抗菌药物治疗,大多数类肺炎性胸腔积液可自行吸收。为了解我国2014—2019年胸腔积液标本来源细菌的分布及耐药特点,本研究对全国细菌耐药监测网(China Antimicrobial Resistance Surveillance System,CARSS)成员单位胸腔积液标本中分离菌株的药敏结果进行回顾性分析。
1 资料与方法
1.1 细菌来源 收集CARSS成员单位胸腔积液标本分离的菌株,每例患者每种细菌只留取第一株菌(剔除重复菌株)。
1.2 方法
1.2.1 药敏试验 CARSS成员单位采用全自动微生物分析仪按统一方案对胸腔积液标本中分离的菌株进行常规抗菌药物敏感性试验,采用K-B纸片法、E-test法作为补充,整个操作过程严格按照《全国临床检验操作规程》进行,药敏试验结果参照当年或上一年度美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)标准进行结果判读。药敏结果分为敏感(S)、中介(I)、耐药(R),中介结果未在结果中展示。
1.2.2 质量控制 全自动微生物分析仪和药敏纸片扩散法均按照CLSI要求进行质量控制。质控菌株:大肠埃希菌ATCC 25922、金黄色葡萄球菌ATCC 29213、铜绿假单胞菌ATCC 27853、产酶大肠埃希菌ATCC 35218、肺炎克雷伯菌ATCC 700603。
1.3 数据分析 数据来源于全国细菌耐药监测网,经WHONET 5.6软件进行汇总、处理和分析。
2 结果
2.1 菌种构成 2014年1月—2019年12月纳入分析的CARSS成员单位从胸腔积液标本中共分离出细菌75 375株,革兰阳性(G+)菌和革兰阴性(G-)菌所占比例相当。其中G+菌以金黄色葡萄球菌为主,G-菌以大肠埃希菌位居首位。见表1。
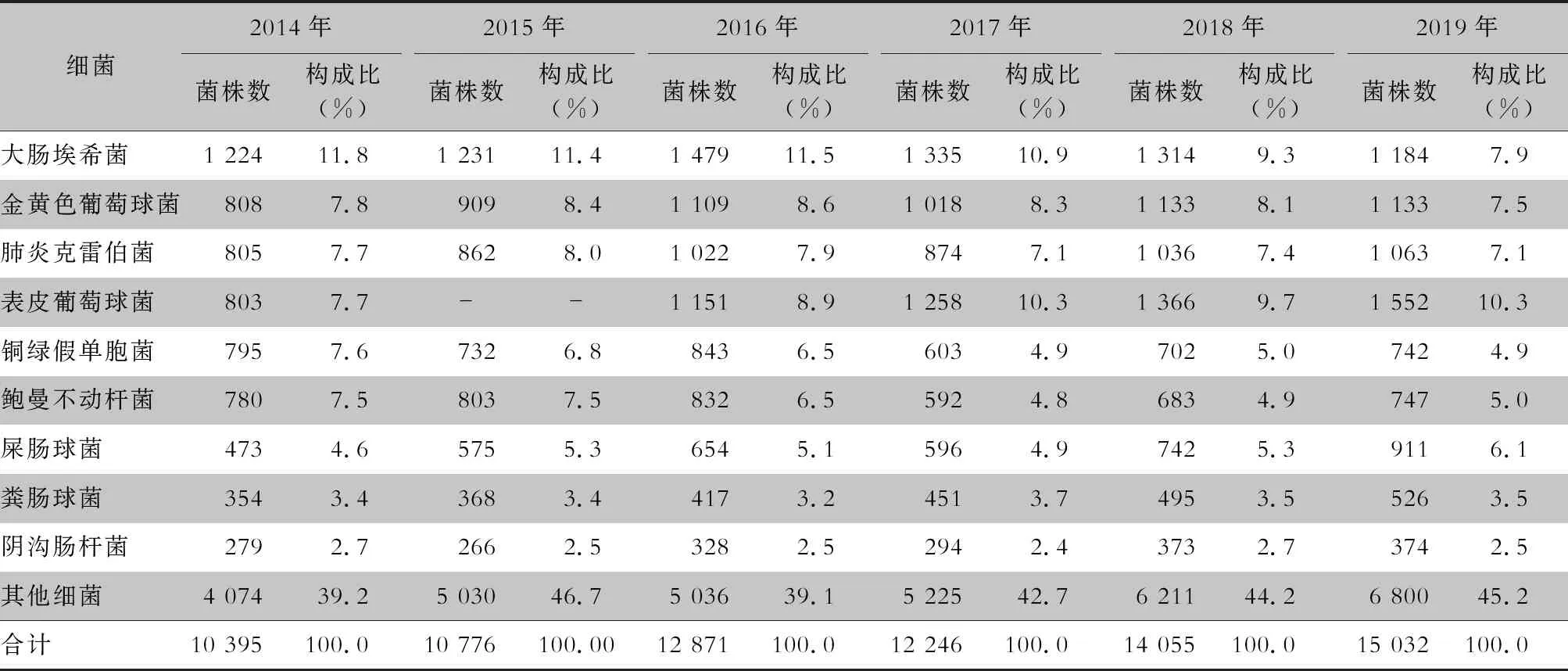
表1 2014—2019年CARSS胸腔积液标本分离细菌的菌种分布
2.2 分离菌对常见抗菌药物的耐药情况
2.2.1 葡萄球菌属 耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)6年间的检出率分别为43.4%(351/808)、41.8%(380/909)、42.3%(441/1 042)、35.8%(351/981)、33.7%(377/1 119)、35.4%(395/1 115),耐甲氧西林凝固酶阴性葡萄球菌(methicillin-resistant coagulase negativeStaphylococcus,MRCNS)6年间的检出率分别为75.3%(1 541/2 046)、71.4%(1 577/2 208)、74.5%(1 966/2 640)、74.0%(2 087/2 819)、74.5%(2 479/3 327)、74.2%(2 769/3 733)。未发现对万古霉素、替考拉宁和利奈唑胺耐药的金黄色葡萄球菌。葡萄球菌属对抗菌药物的敏感率和耐药率见表2~7。
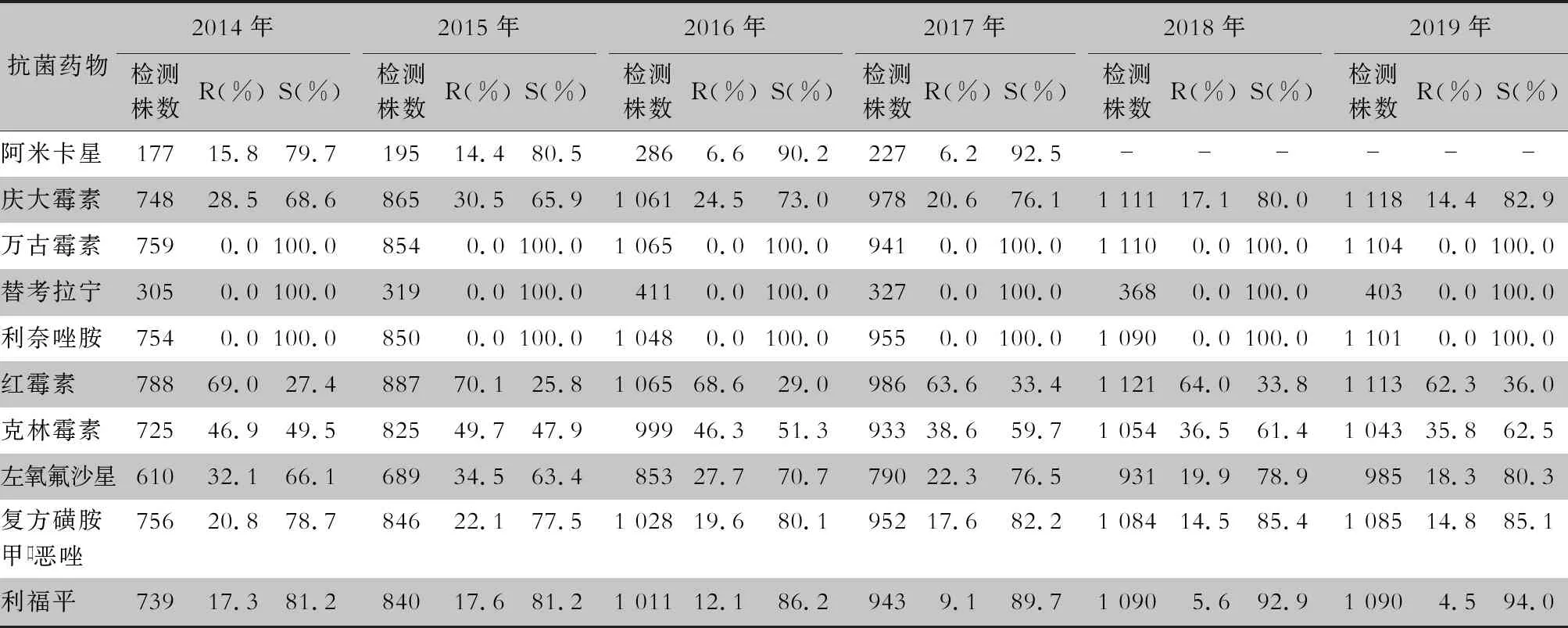
表2 2014—2019年CARSS胸腔积液分离的金黄色葡萄球菌对抗菌药物的药敏情况

表3 2014—2019年CARSS胸腔积液分离的MRSA对抗菌药物的耐药率与敏感率(%)
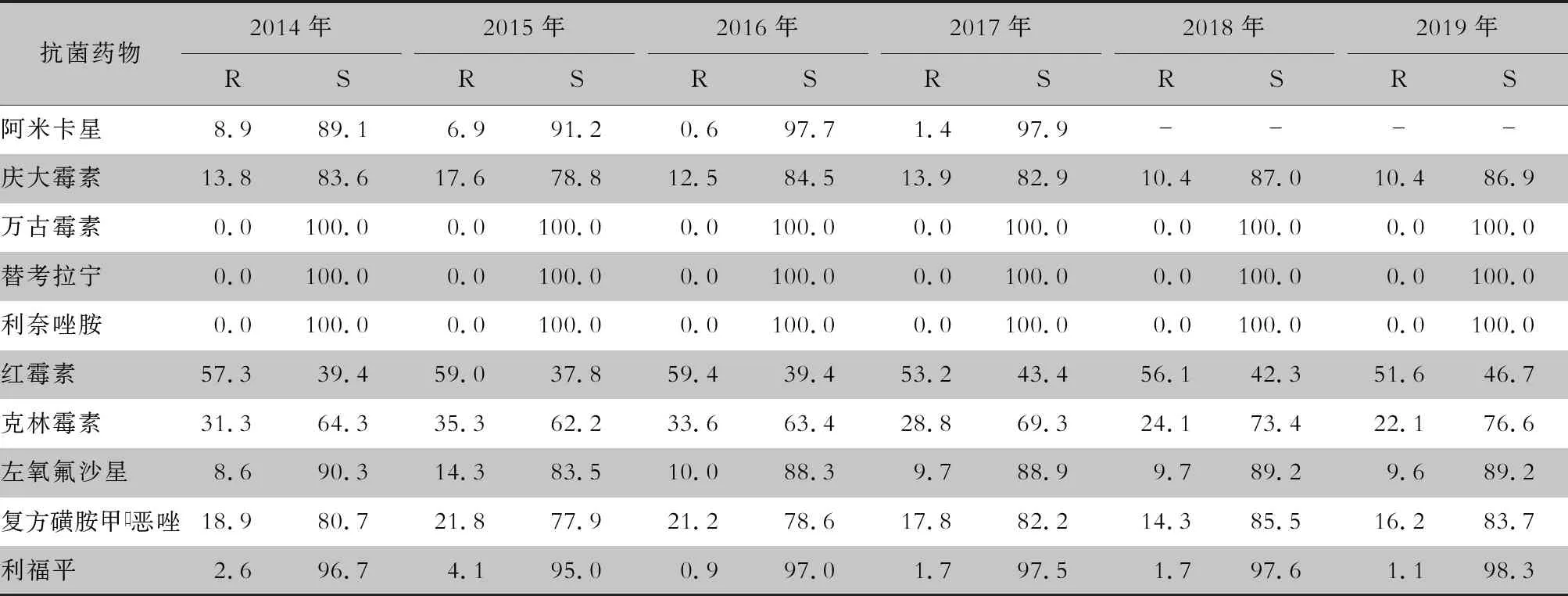
表4 2014—2019年CARSS胸腔积液分离的MSSA对抗菌药物的耐药率与敏感率(%)
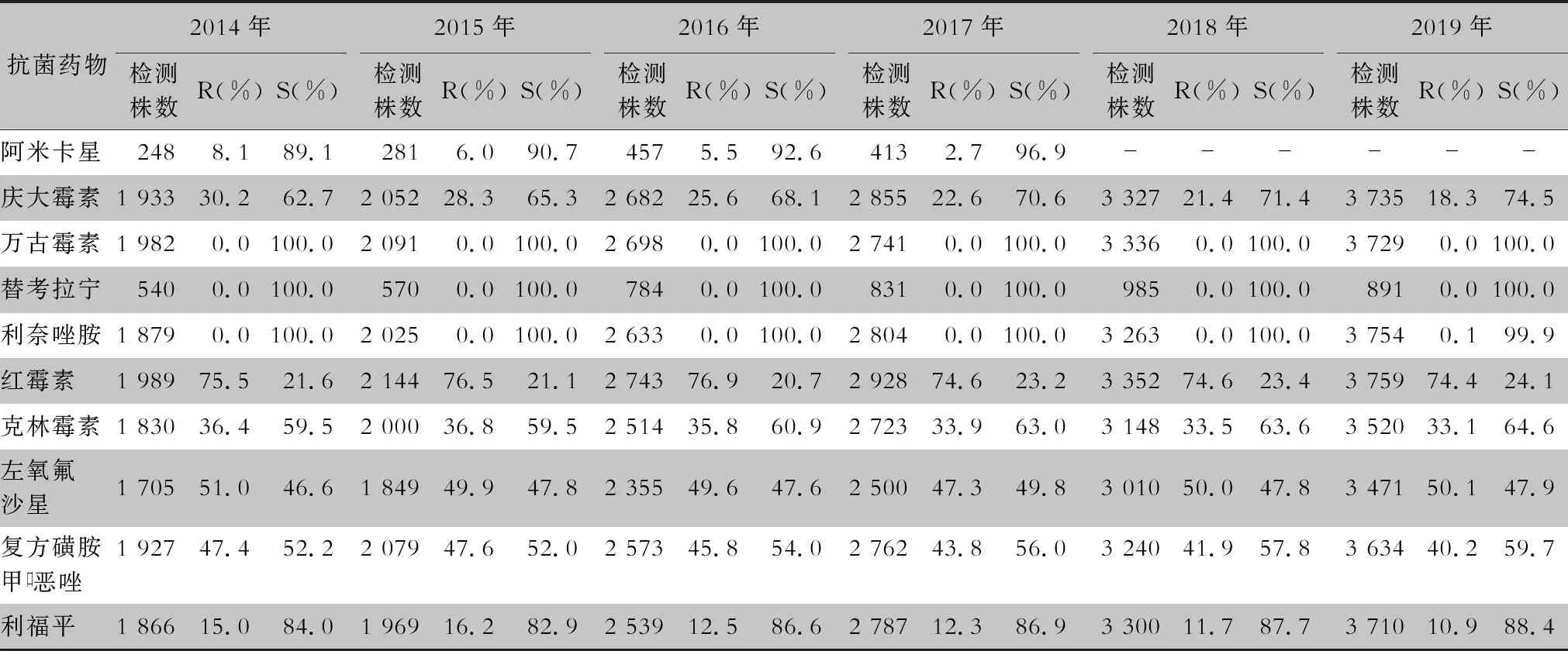
表5 2014—2019年CARSS胸腔积液分离的凝固酶阴性葡萄球菌对抗菌药物的药敏情况
表6 2014—2019年CARSS胸腔积液分离的MRCNS对抗菌药物的耐药率与敏感率(%)

表7 2014—2019年CARSS胸腔积液分离的MSCNS对抗菌药物的耐药率与敏感率(%)
2.2.2 肠球菌属 粪肠球菌对氨苄西林、万古霉素、替考拉宁的耐药率呈下降趋势。对氨苄西林耐药率从2014年的13.4%下降至2019年的6.9%;对万古霉素耐药率2014年为2.3%,2019年未检测出耐万古霉素的菌株;对替考拉宁耐药率从2014年的1.7%下降至2019年的0.5%;屎肠球菌对抗菌药物的耐药率则变化不大。利奈唑胺对屎肠球菌的体外抗菌活性优于粪肠球菌。肠球菌属对抗菌药物的药敏情况见表8、9。

表8 2014—2019年CARSS胸腔积液分离的粪肠球菌对抗菌药物的药敏情况
表9 2014—2019年CARSS胸腔积液分离的屎肠球菌对抗菌药物的药敏情况
2.2.3 链球菌属 6年间肺炎链球菌对青霉素的耐药率为1.1%~7.6%;对第三代头孢菌素的耐药率为5.1%~18.2%;对红霉素的耐药率为87.1%~94.1%;对左氧氟沙星的耐药率2015年最高,达8.7%;未发现对万古霉素及利奈唑胺耐药的肺炎链球菌。见表10。
表10 2014—2019年CARSS胸腔积液分离的肺炎链球菌对抗菌药物的药敏情况

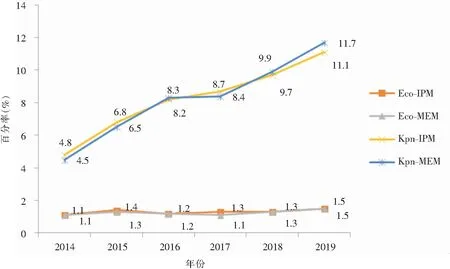
注:Eco-IPM为耐亚胺培南的大肠埃希菌;Eco-MEM为耐美罗培南的大肠埃希菌;Kpn-IPM为耐亚胺培南的肺炎克雷伯菌;Kpn-MEM为耐美罗培南的肺炎克雷伯菌。
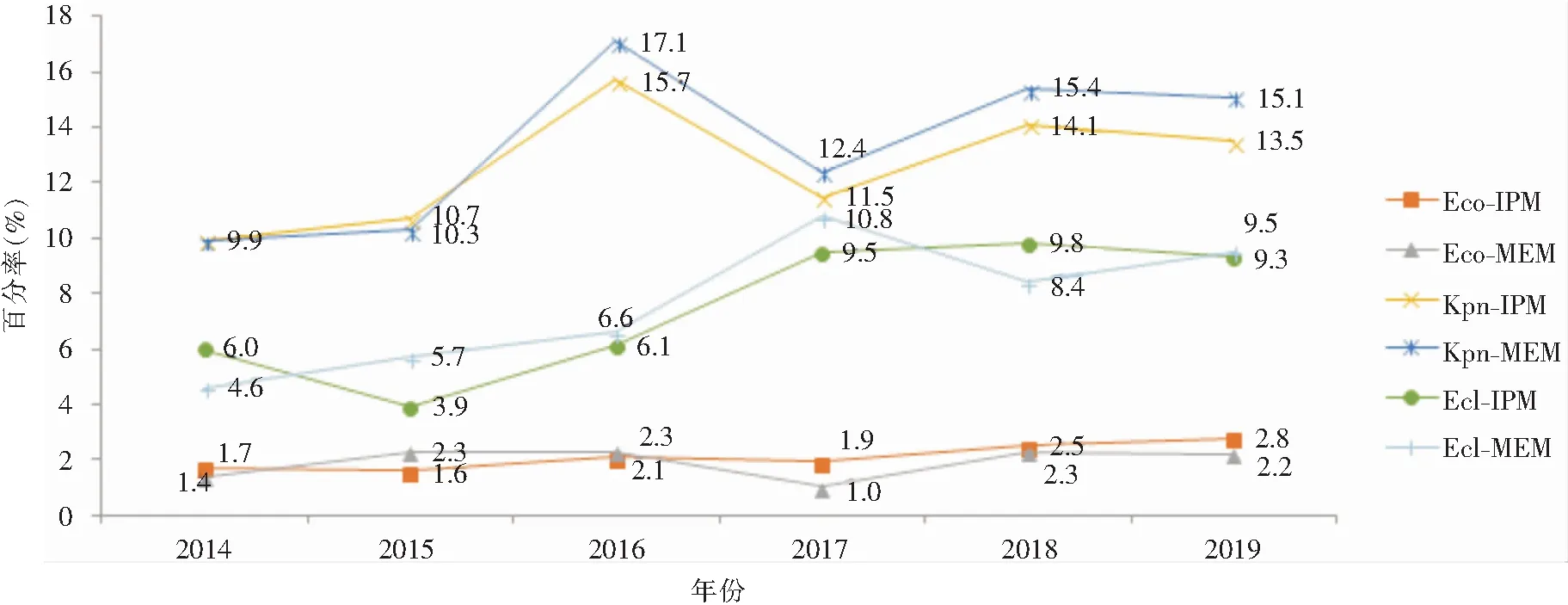
注:Ecl-IPM为耐亚胺培南的阴沟肠杆菌;Ecl-MEM为耐美罗培南的阴沟肠杆菌。

表11 2014—2019年CARSS胸腔积液分离的大肠埃希菌对抗菌药物的药敏情况

表12 2014—2019年CARSS胸腔积液分离的肺炎克雷伯菌对抗菌药物的药敏情况

表13 2014—2019年CARSS胸腔积液分离的阴沟肠杆菌对抗菌药物的药敏情况


表14 2014—2019年CARSS胸腔积液分离的铜绿假单胞菌对抗菌药物的药敏情况
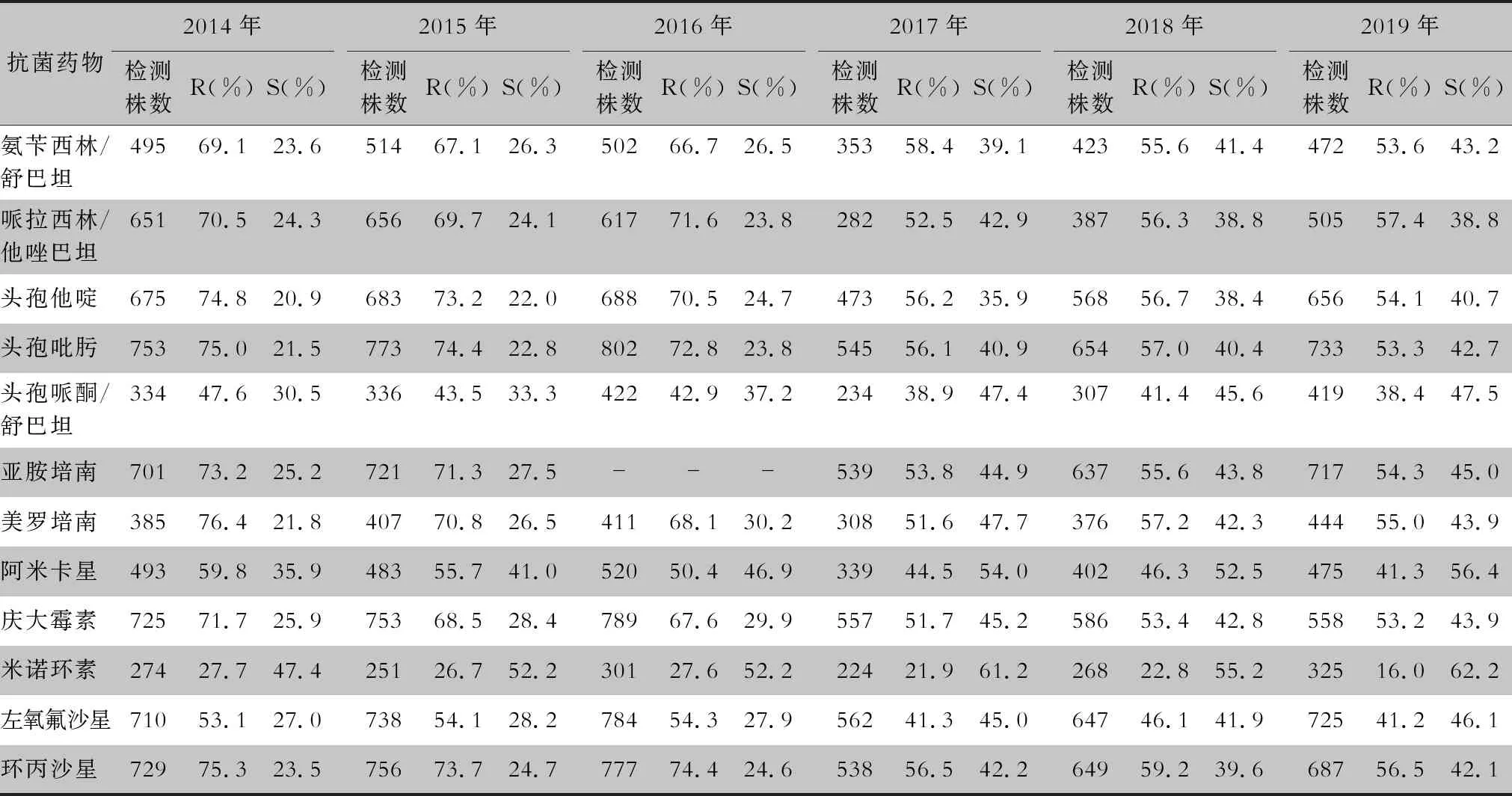
表15 2014—2019年CARSS胸腔积液分离的鲍曼不动杆菌对抗菌药物的药敏情况
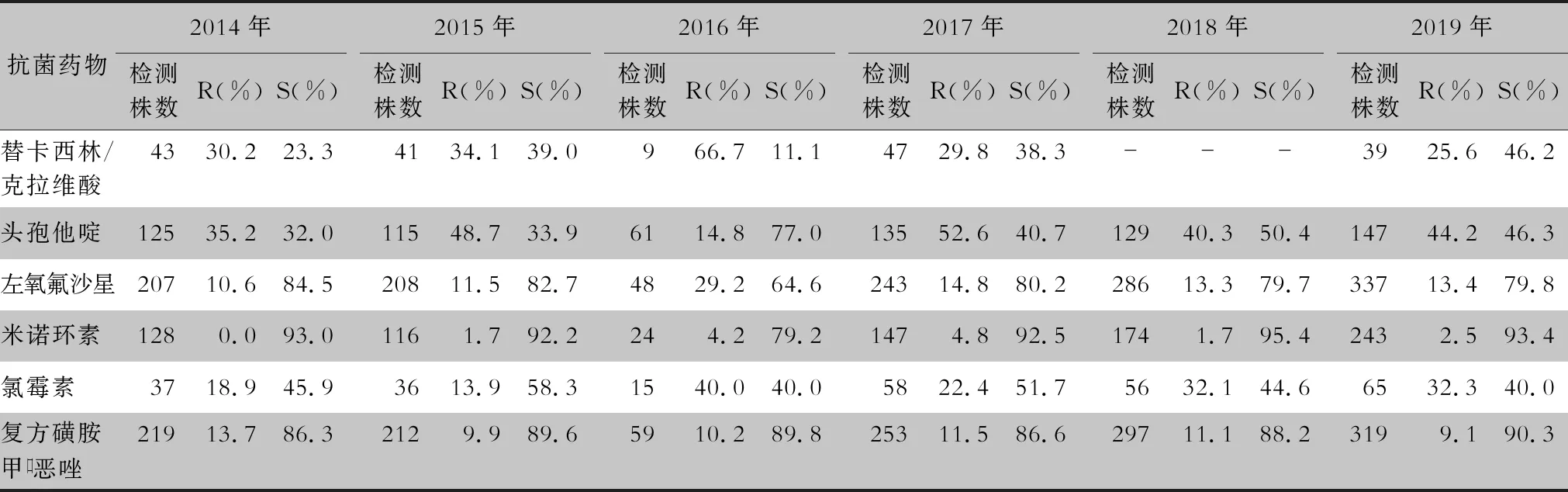
表16 2014—2019年CARSS胸腔积液分离的嗜麦芽窄食单胞菌对抗菌药物的药敏情况
3 讨论
2014—2019年CARSS胸腔积液标本分离菌株分布及药敏结果显示,胸腔积液标本中分离的G+菌和G-菌所占比例相当。其中G+菌以金黄色葡萄球菌居于首位,G-菌以大肠埃希菌居于首位,其次是肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌、阴沟肠杆菌,同既往CHINET耐药性监测的主要菌种检出排名相同[1]。

回顾性分析2014—2019年每年的全国细菌耐药监测总报告发现,大肠埃希菌对碳青霉烯类抗生素的耐药率为1.1%~1.5%,而肺炎克雷伯菌对碳青霉烯类抗生素的耐药率呈逐年增高趋势,从2014年的4.5%上升至2019年的11.7%。与全国分离自所有标本的大肠埃希菌、肺炎克雷伯菌相比,分离自胸腔积液标本的大肠埃希菌、肺炎克雷伯菌对碳青霉烯类抗生素的耐药形势严峻,大肠埃希菌的耐药率为1.0%~2.8%,肺炎克雷伯菌的耐药率为7.1%~17.1%,应重点关注。

近年来,CRE在世界范围内呈逐年增多趋势,世界卫生组织(WHO)将其列为最具威胁人类健康的“超级细菌”[6],且有显著区域差异性[7]。在我国,三甲医院CRE的检出明显高于二甲医院。产碳青霉烯酶的菌株可因质粒介导造成不同菌株间的传播扩散[8]。耐碳青霉烯类肺炎克雷伯菌(CRKpn)、耐碳青霉烯类大肠埃希菌(CREco)、耐碳青霉烯类阴沟肠杆菌(CREcl)在临床最为常见,此次报告表明, CRE的耐药性变迁结果显示CRKpn检出率从2014年的9.9%逐渐上升至2019年的15.5%,应引起高度重视。对于肺炎克雷伯菌,高毒力肺炎克雷伯菌(hypervirulentKlebsiellapneumoniae, hvKP)亦值得关注。hvKP可引起健康人群严重的社区获得性感染,我国曾报道过一种携带blakpc-2的碳青霉烯类耐药的高毒力ST11型肺炎克雷伯菌克隆株[9]以及ST11型碳青霉烯类耐药高黏液型肺炎克雷伯菌的播散[10],故及时、准确的鉴别高毒力肺炎克雷伯菌将有助于临床的诊疗。CRECO的耐药率总的来说保持在较低水平。需值得注意的是,阴沟肠杆菌对美罗培南和亚胺培南的耐药率在2016—2017年显著上升,原因有待进一步探讨。头孢地尔[11]、头孢他啶/阿维巴坦、美罗培南/vaborbactam[11]、头孢吡肟/enmetazobactam和头孢吡肟/taniborbactam[12]将作为治疗CRE的新型药物。新型抗菌药物头孢他啶/阿维巴坦是治疗KPC-2型CRE的首选药物[13],对KPC-3型CRE效果欠佳。另有研究[14]表明,产NDM型CREco较产KPC型菌株耐药情况更为严重,临床实验室应加强碳青霉烯酶及耐药基因[15]的检测,以便于临床精准治疗。
分离自胸腔积液标本的非发酵菌中铜绿假单胞菌对所测抗菌药物的耐药率相对较为稳定,对碳青霉烯类抗生素的耐药率为18.1%~32.0%,较分离自其他标本类型的耐药率低[16]。最新研究[17]表明,新型ceftolozane/tazobactam对非碳青霉烯酶导致的耐碳青霉烯类铜绿假单胞菌有很好的抗菌活性。鲍曼不动杆菌对多数抗菌药物的耐药率仍保持在高水平状态,2017年耐药率较前明显下降,可能与国家抗菌药物合理应用的相关政策出台相关。
目前治疗胸腔感染的抗菌药物仍主要根据当地的流行病学特征和细菌监测数据,以及国内外的相关指南进行选择。要重视全国细菌耐药监测工作,以了解我国及本地区、本单位耐药流行趋势,从而更有效的指导临床合理用药。

