内脏脂肪组织在克罗恩病发病、诊断及治疗中的作用
陈 博,阳惠湘
中南大学湘雅医院消化内科,长沙 410008
炎症性肠病(inflammatory bowel disease,IBD)包括克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)。CD是一种慢性炎性肉芽肿性疾病,可累及全消化道,多见于末端回肠和临近结肠,呈节段性分布,表现为透壁性炎症。CD的确切致病机制尚不明确,目前认为与免疫、遗传、肠道菌群、环境等多种因素有关[1]。尽管CD患者因肠道吸收功能不良出现体重减轻,但其内脏
脂肪含量却是增加的。早在1932年,Crohn就发现CD患者肠系膜脂肪组织(mesenteric adipose tissue,MAT)增生的现象[2]。
内脏脂肪组织(visceral adipose tissue,VAT)是指包绕内脏的白色脂肪组织,主要分为网膜脂肪组织、MAT、腹膜后脂肪、性腺周围脂肪和心包周围脂肪等,其中MAT是指包绕肠系膜、以网状附着于肠管上的VAT[3]。显然MAT和VAT的概念不同,MAT属于VAT。鉴于目前针对CD和VAT的相关文献和临床研究,常将MAT等同于VAT,故本文在表述中亦将MAT统称为VAT。VAT已被证实在调节全身炎症反应中发挥关键作用[3],而MAT增生是CD的特征性表现,因此,VAT在CD发生发展中的功能及影响成为目前关注的焦点。本文对VAT在CD发病、诊断及治疗中的作用进行梳理、总结,旨在帮助临床医生加深对二者的认识。
1 爬行脂肪征
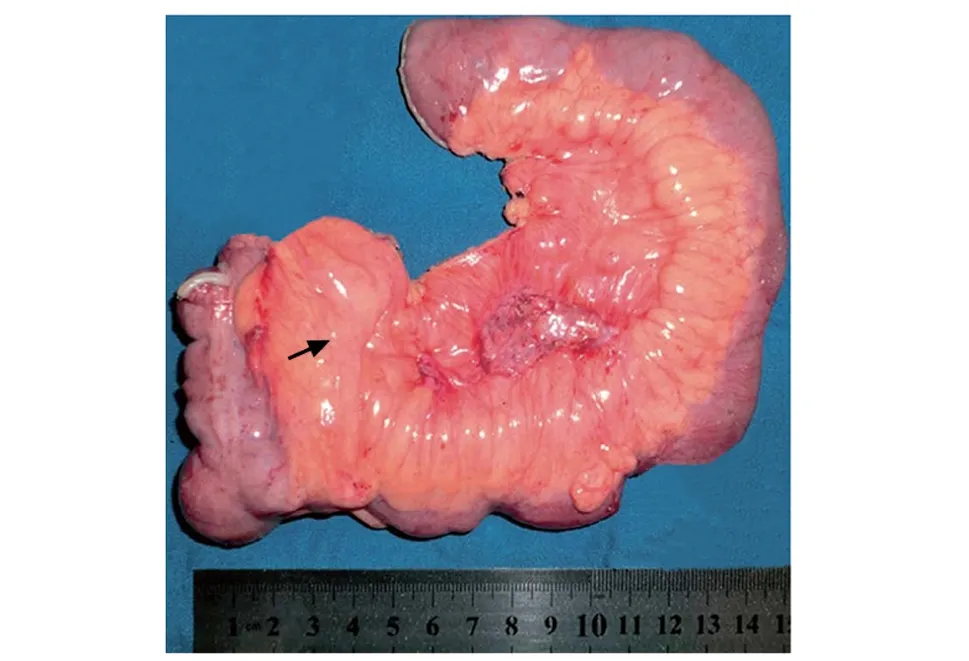
图1 克罗恩病患者的病变肠切除标本[5]显示,增生的肠系膜脂肪组织(箭头)包绕肠管且超过其周长的50%,即“爬行脂肪征”
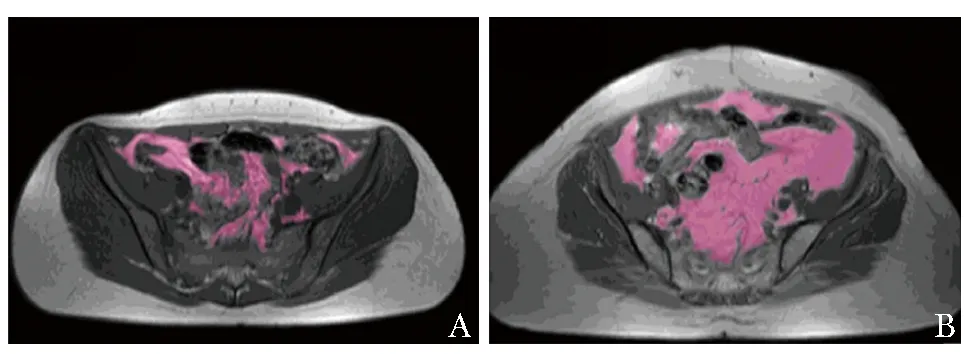
图2 内脏脂肪组织(紫色)的MRI定量分析影像[6]A.正常人;B.克罗恩病患者
爬行脂肪是指从肠系膜向肠延伸的白色脂肪组织,包绕肠管并超过其周长的50%,覆盖部分肠管并使肠系膜角闭合[4]。CD患者肠系膜出现VAT增生的现象称为“爬行脂肪征”,其为CD的特征性改变(图1,2)[5-6]。大多数早期CD患者小肠切除标本中可见VAT堆积,但其他胃肠疾病中却未见此发现[7]。CD患者VAT的组织病理学检查可见组织纤维化、血管周围炎症、淋巴管增厚、基质细胞浸润、神经周围慢性炎症和小脂肪细胞[5]。此外,在形态学上,CD患者肠系膜脂肪细胞的大小约为对照组的1/4,但数量却为对照组的4倍[8]。因此,爬行脂肪组织在病理学与形态学上的特别之处证实了其对于CD的特异性。
2 内脏脂肪组织在克罗恩病中发挥炎性作用
VAT在CD患者中形成具有特异性的爬行脂肪,研究人员对其功能进行了深入研究,发现VAT的炎性介质及脂肪因子释放增加,而这些炎性介质和脂肪因子的增加与炎症反应密切相关,提示VAT在CD的发病机制中发挥炎性作用。
2.1 炎性介质与克罗恩病
CD患者的VAT既可合成促炎细胞因子,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-6、IL-1β、IL-18等,又可分泌抗炎细胞因子,如C反应蛋白(C-reactive protein,CRP)、IL-10等[9],这些炎症介质共同参与了CD的炎症反应。
2.1.1 CRP
CRP是炎症反应的非特异性标志物,常用于判断CD患者病情的严重程度。活动期CD患者的CRP水平明显增高,提示疾病控制不佳。既往认为CRP主要来源于肝脏,IL-6是其合成的有效诱导因子,但最新研究表明,CD患者的肠系膜脂肪细胞也可产生CRP,且产生的量与全身CRP水平相关[10]。
Peyrin-Biroulet等[11]研究发现CRP基因在CD患者VAT中过表达,其mRNA水平是结直肠癌患者的(1450±750)倍;而同一CD患者的VAT和皮下脂肪组织(subcutaneous adipose tissue,SAT)的CRP表达比较,前者的mRNA水平是后者的(140±65)倍。此外,该研究在蛋白质水平亦证实了VAT中CRP表达增高,说明VAT是CD患者CRP的重要来源,VAT通过炎症反应积极参与了CD发病。
关于VAT增强CD患者体内CRP表达的机制,有理论认为局部细胞因子(TNF-α、IL-6)的产生和革兰氏阴性菌的移位协同促进CD患者肠系膜脂肪细胞CRP的生成[11]。VAT和肝脏一样,可通过分泌IL-6调控CRP水平。另外,CD为可穿透肠壁的炎症,肠道通透性增加,细菌移位至VAT,其后细菌作为Toll样受体4(Toll-like receptor 4,TLR4)配体被肠系膜脂肪细胞上的相关特异性受体识别,促进CRP的生物合成。
2.1.2 TNF-α
TNF-α是一种重要的促炎因子,与CD患者肠黏膜溃疡相关,目前认为抗TNF-α单克隆抗体是诱导CD患者疾病缓解的有效药物[12]。研究表明,CD患者VAT的脂肪细胞是TNF-α的主要来源细胞,与健康对照组相比,CD患者VAT中的TNF-α表达水平明显增高[12]。
2.2 脂肪因子与克罗恩病
脂肪因子是指由脂肪组织分泌的具有生物活性的激素样介质。目前,已证实有50多种脂肪因子与CD相关,如瘦素(leptin)、脂联素(adiponectin)、抵抗素(resistin)、趋化素(chemerin)、内脂素(visfatin)等[12],主要脂肪因子名称及功能见表1。

表1 与CD相关的主要脂肪因子及功能
2.2.1 瘦素
瘦素是一种分子量为16 kDa的非糖基化蛋白,属于Ⅰ型细胞因子超家族,主要由脂肪细胞产生[19]。结构上,瘦素被认为是IL-6家族的促炎细胞因子[20],可促进TNF-α的产生,并与TNF-α协同发挥促炎作用[13]。其可调节辅助T细胞极化,通过记忆T细胞促进幼稚T细胞增殖和干扰素-γ的产生[14]。
对CD患者瘦素的表达研究发现,瘦素mRNA在CD患者的病变组织中过表达[21]。此外,与SAT相比,VAT中瘦素mRNA的表达较高[22]。但也有研究表明,CD患者和健康对照组的血清总瘦素水平无显著性差异[23-24]。这表明CD患者瘦素的高表达呈局部性,而非全身性,提示VAT通过自分泌和旁分泌的方式在病变组织周围释放瘦素以促进炎症进程,参与CD发病机制。
2.2.2 脂联素
脂联素是一种分子量约30 kDa的多肽,包括4个结构域,几乎完全由脂肪细胞分泌[25],其具有显著的抗炎作用。在血管壁内,脂联素通过减少黏附分子的表达以抑制单核细胞和内皮细胞的黏附,通过抑制清道夫受体的表达来抑制巨噬细胞向泡沫细胞转化,并减少平滑肌细胞对生长因子的反应[25]。但也有研究认为脂联素对肠上皮细胞具有促炎作用[26]。
CD患者脂联素的来源及作用已被广泛研究,但结果不一。在活动性CD患者中,VAT中脂联素的水平是降低的,且表达水平与疾病活动度呈负相关[24]。Pajvani等[27]比较了有/无活动性病变CD患者回肠末端脂联素的表达差异,发现无活动性病变回肠末端脂联素的表达较多,提示脂联素可能属于CD的保护性因素。但也有研究得出相反的结果,Yamamoto等[8]研究发现,CD患者病变的肠道组织周围VAT中脂联素mRNA和蛋白质的表达水平均明显高于其正常的肠道组织。此外,对于CD患者血清脂联素水平的测定亦得出了相互矛盾的结果[23]。这可能与脂联素存在不同功能亚型,与不同活性的脂联素受体结合而产生不同的生物学效应有关[15]。
2.2.3 抵抗素
抵抗素属于半胱氨酸家族的抵抗素样分子[16]。最初抵抗素在脂肪细胞被发现,但其主要表达于VAT内外的巨噬细胞[16]。抵抗素与炎症过程有关,其表达由促炎细胞因子(IL-1、IL-6和TNF-α)诱导。同时,抵抗素可通过核因子-κB(nuclear factor-κB,NF-κB)信号通路促进单核细胞表达TNF-α、IL-6和IL-12,发挥促炎活性[17]。研究显示,与健康对照组相比,CD患者的血清抵抗素水平升高,但与其他疾病(如非酒精性脂肪肝、憩室病和结直肠癌)相比无显著差异[28],提示抵抗素可能为非特异性炎症标志物。根据抵抗素的特点及血清水平变化,抵抗素被认为与CD患者的CRP水平相关,是活动性CD的独立预测因子[29]。
2.2.4 趋化素
趋化素是由脂肪组织产生的脂肪因子,表现出趋化因子样活性,通过招募和激活抗原呈递细胞在炎症早期发挥作用,连接先天性免疫和获得性免疫[18]。Weigert等[30]研究发现,IBD患者(CD患者230例,UC患者80例)的血清趋化素水平升高,而此现象在CD患者中表现更为明显。这一结果与Terzoudis等[31]的研究结果一致,提示趋化素是促进CD炎症反应的重要因子。
2.2.5 其他脂肪因子
此外,亦有一些其他脂肪因子在CD中发挥重要作用,如内脂素、生长激素释放肽(ghrelin)、视黄醇结合蛋白4(retinol binding protein 4,RBP4)、网膜素-1等。研究表明,内脂素促进炎症因子的生成,发挥促炎作用[32]。生长激素释放肽具有拮抗瘦素的作用,主要抑制瘦素诱导的巨噬细胞和T细胞促炎反应,降低促炎细胞因子的表达及胃肠道中瘦素的表达[33]。RBP4是一种与代谢综合征相关的介质,在CD患者中表达升高,与疾病活动度呈负相关[34]。网膜素-1主要在大网膜组织中表达,通过抑制TNF-α发挥抗炎活性[35]。
研究证实,VAT产生的炎性介质和脂肪因子在CD患者肠道炎症反应中发挥重要作用。尽管这些关键介质的生理作用仍有待更深入的研究,但显而易见,VAT参与了CD发病并促进了疾病进展,VAT与CD的发病机制、病程及诊断关系见图3。
3 内脏脂肪组织与克罗恩病病程、诊断及治疗
3.1 内脏脂肪组织与克罗恩病病程
目前对于VAT增生是CD的原发性改变还是继发性改变问题仍存在争议,但VAT在CD发病机制中发挥重要作用是肯定的[9]。VAT增生可能由CD的透壁性炎症引起,而后者与促炎因子的释放有关[36],同时VAT可产生多种炎性介质促进炎症发展。即CD的跨壁炎症引起了VAT增生,VAT分泌的炎性介质又加剧了CD炎症。由此可见,VAT与CD炎症情况密切相关(图3)。因此,VAT含量可反映CD的严重程度和活动度,并可预测患者的预后。Sheehan等[7]首先证实爬行脂肪与CD的溃疡、狭窄、肠壁增厚及跨壁炎症有关,其中与跨壁炎症的相关性最强。Li等[37]也证实VAT含量与疾病活动度显著相关。Van Der Sloot等[38]对马萨诸塞州总医院IBD前瞻性研究数据库中的482例CD患者进行研究,发现CD患者的VAT含量与穿透型病变的发生风险相关。不仅如此,儿童CD患者中也有类似发现。Uko等[39]的研究亦证实,儿童CD患者VAT的含量越高,发生瘘管和纤维狭窄疾病的风险越高。
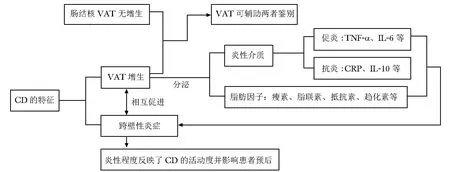
图3 内脏脂肪组织与克罗恩病发病机制、病程及诊断的关系VAT:内脏脂肪组织;CRP:C反应蛋白;CD、TNF-α、IL:同表1
为更好地探讨VAT与CD活动度的关系,常使用2个关键指标反映VAT的含量。一个指标为肠系膜脂肪指数(mesenteric fat index,MFI),也称内脏脂肪指数(visceral fat index,VFI),即VAT面积与SAT面积的比值(visceral fat area/subcutaneous fat area,VF/SC),被认为是复杂型CD的生物标志物[22,39]。在多变量分析中,CD患者的VFI升高会增加复杂疾病表型(狭窄/穿透型病变和/或既往手术)的风险[40]。另一个指标为VAT面积与总脂肪质量(fat mass,FM)的比值。Büning等[6]的研究证实高VAT/FM比值与狭窄型和穿透型CD严重疾病行为相关。
预后方面,VAT是CD患者肠切除术后复发和并发症发生的独立预测因素[41]。最新研究表明,VAT表面积>130 cm2(L3水平的横断面CT图像测得)的患者需要手术时间更长、手术范围更大、术中失血更多、术后更易发生肠梗阻[42]。因此,VAT是CD患者术后预后不良的危险因素,这一结论得到相关研究的进一步证实[5]。但Maconi等[43]研究发现,对于缓解期的CD患者,MAT是否增生与患者5年内预后无关,且与患者2年内疾病复发风险无显著相关。说明对于病情稳定的缓解期CD患者,不能仅通过VAT含量判断其预后和复发情况。
总之,VAT面积与CD疾病的严重病程密切相关;爬行脂肪的范围越大,表明CD的活动度越强,也提示更为严重的疾病表型和更差的疾病预后。
3.2 内脏脂肪组织与克罗恩病的诊断
目前,CD的诊断缺乏金标准,需结合临床表现、实验室检查、内镜检查、影像学检查和组织病理学检查进行综合分析并密切随访[44]。临床上CD的诊断是一大难题,尤其难以与肠结核进行鉴别诊断。而VAT增生是CD的特征性表现,有助于鉴别 CD与肠结核。Yadav等[45]对CD和肠结核患者进行回顾性研究,发现CD组患者的VAT面积及VF/SC均明显高于肠结核组,以“VF/SC=0.63”为截断值鉴别CD与肠结核的灵敏度为82%、特异度为81%。Ko等[46]也证实了VAT面积在CD与肠结核鉴别中的价值。但由于研究样本量不足,目前尚不能将VAT面积作为诊断CD的标准,VAT在CD诊断方面的价值有待进一步研究证实。
3.3 内脏脂肪组织与克罗恩病的治疗
临床上根据患者疾病的严重程度及对治疗的反应情况综合选择治疗方案[44],主要治疗药物包括氨基水杨酸制剂、糖皮质激素、硫唑嘌呤类药物、免疫抑制剂、生物制剂等。
硫唑嘌呤是治疗CD的维持和缓解用药,其治疗剂量与患者体重相关。6-硫鸟嘌呤核苷酸(6-thioguanine nucleotide,6-TGN)是硫唑嘌呤的代谢物[44],CD患者的6-TGN水平与其临床缓解之间存在相关性[47],而与去脂体重、SAT面积、VAT面积等参数无相关性[48]。这表明VAT含量与6-TGN水平无关,即VAT对硫唑嘌呤治疗效果的影响较小。
英夫利昔单克隆抗体是目前国内治疗CD最常用的生物制剂,可诱导患者的黏膜愈合。一项回顾性研究分析了97例CD患者VAT含量与英夫利昔单克隆抗体诱导的黏膜愈合之间的关系,发现VAT含量增加与黏膜愈合减弱独立相关[49]。可能由于VAT表达较高水平的TNF-α,影响英夫利昔单克隆抗体的治疗效果,表明CD患者对某些生物制剂的反应受VAT的影响。
4 小结
VAT通过产生多种炎性介质和脂肪因子在CD的发展过程中发挥重要作用,VAT含量与CD的疾病活动度相关,并影响患者预后。此外,对VAT面积的测量有助于CD诊断,但该诊断方法仍需多中心、大规模队列研究进行验证。目前,尚无针对VAT的治疗策略,VAT能否成为CD治疗的新靶点,有待进一步研究证实。随着对VAT研究的深入,相信会取得更大突破和进展,为CD患者带来福音。
作者贡献:陈博负责收集文献、撰写并修订文章;阳惠湘负责提出选题思路,修订文章。
利益冲突:无

