抗癌新药依维莫司的合成工艺优化和抗癌活性研究
*王新利 兰燕芹 王尧
(福建医科大学附属协和医院肿瘤科 福建 350001)
依维莫司(Everolimus)为西罗莫司衍生物,由瑞士诺华公司研制开发的一种哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂,又称40-O-(2-羟乙基)-西罗莫司,临床上主要用于预防肾移植和心脏移植手术后的排异反应(图1)。随着对依维莫司药理活性和作用机制研究的不断深入,其在肿瘤治疗领域开始显示出其积极的作用。研究表明,依维莫司抗癌机制与西罗莫司类似,将肿瘤细胞阻滞于G1期,使肿瘤细胞的生长受抑制并最终阻滞细胞的增殖甚至使细胞凋亡,发挥其独特的靶向抗肿瘤活性[1-3]。
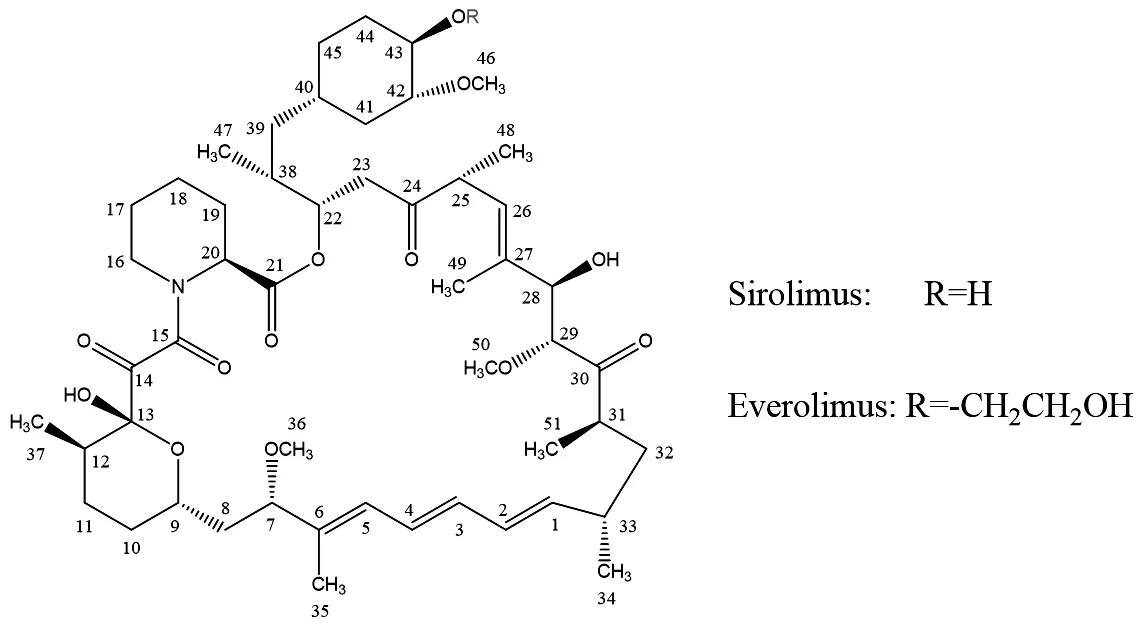
图1 西罗莫司和依维莫司结构式
近年来,依维莫司在各类型肿瘤治疗领域应用越发广泛,自2003年依维莫司用于治疗肾细胞癌首次在瑞典上市,2006年已全面占领欧洲市场。2009年3月美国FDA批准依维莫司(商品名:Afinitor)用于肾细胞癌患者,2010年11月美国FDA批准癌症治疗药依维莫司用于治疗伴有与结节状脑硬化相关的室管膜下巨细胞星形细胞瘤的患者[4]。基于抗肿瘤药物市场强劲的增长势头和依维莫司口服给药和适用多种适应症的特点,其在肿瘤药物市场上将占据重要位置,已入选美国行业最具市场前景的十大新药之一[5]。目前,国内外报道的依维莫司合成工艺较少,它们都是以西罗莫司为原料,经与磺酸酯侧链经醚化反应形成依维莫司前体,最后经脱硅醚保护得到依维莫司(图2)[6-9]。当前,随着依维莫司适应症的不断扩大,其需求量将大幅增长,但现有依维莫司的制备工艺由于产率低,成本较高,已无法满足工业化生产的需求。
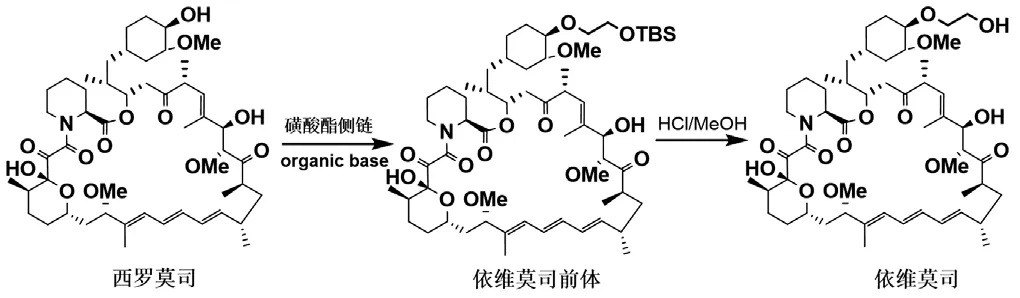
图2 依维莫司合成工艺路线
通过对西罗莫司结构进行分析,发现其反应位点较多,在醚化反应时,会产生两个羟基位点的双醚化副产物和C28位羟基的单醚化副产物(图3)。此外,西罗莫司化学性质不稳定,在酸碱等条件下容易造成开环等问题。现有依维莫司合成中,其醚化反应时间较长,致西罗莫司及其中间体在高温有机碱作用下产生开环降解,最终导致依维莫司的合成收率降低。本项目首先将乙二醇经单硅醚保护,尝试将另一端的羟基经与磺酸酐反应形成活性磺酸酯,再与西罗莫司C43位羟基反应,考察反应当量比、反应温度和反应时间等工艺参数对产物收率的影响,以期提高醚化反应的区域选择性,显著提高关键中间体的收率,最后经全新的脱硅醚法得到最终产品。同时,通过尝试不同试剂及优化工艺参数,改进相应的后处理方法,以期提高依维莫司产品的收率和提高产品质量,降低生产成本。
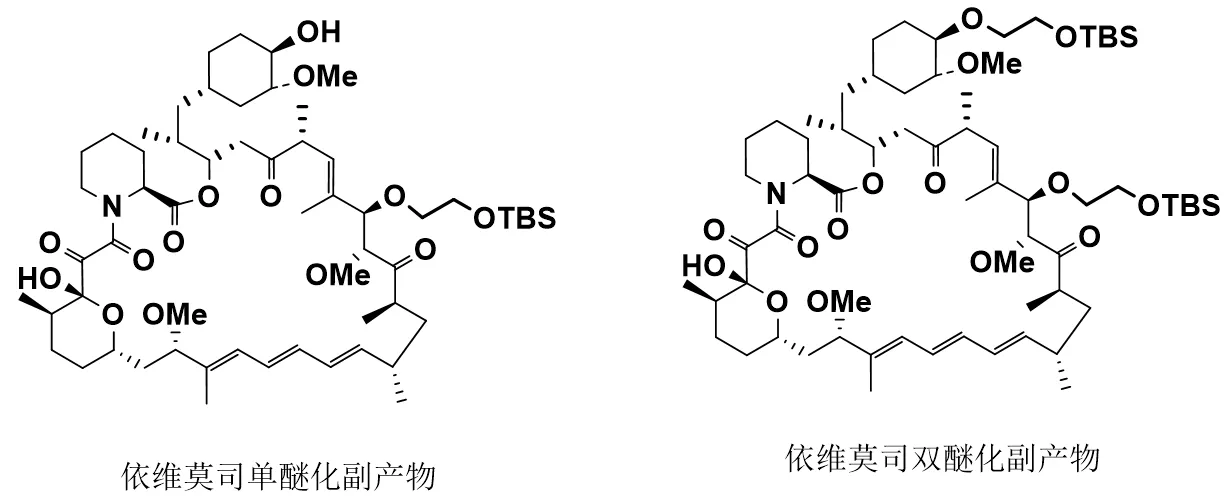
图3 依维莫司合成工艺醚化反应主要副产物结构式
1.试验部分
(1)试验试剂
西罗莫司、依维莫司,四川雅途生物科技有限公司;三乙胺,三氟甲磺酸酐,二氯甲烷,甲醇,四氢呋喃,石油醚,乙酸乙酯,甲苯,化学纯,购自国药集团;二异丙基乙胺、2,6-二甲基吡啶,分析纯,阿拉丁公司;氢氟酸吡啶盐,分析纯,北京偶联科技有限公司;硅胶,上海安耐吉有限公司。
(2)试验仪器
低温反应釜(1L,带搅拌),集热式油浴加热搅拌器,循环水真空泵(SHZ-D3),真空干燥箱,郑州豫华仪器制造公司;高压液相色谱液质联用仪,高压液相色谱仪,安捷伦科技有限公司;电子天平(ML104),梅特勒-托利多(中国)公司;温度计、PHs-3C型酸度计,上海化科实验器材公司;HBS-1096C酶标仪。
(3)侧链磺酸酯的制备
根据西罗莫司C28、C43位羟基的位阻和活性差别,选择三氟甲磺酸酐为磺酸化试剂,获得醚化反应侧链。图4为磺酸酯侧链的制备。将乙二醇单硅醚保护中间体倒入茄形瓶中,降温至0℃,加入三乙胺,搅拌条件下加入三氟甲磺酸酐,反应约1h后,经TLC薄层和采用磷钼酸显色检测反应进程,反应完毕。反应液后经稀盐酸(1N)水溶液、饱和碳酸氢钠溶液和饱和食盐水萃取,有机层经无水硫酸钠干燥,抽滤后经旋转蒸发仪减压浓缩获得磺酸酯侧链中间体A。
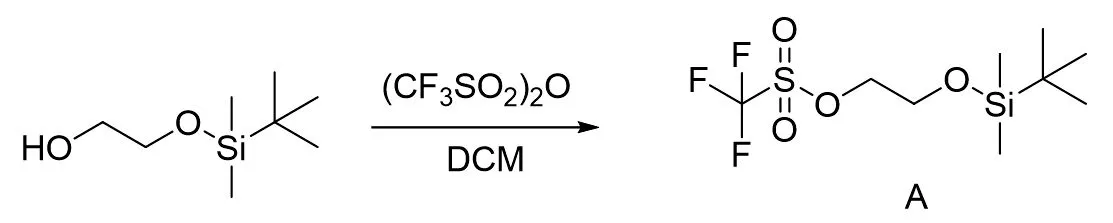
图4 醚化反应中间体A的制备
(4)西罗莫司醚化反应
在相同条件下,将磺酸酯侧链分别与西罗莫司平行反应,考察反应时间、当量比和温度对反应速率和区域选择性的影响。综合实验结果,得到较优的工艺参数,并选择适宜的有机碱、磺酸酯侧链。醚化反应如图5所示。将西罗莫司倒入茄形瓶中,加入甲苯溶剂,升温至40℃-60℃等不同温度后,加入二甲基吡啶,然后加入磺酸化侧链(侧链与西罗莫司不同当量比,分别为1:1,1:2,1:3),反应至1-3h后,经TLC检测反应,反应液降温冷却至0℃后,直接经快速柱层析方法进行分离纯化,获得关键的依维莫司前体。
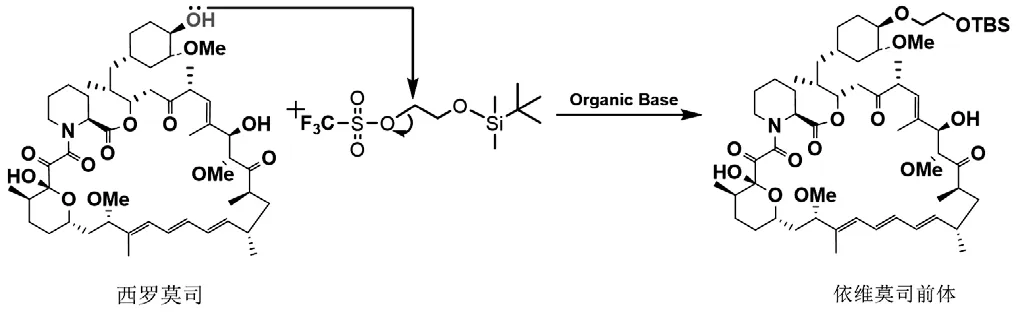
图5 西罗莫司醚化反应合成路线图
(5)依维莫司前体硅醚脱保护反应
传统方法:将关键中间体依维莫司前体溶于甲醇中,降温到0℃后,加入稀盐酸进行脱保护,反应3h后,经TLC检测,反应完毕后。将反应液投入大量冰水中,有大量的白色固体析出,经抽滤、烘干获得依维莫司产品。
本文方法:将关键中间体依维莫司前体溶于四氢呋喃中,降温到0℃后,加入吡啶氢氟酸盐进行脱保护,经TLC检测,反应完毕后将反应液投入大量冰水中,有大量的白色固体析出,经抽滤、烘干获得依维莫司产品。
将合成得到的依维莫司前体经脱硅醚得到终产品依维莫司。在依维莫司合成工艺路线中,最常规的方法是采用甲醇为溶媒,以稀盐酸脱保护。该方法使用醇类溶剂,容易在C7位形成差向异构体,且理化性质与产品极其相似,不易纯化,如图6所示。因此,本路线拟采用不同类型的有机碱氢氟酸盐,如三乙胺三氢氟酸盐、二异丙基乙胺三氢氟酸盐和吡啶氢氟酸盐等,依靠氟离子的脱硅醚作用,合成得到依维莫司产品。最后选择一种最佳的有机碱氢氟酸盐作脱硅醚试剂,脱保护反应如图7所示。
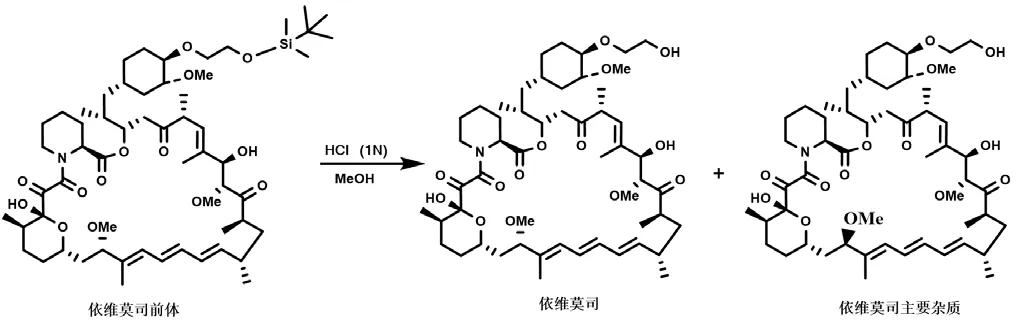
图6 文献报道的依维莫司前体脱保护反应合成路线图
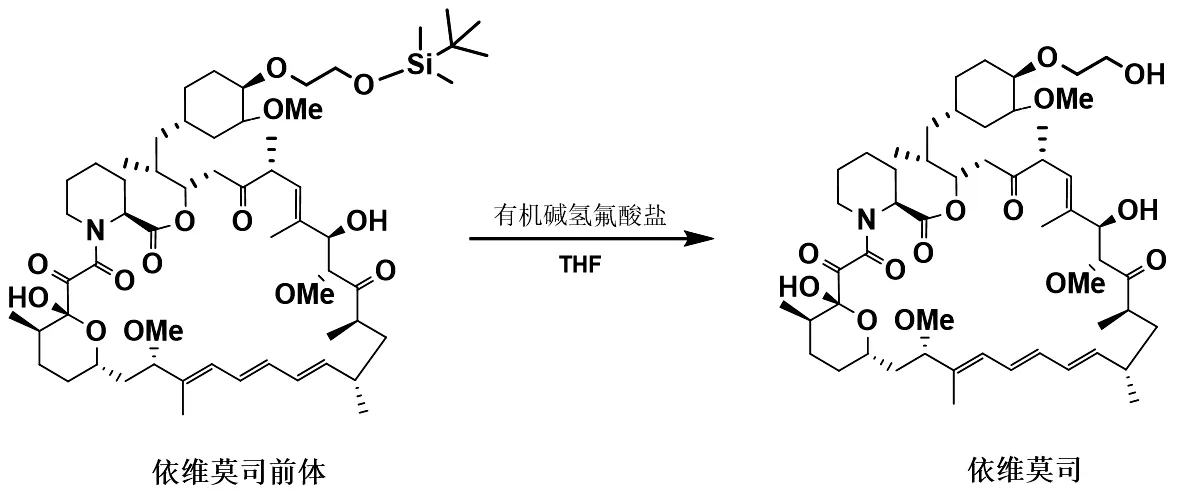
图7 依维莫司前体脱保护反应合成路线图
2.结果与讨论
(1)考察不同反应温度、反应当量和反应时间对醚化反应收率的影响
表1为合成依维莫司前体温度工艺参数优化表,在相同工艺条件及操作下,对比表中9组试验数据,反应当量、反应时间和温度对关键中间体的收率影响较大;对比表中1、2、3组试验数据,在反应温度为50℃时,具有较高的反应收率,达81%;对比表中4、5、6组试验数据,在反应当量比为1:2时,具有较高的反应收率,达80%;对比表中7、8、9组试验数据,在反应时间为1h,具有较高的反应收率。因此,综合考察三个工艺参数后发现,在反应温度为50℃,当量比为1:2,反应时间1h,具有较高的合成收率。
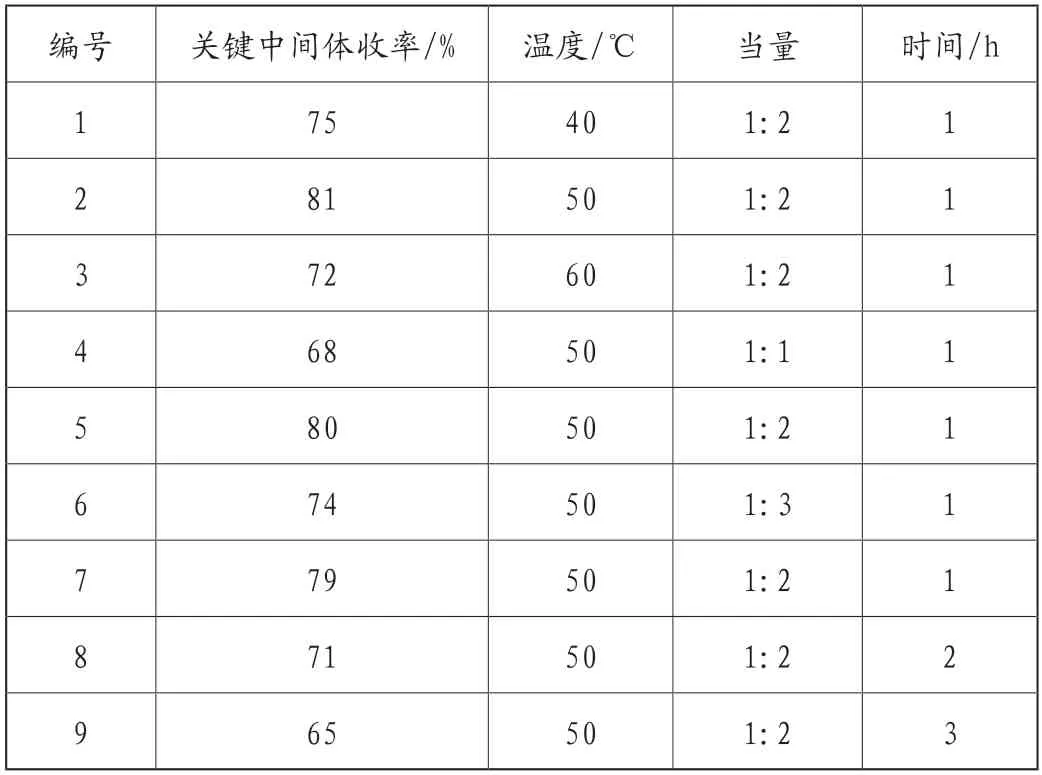
表1 醚化反应工艺参数考察表
(2)硅醚脱保护反应的条件选择
在报道的稀盐酸甲醇溶剂体系里,反应时间虽然较短,易于产生C7位差向异构化杂质,达3.3%,目标化合物依维莫司的纯度仅为其理化性质与产品极其相似,不易于分离纯化,产品收率89%。在本工艺路线中,运用四氢呋喃体系,吡啶氢氟酸脱保护,有效避免了7位异构体杂质的产生,且产品纯度高达96.1%。产品收率88.0%,如图8所示。
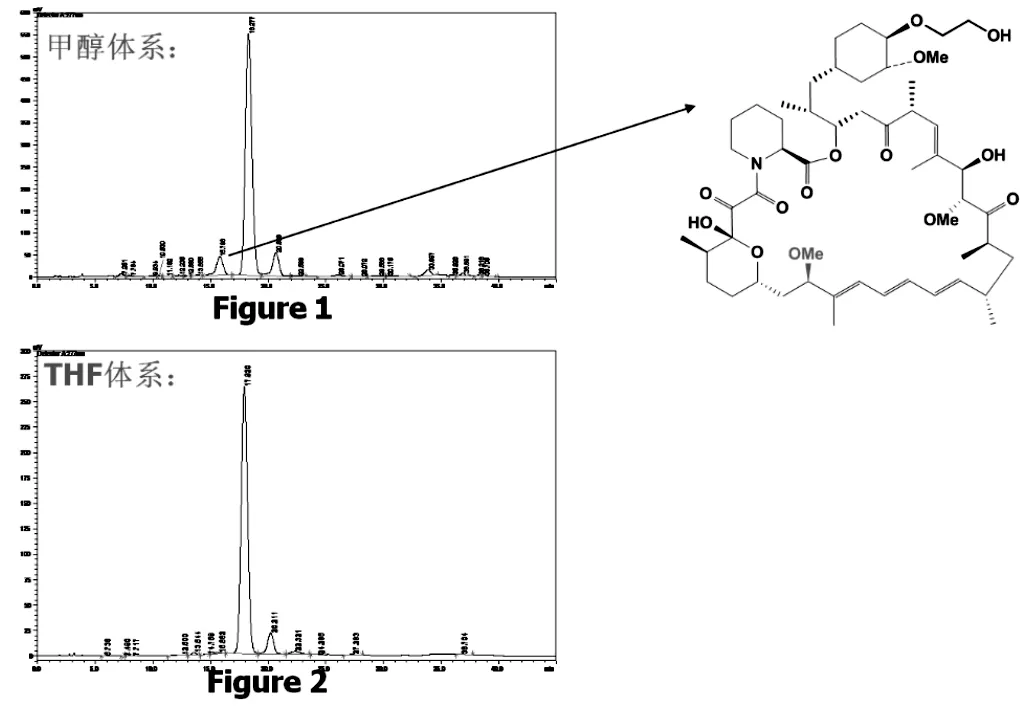
图8 两种不同硅醚脱保护反应体系对产品纯度的影响
(3)柱层析分离纯化
采用正向硅胶填料200-300目,进行快速柱层析分离,采用石油醚和乙酸乙酯梯度洗脱系统,获得纯度大于98%的高纯度样品,柱层析分离纯化收率为88.3%。
(4)自制样品对肾癌细胞株抑制活性检测
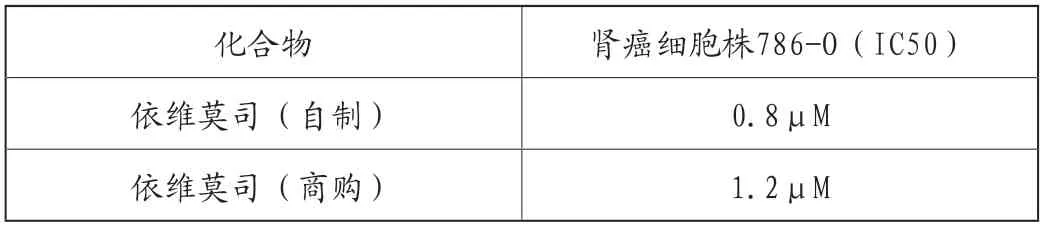
表2 本文自制样品与商购样品对肾癌细胞抑制能力比较
采用MTT法,对本文自制的依维莫司样品和商购样品进行体外肾癌细胞株786-O的细胞抑癌活性检测,本方自制的依维莫司对癌细胞半数抑制浓度为0.8μM,商购依维莫司的半数抑制浓度为1.2μM,发现自制样品具备与商购样品相当的抑癌活性。
3.结论
(1)考察反应当量比、时间、温度等对第一步醚化反应速度、醚化区域选择性和最终产品收率的影响,获得当量比为1:2,反应温度为50℃,反应时间1h,具有较高的产品收率。
(2)在脱保护反应中,采用新的非质子溶剂吡啶氢氟酸盐反应体系,可有效避免质子性溶剂易在C7位产生异构化杂质的影响。
(3)通过两步合成工艺优化,获得总收率为63%,纯度为98%的样品。
(4)通过体外抗癌生物活性验证,本工艺获得的依维莫司具备与商购依维莫司相当的抗癌活性。

