2019年国家医疗器械监督抽检产品质量状况分析
李晓,张欣涛,郝擎,朱炯,马金竹
1 中国食品药品检定研究院,北京市,102629
2 天津市医疗器械质量监督检验中心,天津市,300384
0 引言
国家医疗器械监督抽检(以下简称国抽)是加强医疗器械产品质量监管、保障公众用械安全的重要手段[1-2]。通过医疗器械监督抽检,加大对不符合标准规定产品生产、经营、使用单位的监管力度,能够促使企业端正质量管理和风险防控态度,加强生产过程控制,加强流通环节产品质量跟踪,促进上市后医疗器械产品质量提高,减少质量事故和械害事件发生。同时,监管部门能够在全国范围内针对同类产品统一摸排,有针对性地了解其标准、审评、生产、流通等方面产品质量状况和监管情况,全面分析产品质量,客观发现和反馈问题,更好地推动技术进步,促进医疗器械全生命周期管理体系的完善[3-7]。本文围绕2019年国抽,分析抽检品种质量状况,归纳品种质量变化特点,向行业和监管部门提出改善建议。
1 2019年国抽概况
1.1 抽样情况
2019年国抽共对54种医疗器械开展监督抽检[8],抽到样品2 749批。此外,还对5种医疗器械进行风险监测,抽到样品121批。监督抽检样品中,有源医疗器械21种,共抽到638批;无源医疗器械22种,共抽到1 809批;体外诊断试剂11种,共抽到302批。
1.2 检验情况
经检验,共发现不合格医疗器械产品212批,整体不合格检出率7.71%(由于风险监测不出具检验结论,此处不予统计,下同)。其中,有源医疗器械不合格112批,不合格检出率17.55%;无源医疗器械不合格98批,不合格检出率5.42%;体外诊断试剂不合格2批,不合格检出率0.66%。
监督抽检样品中,一共有三类医疗器械864批,二类医疗器械1 883批。三类医疗器械不合格共34批,不合格检出率3.94%,二类医疗器械不合格共177批,不合格检出率9.40%。
监督抽检样品中,国产医疗器械共2 377批,发现不合格181批,不合格检出率7.61%;进口医疗器械共353批,发现不合格30批,不合格检出率8.50%。其中,国产医疗器械涉及生产企业共1 027家,分布于全国27个省区市;进口医疗器械共涉及进口总代理单位144家,分布于全国12个省区市。
1.3 不合格品种及项目
监督抽检样品中,生产环节共1 309批,发现不合格115批,不合格检出率8.79%;经营环节共703批,发现不合格34批,不合格检出率4.84%;使用环节共537批,发现不合格39批,不合格检出率7.26%;进口代理环节共200批,发现不合格24批,不合格检出率12.00%。
监督抽检样品中原检不合格235批次,其中113批次申请复检,23批次复检合格,复检改判率为20.35%。
检验发现不合格批次数较多的10个品种信息见表1。不合格检出率较高的10个品种信息见表2。
2 品种质量变化特点
国抽针对风险高、使用量大以及既往抽检发现问题较多的品种进行了持续关注,从品种角度分析医疗器械行业发展水平。通过对近年来国抽检验结果的对比分析,发现部分品种质量发生改变,并呈以下特点:一是部分品种质量状况无明显改善,占比21%;二是部分品种的不合格检出率有明显改善,占比58%;三是部分品种不合格检出率虽无明显改善,但在重要安全和性能指标上也有明显好转,占比21%。
2.1 部分品种质量无明显改善
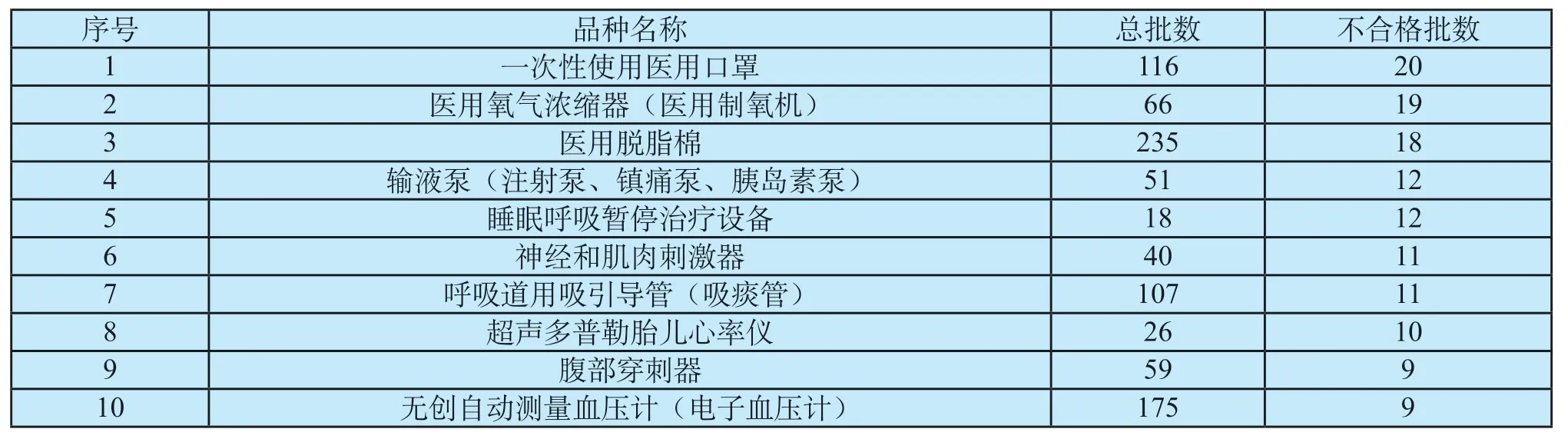
表1 不合格批次数较多的10种产品统计表Tab.1 The statistics of 10 products with large number of unqualified batches

表2 不合格检出率较高的10种产品统计表Tab.2 The statistics of 10 products with high unqualified detection rate
2.1.1 手术衣
该产品2015年至2019年已连续抽检5次,不合格检出率分别为21.43%、17.74%、9.52%、17.19%和12.77%。不合格项主要集中在胀破强力、断裂强力、抗渗水性项。其中胀破强力、断裂强力在5次抽检中均有发现。以上项目均是影响该产品使用安全的重要项目。胀破强力不合格,可能引发手术衣不能满足机械应力的要求、增加手术人员或病人感染的风险;断裂强力不合格,可能使手术衣的完整性和阻隔性无法保证、削弱医护人员的防护屏障;抗渗水性不合格,可能引发交叉感染,不能有效防止液体病源污染物渗透。造成这些项目不合格的主要原因可能是选用不适合的原材料。
2.1.2 高频手术设备
该产品2013年以来曾抽检3次,3次抽检的不合格检出率分别为16.67%、31.82%和26.09%。2013年不合格项主要集中在无法正常工作、无高频工作信号输出;2016年不合格项主要集中在设备或设备部件的外部标记、控制器件和仪表的准确度、高频漏电流;2019年不合格项主要集中在控制器件和仪表的准确度、高频漏电流和不能正常开机。其中控制器件和仪表的准确度、高频漏电流在2次抽检中均发现不合格,且均为安全或性能指标(2016年两项合计9批,2019年两项合计8批)。
2.1.3 神经和肌肉刺激器
该产品2013年以来曾抽检5次,不合格检出率分别为41.67%、46.16%、36.36%、29.84%和27.50%。不合格项主要集中在外部标记、随机文件等,其中外部标记项目2013年3批,2014年5批,2015年3批,2017年14批,2019年7批;随机文件项目2013年4批,2014年10批,2015年4批,2017年16批。
2.2 部分品种不合格检出率有明显改善
2.2.1 腹部穿刺器
该产品2018至2019年曾连续抽检2次。2018年不合格检出率为30%。2019年不合格检出率为15%。通过两年抽检,该产品质量有较为明显的提高:首先,外观、灵活性两项不合格在2019年未再被检出;其次,2次抽检均发现的不合格项目(密封性和阻气性、配合性能、硬度)也有明显改善(见表3);第三,部分在2018年被检出不合格的企业,在2019年再次被抽到后,检验结果合格。
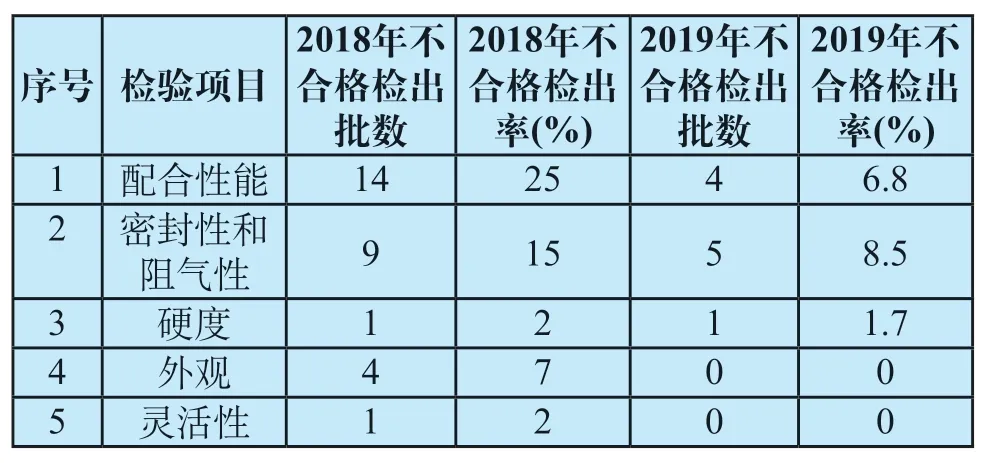
表3 两次抽检情况对比Tab.3 Comparison of two supervision and inspection
2.2.2 无创自动测量血压计(电子血压计)
该产品2014年以来共抽检5次,2014年不合格检出率为17.2%,2015年不合格检出率为28.8%,2016年不合格检出率为24.0%,2018年不合格检出率为13.1%,2019年不合格检出率为5.1%,不合格检出率在逐渐降低。另外,往年该品种比较突出的外包装信息缺少、说明书不全等现象也有了明显的改善。其中“外部标记”项在本次抽检中未发现不合格,“标识要求”不合格检出率从2014年17.2%减少至2019年5.1%,详见表4。
表4 外部标记和标识要求的不合格检出率Tab.4 Unqualified detection rate of external marking and identification
2.2.3 人绒毛膜促性腺激素检测试纸
该产品2013年、2015年、2019年共抽检3次,其中2013年的不合格检出率为13%,不合格项有标识、标签及使用说明书、阴性特异性、阳性特异性、外观、重复性、最低检测限。2015年和2019年均未发现不合格。
2.3 部分品种的安全和性能指标有明显好转
2.3.1 特定电磁波治疗器
2019年国抽共抽取特定电磁波治疗器27批次,检验发现5批样品不合格,不合格检出率18.5%。该类产品在2018至2019年连续2次抽检,2018年不合格检出率为22.2%,不合格检出率有所下降,特别是以下两点较为明显:一是2018年发现的不合格项目在2019年明显改善,包括控制器的操作部件项目、防护件项目、正常使用时的稳定性;二是2018年不合格企业较为集中的省份,2019年抽检中当地企业的产品质量明显好转。2018年抽到某省产品14批,检出不合格4批,而2019年抽到该省产品14批,检验结果均为合格。
2.3.2 半导体激光治疗机
2019年国抽共抽取半导体激光治疗机12批次,5批不合格,不合格检出率41.7%。主要不合格项目为设备或设备部件的外部标记、标记、输入功率,是影响该产品使用安全的项目,可能影响操作者对设备基本信息的掌握,导致供电不足无法正常开机使用。
但通过对比往年抽检信息,仍然可以发现一些可喜的变化。该产品自2013年以来共抽检3次,2014年不合格检出率为50%、2017年不合格检出率为67.3%。3次抽检由于检验项目的变化,导致不合格检出率未有明显降低。但对比前两次检出的不合格项目在2019年抽到样品上的表现,发现外壳和防护罩、脉冲特性、接地阻抗及漏电流等方面有了较为明显的改善,产品质量有一定提高见表5。
2.3.3 裂隙灯显微镜
该品种共抽检3次,2014年不合格检出率为33.3%,不合格项目为外部标记、总放大率允差、输入功率、最大照度;2017年不合格检出率35.7%,不合格项为外部标记、总放大率允差、输入功率、左右观察系统放大允差、变倍时物面移动量;2019年不合格检出率30.0%,不合格项全部为外部标记。3次抽检不合格检出率无明显改善,但通过对比前两次检出的不合格项目在2019年抽到样品上的表现,发现总放大率允差、输入功率、最大照度及输入功率等一些重要的安全和性能指标不合格项有明显改善,产品质量也在逐渐提高。
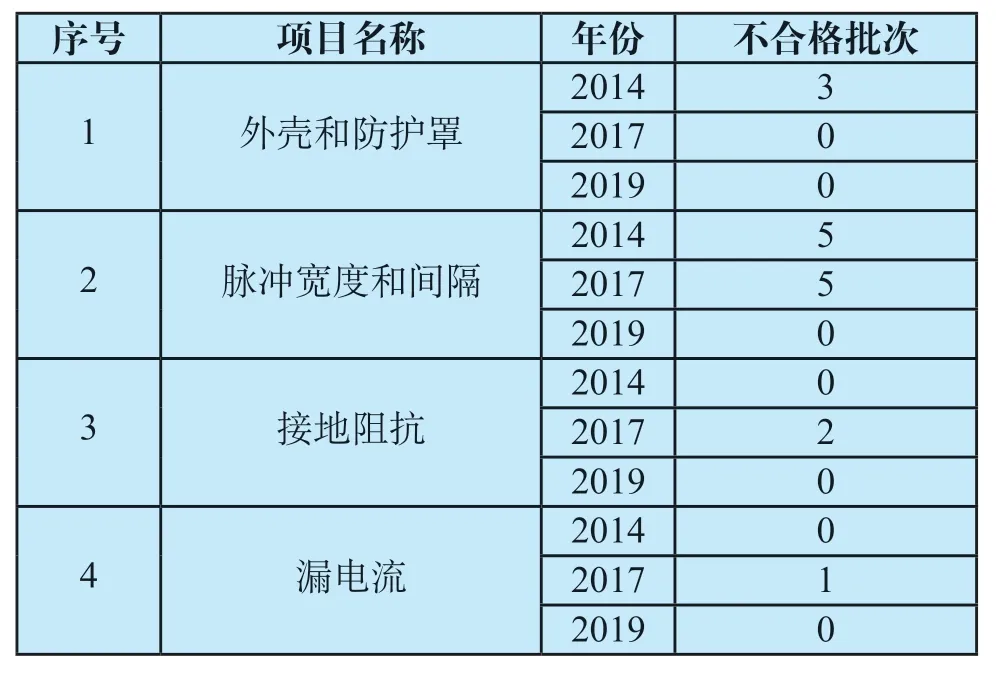
表5 三次抽检中各项目的不合格检出批数Tab.5 Number of unqualified inspection batches of each project in three sampling inspections
3 意见建议
3.1 建议医疗器械生产企业加强自身质量管理体系建设
一是加强内审自查,发现问题迅速整改;二是加强原材料的选择和验收、零配件的设计和采购;三是做好工艺控制,变更产品设计和生产工艺前应进行验证和确认;四是加强体系对企业不同环节部门的约束;五是提升出厂检验能力。
3.2 建议监管部门加强对企业、产品的管控与处理
一是加强医疗器械生产企业的体系核查,制定核查细则;二是加大体系核查、日常监督检查、飞行检查的力度和频次;三是加强对问题企业、问题产品的风险评估,实施产品召回并发布产品召回信息;四是组织监督检查和调查核实,对涉嫌违法违规的,应当立案调查,及时取证,查明事实,依法严肃处理;对涉嫌刑事犯罪的,应当及时移交并配合公安机关继续侦查;五是研究国抽发现的产品质量安全风险点,采取切实有效的措施,强化后续监管工作。
3.3 建议进一步做好审评指导与标准宣贯
一是建议出台更多更详细的审评指导原则,对需要厘清的概念划分、管理类别界定、技术要求中应包含的主要指标等给出指导意见;二是增加限定原材料、零配件等使用范围的说明,引导产业更好发展;三是建议相关标技委继续组织开展针对企业和审评人员的培训;四是建议各地医疗器械技术审评部门也能加强对标准的学习,将标准条款和精神应用到产品技术要求的审评中去。
4 结语
医疗器械技术的进步、行业的规范、产业的持续稳定健康发展,离不开每一个从业者的共同努力。目前医疗器械产业持续稳定的发展,国家对医疗器械质量愈发重视,对医疗器械监管力度也进一步加强,国抽作为重要的医疗器械监管方式,有效地衔接了从注册、生产、经营、使用的全链条医疗器械法规监管制度体系。通过对国抽检验结果的深入分析,充分利用监管资源,高效发挥抽检效能,发现品种典型问题。希望相关人员重视医疗器械质量状况,进一步提升医疗器械产业水平,保障公众用械安全。

