厚壳贻贝(Mytilus coruscus)养殖海域与天然生长海域的微生物群落比较研究*
李斯远 何治江 吕泓玥 汤秋晗 廖 智王健鑫 严小军, 张晓林,
(1. 浙江海洋大学海洋科学与技术学院 舟山 316022; 2. 浙江海洋大学 国家海洋设施养殖工程技术研究中心舟山 316022)
厚壳贻贝Mytilus coruscus 属软体动物门Mollusca、双壳纲 Bivalvia、异柱目 Anisomyaria、贻贝科Mytilidae、贻贝属Mytilus(叶莹莹等, 2011), 俗称淡菜,为温水性种, 主要分布在我国黄海、渤海和东海沿岸,以浙江沿海资源量最大。厚壳贻贝具有肉质鲜美、营养丰富、蛋白质含量高、生长繁殖快、抗病能力强、易于人工养殖等诸多优点, 是浙江舟山海域具有重要经济价值的养殖贝类之一(徐晴晴等, 2018)。目前厚壳贻贝主要养殖区域为浙江嵊泗海域和东极海域。厚壳贻贝在养殖过程中, 对于海域环境中的藻类和微生物多样性具有较强的依赖性; 一方面, 藻类是贻贝的主要食物来源(朱雨瑞等, 2010), 另一方面, 贻贝在养殖过程中对海域微生物群落具有特异的富集作用(陈瑜等, 2016), 但目前尚不清楚微生物群落对贻贝的养殖具有哪些影响。
但近年来, 随着厚壳贻贝的养殖区域的不断扩展和养殖密度逐渐增加, 其养殖过程显现种种问题,例如贻贝个体的肥满度下降, 生长速度下降, 贻贝逃苗和病害也时有发生(林永添, 2007)。有研究显示, 微生物群落变化能够影响贻贝的附着和防病(杨娜,2018; 梁箫等, 2020)。国内外已有针对不同贝类生长区海域浮游群落的调查研究(陈雷等, 2013; 尹洁慧,2013; 金雷等, 2015; Fogel et al, 2015), 但其主要焦点集中于海域中浮游植物的种类和丰度对贝类摄食以及营养价值的影响。关于海域微生物群落与贻贝生长过程以及生理生化的影响尚未见报道。厚壳贻贝作为我国东部海域最重要的养殖贝类之一, 其生存环境的微生物群落调查以及与其体内微生物群落的对比分析将对贻贝养殖具有重要研究意义。为此, 本文将针对厚壳贻贝生长海域的微生物群落结构特征及其体内微生物组成开展研究, 以期为厚壳贻贝的健康、生态养殖提供重要的理论依据。
本研究主要以厚壳贻贝为对象, 首先将调查嵊泗县枸杞岛和东极镇庙子湖岛厚壳贻贝养殖区和野生区海域的微生物群落的结构特征, 并与厚壳贻贝体内分离到的微生物组成情况相结合进行比较分析,以探明厚壳贻贝生长海域的微生物群落分布特征以及养殖和野生生长海域的微生物组成差异。本论文的研究结果一方面能够为厚壳贻贝的人工养殖和野生驯化的海域选择提供强有力的参考, 另一方面可以维持海域微生物群落的动态平衡, 促进贝类养殖产业的健康、可持续发展。
1 材料与方法
1.1 厚壳贻贝生存海域的海水微生物群落分析
1.1.1 实验材料 于2019 年5—6 月, 选择嵊泗县枸杞岛(30°42′N, 122°46′E)厚壳贻贝养殖区海域 5、10 m 水深和厚壳贻贝野生生长区海域5、10 m 水深;东极镇庙子湖岛(30°11′N, 122°41′E)厚壳贻贝养殖海域5、10 m 水深和厚壳贻贝野生生长区海域5、10 m水深, 共计 8 个点位, 具体采样位置见图 1。在调查期间, 每个点位采集3 个平行海水样本, 送往实验室经静置沉淀并过滤后进行16S rRNA 扩增子测序。

图1 枸杞岛(右下)和东极岛(右上)厚壳贻贝养殖和野生生长海域采样站位图Fig.1 Location of the sampling points for M. coruscus in natural and cultural regions in Gouqi Island (lower right) and Dongji Island(upper right)
1.1.2 实验方法 取质量合格的基因组DNA 样品30 ng 及对应的融合引物配置 PCR 反应体系, 设置PCR 反应参数进行 PCR 扩增, 使用 Agencourt AMPure XP 磁珠对PCR 扩增产物进行纯化, 并溶于Elution Buffer, 贴上标签, 完成建库。 使用Agilent2100 Bioanalyzer 对文库的片段范围及浓度进行检测。检测合格的文库根据插入片段大小, 选择HiSeq 平台进行测序。然后对所有样品的全部序列进行聚类, 以97%的相似度将序列聚类成OUT, 然后对OTU 的代表序列进行物种注释, 确定16S rRNA 序列对应的微生物名称(赵立君等, 2019)。
1.1.3 生物信息学分析 下机数据过滤, 剩余高质量的Clean data 用于后期分析(Magoc et al, 2011);通过 reads 之间的 overlap 关系将 reads 拼接成 Tags;将Tags 聚类成OTU 并与数据库比对、物种注释; 基于 OTU 和注释结果进行样品物种复杂度分析, 组间物种差异分析等。再利用 UCHIME(v 4.2.40)将 PCR扩增产生的嵌合体从 OTU 代表序列中去除, 使用usearch_global 方法将所有 Tags 比对回 OTU 代表序列(Wang et al, 2007), 对每个样品的OTU 丰度、多样性指数等进行分析, 同时对物种注释在门分类水平上进行群落结构的统计分析。在以上分析的基础上,进行基于OTU 的主成分分析(PCA)。
1.2 厚壳贻贝体内组织微生物分离与鉴定
1.2.1 培养基制备 第一类分离选用 2216E 普通海水培养基。为还原贻贝组织的营养成分, 尽可能分离到贻贝体内全部种类的微生物, 选取足量的厚壳贻贝全组织进行匀浆并过滤, 120°C、21 min 高温高压处理, 加入适量琼脂制备成厚壳贻贝肉汤培养基, 用于第二类分离。
1.2.2 微生物分离与筛选 选取来自同一生长环境的厚壳贻贝 10 只, 解剖取其鳃、性腺、消化腺、外套膜、足并用无菌海水轻轻冲洗去除组织表面杂质,使用两种不同方式分离微生物: (1) 第一类分离针对贻贝组织表面附着的微生物, 用无菌棉签分别刮取不同组织的表面, 将棉签伸至于放有玻璃珠的三角瓶中并加入少量无菌海水, 常温振荡培养1 h。(2) 第二类次分离针对可能在贻贝体内生长的微生物, 分别将上述5 类组织匀浆后, 加入放有玻璃珠的三角瓶中, 常温振荡培养 1 h。两次分离都根据选用的不同组织分成5 组, 每组3 次重复。
取上述适量处理过的培养液接种到对应的培养基中, 28°C 过夜培养, 分别挑取不同细胞形态、大小、颜色的菌落至海水LB 培养基上, 反复纯化三次。
1.2.3 微生物鉴定 使用试剂盒(TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit)分别提取筛选菌落的基因组 DNA, 选用通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和 1492R(5′-TACGGTTACCTTGTTACGACTT-3′)PCR 扩增 16S rDNA, PCR 产物送至生工生物工程(上海)有限公司进行进一步的分析和鉴定。
2 结果与分析
2.1 海水样品测序结果
如表1、表2 所示, 两个海域的所有样品优化后序列占优化前序列的 80%以上, 因此可以很好地用于后续的进一步分析。

表1 东极海域微生物群落16S rRNA 扩增子测序序列结果优化对比Tab.1 Comparison of microbes 16S rRNA sequencing in the Dongji sea area

表2 嵊泗海域微生物群落16S rRNA 扩增子测序序列结果优化对比Tab.2 Comparison of microbes 16S rRNA sequencing in the Shengsi sea area
2.2 各海域微生物群落多样性特征
通过多样性指数可以对两个海域海水样品中微生物多样性进行分析。从表 3 可得, 东极海域海水样品有效序列共计245568 条, 其中养殖区海域10 m 水深样品包含 60785 条, OTU 数 674 个; 养殖区海域 5 m 水深样品包含61905 条, OTU 数616 个; 野生生长区海域10 m 水深样品包含 60756 条, OTU 数 635 个; 野生生长区海域 5 m 水深样品包含62122 条, OTU 数 535 个。
从表 4 可得, 嵊泗海域海水样品有效序列共计249809 条, 其中养殖区海域 10 m 水深样品包含61514 条, OTU 数 592 个; 养殖区海域 5 m 水深样品包含64847 条, OTU 数584 个; 野生生长区海域10 m水深样品包含61326 条, OTU 数623 个; 野生生长区海域5 m 水深样品包含62122 条, OTU 数570 个。
综上可以得, 东极海域养殖区微生物(OTU 为616—674)丰富度大于野生生长区微生物(OTU 为535—635), 10 m 水深微生物(OTU 为 635—674)丰富度大于5 m 水深微生物(OTU 为535—616); 嵊泗海域野生生长区区微生物(OTU 为 535—674)丰富度大于养殖区区微生物(OTU 为584—592), 10 m 水深微生物(OTU 为592—623)丰富度大于5 m 水深微生物(OTU为570—584)。嵊泗海域总体微生物(OTU 为570—623)丰富度大于东极海域(OTU 为535—674)。
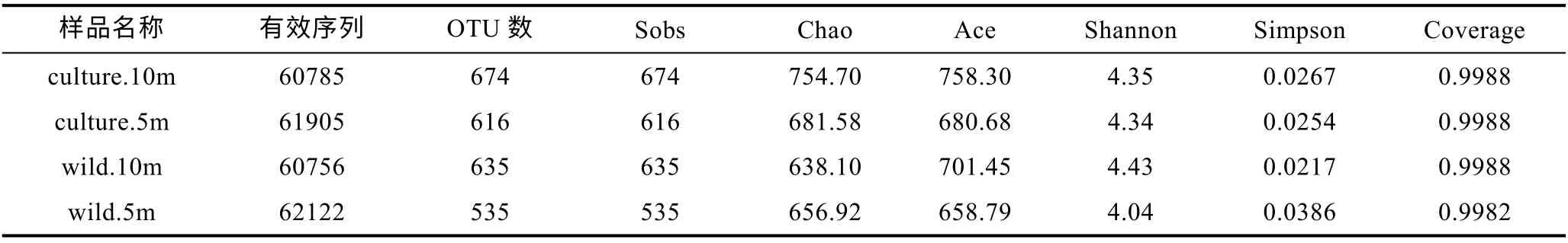
表3 东极海域样品OTU 数及多样性指数Tab.3 The OTU and diversity index in the Dongji sea area

表4 嵊泗海域样品OTU 数及多样性指数Tab.4 The OTU and diversity index in the Shengsi sea area
本文通过包括Sobs 指数、Chao 指数、ACE 指数、Shannon 指数、Simpson 指数以及 Good- coverage 指数的 Alpha 多样性来分析海水样品中微生物多样性差异(Schloss et al, 2009)。Sobs 指数、Chao 指数和ACE 指数反映样品中群落的丰富度, 而Shannon 指数以及Simpson 指数反映群落的多样性, Good-coverage反映了样品文库的覆盖率。其中, Sobs 指数、Chao指数和ACE 指数和Shannon 指数越大, Simpson 指数越小, 说明样品中的物种越丰富; Good-coverage 数值越高, 则表明样品中序列没有被测出来的概率越低,该值反映了测序结果是否代表样品的真实情况, 所有样品的 Good-coverage 指数均在 0.998 以上, 因此本次测序结果代表了样本中微生物的真实情况。
由此可得, 东极海域不同采样点微生物丰富度及多样性由大到小分别为 culture.10m > wild.10m >culture.5m > wild.5m; 嵊泗海域不同采样点微生物丰富度及多样性由大到小分别为wild.10m > culture.10m >culture.5m > wild.5m。
Core-Pan OTU 以花瓣图展示所有样本共有和特有的 OTU, 分析数据与维恩图相同, 但相比于维恩图只展示 5 组(或 5 个样品)以内的数据, 花瓣图可以展示任意组(或样品), 因此可以尽可能多的展示组间OTU 的异同。
从图2 可知, 东极海域样品微生物OTU 数为440—473, 共有 OTU 达到 436, 说明东极海域总体上微生物组成相似度较高, 养殖区海域 10 m 水深特有OTU 最高, 达到37; 野生生长区5 m 水深特有OTU最低, 仅达到 4。从图 3 可知, 嵊泗海域样品微生物OTU 数为 455—473, 共有 OTU 达到 439, 说明嵊泗海域总体上微生物组成相似度也较高, 野生生长区海域10m 水深特有OTU 最高, 达到34; 养殖区海域特有OTU 均最低, 仅达到16。
2.3 各海域微生物群落门分类水平组成分析
物种柱状图可以直观地展示各样本物种组成及比例, 反映样本间物种的变化情况。 通过与数据库进行比对, 对 OTU 进行物种分类, 本文选取在门分类水平上(物种丰富度均大于 0.5%)对各样品所作的物种丰度柱状图。

图2 东极海域样品OTU 分布Core-Pan 图Fig.2 The Core-pan diagram of OTU distribution in the Dongji sea area

图3 嵊泗海域样品OTU 分布Core-Pan 图Fig.3 The Core-pan diagram of OTU distribution in the Shengsi sea area
从图 4 可知, 东极海域主要包含变形菌门Proteobacteria、拟杆菌门 Bacteroidetes、广古菌门Euryarchaeota、放线菌门 Actinobacteria、泉古菌门Crenarchaeota 等在内的 30 个门类, 其中变形菌门是四个采样点的最大优势门类, 其在野生生长区 10 m水深、野生生长区5 m 水深、养殖区10 m 水深、养殖区 5 m 水深的百分比分别为 37.58%、28.53%、36.26%、37.13%, 拟杆菌门(19.72%—26.41%)、放线菌门(9.23%—20.86%)是东极海域第二、第三优势细菌门, 这三大优势细菌门类占据东极海域细菌比例的60%以上。
此外, 东极养殖区海域和野生生长区海域微生物门类无明显差异, 但可明显得知野生生长区海域各类优势细菌门所占比例大于养殖区海域各类优势细菌门所占比例。
从图 4 可知, 东极海域主要包含变形菌门Proteobacteria、拟杆菌门 Bacteroidetes、广古菌门Euryarchaeota、放线菌门 Actinobacteria、泉古菌门Crenarchaeota 等在内的27 个门类, 其中变形菌门是四个采样点的最大优势门类, 其在野生生长区10 m 水深, 野生生长区5 m 水深, 养殖区10 m 水深, 养殖区5 m 水深的百分比分别为51.48%、54.66%、61.88%、60.46%, 拟杆菌门(17.48%—19.72%), 放线菌门(9.08%—11.99%)是嵊泗海域第二、第三优势细菌门, 这三大优势细菌门类占据东极海域细菌比例的80%以上。
同样, 嵊泗养殖区海域和野生生长区海域微生物门类无明显差异, 但可明显得知野生生长区海域各类优势细菌门所占比例大于养殖区海域各类优势细菌门所占比例。
综合图4、图5 可知, 东极海域总体微生物丰富度要大于嵊泗海域, 但是在同样优势菌门的条件下,嵊泗海域各类优势菌门所占的微生物总比例远高于东极海域的各类优势菌门。
2.4 各海域微生物群落属分类水平组成分析
从图6 可知, 东极海域主要包含厌氧氨氧化菌属Candidatus Portiera (5.57%—8.03%), 海洋氨氧化古菌 属 Nitrosopumilus (5.27%—6.94%), Fluviicola(4.21%—6.34%), 蓝细菌聚球藻属 Synechococcus(1.82%—3.09%), 弧菌属Vibrio (0.33%—2.50%)等在内的9 个属类。从表5 可知, 东极海域厚壳贻贝养殖区和野生生长区属分类水平微生物丰度之间的比较无明显规律。

图4 东极海域微生物门分类水平物种丰度柱状图Fig.4 The phylum abundance in the Dongji sea area

图5 嵊泗海域微生物门分类水平物种丰度柱状图Fig.5 The phylum abundance in the Shengsi sea area

图6 东极海域微生物属分类水平物种丰度柱状图Fig.6 The genus abundance in the Dongji sea area
从图 7 可知, 嵊泗海域主要包含十八杆菌属Octadecabacter (10.80%—15.04%), 假交替单胞菌属Pseudoalteromonas (2.41%—8.77%), 厌氧氨氧化菌属 Candidatus_Portiera (3.57%—6.69%), ZA3312c(1.80%—3.21%), 沉积物陆丹氏菌属 Loktanella(3.26%—4.29%), 弧菌属Vibrio (0.21%—6.36%)等在内的13 个属类。
从表6 可知, 嵊泗海域厚壳贻贝养殖区和野生生长区属分类水平微生物丰度之间可观察到明显的规律, 总体上养殖区海域各类优势属微生物丰度大于野生生长区海域。
2.5 各海域微生物群落相似度分析
本文采用主成分(PCA)分析, 通过分析不同样品在图上的分散和聚集的情况, 根据离散程度可以了解不同样品的组成是否具有相似性(Jolliffe, 1986;Avershina et al, 2013)。从图 8 可知: 轴 1 (PC1)贡献值为72.72%, 轴2 (PC2)贡献值为13.13%, 总贡献值为85.85%。从整体上来看, 东极和嵊泗海域之间的微生物群落存在明显差异, 两个海域的野生生长区5 m 和10 m 之间的微生物群落相似度明显低于养殖区5 m和10 m 的微生物群落相似度, 而这种差异在嵊泗海域尤为明显。
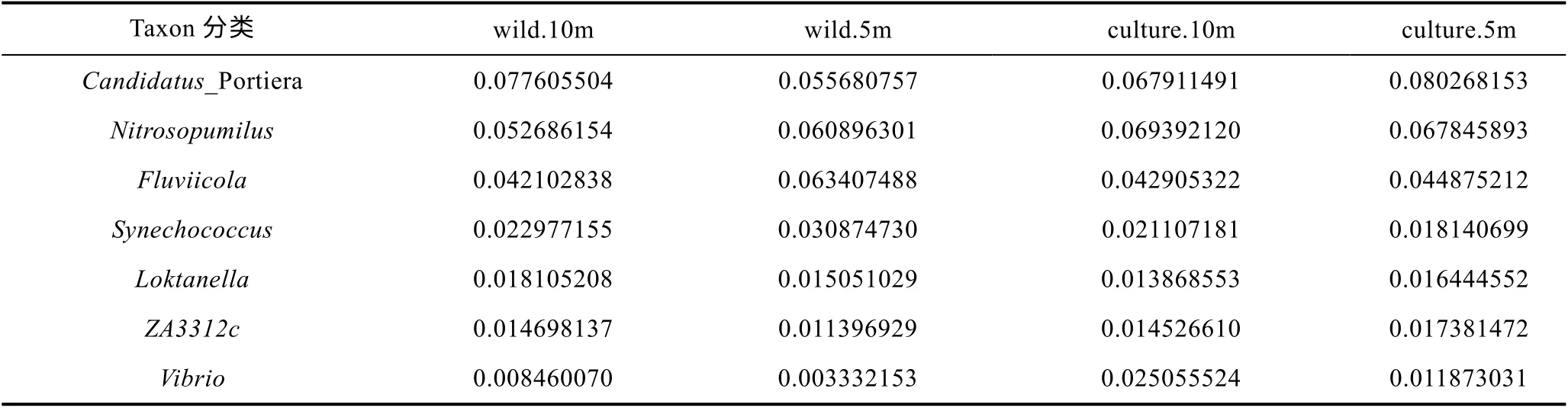
表5 东极海域微生物群落16S rRNA 扩增子测序属分类水平微生物群落结构表Tab.5 The community structure in genus level in the Dongji sea area

图7 嵊泗海域微生物属分类水平物种丰度柱状图Fig.7 The genus abundance in the Shengsi sea area

表6 嵊泗海域属分类水平微生物群落结构表Tab.6 The community structure in genus level in the Shengsi sea area

图8 各海域样品PCA 分析图Fig.8 The PCA analysis diagram of sea area samples
2.6 厚壳贻贝体内分离微生物组成分析
由表7 可知, 从厚壳贻贝的鳃、性腺、足、消化腺中均分离出微生物, 主要包括: 黏着杆菌属Tenacibaculum sp., 蜡样芽孢杆菌属 Bacillus cereus,红色杆菌属 Erythrobacter sp., 鲁杰氏菌属 Ruegeria sp., 弧菌属Vibrio sp., 巨型弧菌属Vibrio gigantis, 假交替单胞菌属Pseudoalteromonas 这7 类菌属。
结合上文图7 可发现, 在厚壳贻贝生长海域水体中检测分析得到的假交替单胞菌属 Pseudoalteromonas,黏着杆菌属 Tenacibaculum sp.以及弧菌属 Vibrio sp.均在厚壳贻贝体内组织中检测到, 且这三类菌属都出现于厚壳贻贝的鳃组织中。
3 讨论
3.1 厚壳贻贝养殖环境及其体内微生物群落多样性分析
嵊泗海域总体微生物丰富度大于东极海域。嵊泗海域不同采样点微生物丰富度由大到小分别为wild.10m > culture.10m > culture.5m > wild.5m, 其中嵊泗海域野生生长区 10 m 水深微生物丰富度最高,野生生长区5 m 水深微生物丰富度最低; 东极海域不同采样点微生物丰富度由大到小分别为 culture.10m> wild.10m > culture.5m > wild.5m, 东极海域养殖区10 m 水深微生物丰富度最高, 野生生长区10 m 水深微生物丰富度最低。

表7 厚壳贻贝体内分离微生物组成表Tab.7 The microbial composition inside the Mytilus coruscus
从属分类水平来看, 东极海域的优势微生物群落主要为厌氧氨氧化菌属 Candidatus_Portiera、海洋氨氧化古菌属 Nitrosopumilus、Fluviicola、蓝细菌聚球藻属 Synechococcus 以及弧菌属 Vibrio; 嵊泗海域的优势微生物群落主要为十八杆菌属 Octadecabacter、假交替单胞菌属 Pseudoalteromonas, 厌氧氨氧化菌属Candidatus_Portiera、ZA3312c、沉积物陆丹氏菌属Loktanella 以及弧菌属Vibrio。
总体上, 东极海域4 个取样点的微生物群落相似度比嵊泗海域高。由于受到厚壳贻贝长期选择性摄食的影响, 东极和嵊泗两个海域的野生生长区 5m 和10m 之间的微生物群落相似度明显低于养殖区5m 和10m 的微生物群落相似度, 且这种差异在嵊泗海域尤为明显。这可能是受嵊泗近海海域厚壳贻贝的大面积养殖的影响。从已有的文献中可知(王芳等, 1998; 刘绪博, 2011; 周曦杰, 2014), 包括贻贝在内的许多双壳贝类有着选择性滤食的习性, 即这些贝类会优先选择摄食水体中的一类浮游生物, 因而导致该区域水体中浮游生物种类相对单一, 相似度较高。相比于嵊泗海域, 东极海域4 个取样点的微生物群落相似度较高, 而东极近海海域厚壳贻贝的养殖规模远不如嵊泗海域大, 因此近海微生物群落受厚壳贻贝的摄食影响较小, 和野生生长区微生物群落相比, 相似度就更高。
Vezzulli 等人对位于意大利利古里亚海的地中海贻贝养殖场的水体微生物群落进行了分析, 发现弧菌属和假交替单胞菌属是该海域的主要优势微生物(Vezzulli et al, 2018), 这与本文嵊泗海域的主要优势微生物结果相一致。而东极海域也发现假交替单胞菌这一种优势微生物, 同时也间接印证了东极海域的微生物丰富度不如嵊泗海域。
在厚壳贻贝生长海域以及厚壳贻贝体内组织都鉴定到了假交替单胞菌属Pseudoalteromonas、黏着杆菌属Tenacibaculum sp.以及弧菌属Vibrio sp.这三类微生物, 初步推测厚壳贻贝和这些自然水域中存在的微生物产生了某种共生关系, 有报道说海洋双壳贝类会将某些环境中的细菌甚至是致病菌富集在鳃上,以此到达帮助宿主摄食消化、阻止其他病原体侵入的作用, 这也是贻贝不易染病的原因之一(Yu et al,2019)。相似的研究在紫贻贝中也有报道, 通过对土耳其伊兹密尔沿海生长的紫贻贝体内微生物进行宏基因组分析, 结果发现紫贻贝中也存在弧菌、变形杆菌、摩根氏菌等在内的34 种菌属(Bozcal et al, 2020)。
3.2 贻贝及其共生微生物的独特适应性
无论是厚壳贻贝生长海域, 还是其体内均分离鉴定到大量弧菌。而之前的报道显示在紫贻贝体内也大量存在弧菌(Bozcal et al, 2020)。其中弧菌是水产养殖中常见的致病菌, 在紫贻贝和厚壳贻贝体内都存在大量的弧菌, 说明贻贝对弧菌具有特殊的适应性,其特殊的适应机制和病原识别模式还有待于进一步研究。目前关于弧菌和宿主的共生已有一些研究, 例如有报道显示在海洋鱼类中, 弧菌会在进入宿主肠道系统后, 通过其VI 型分泌系统分泌一些效应分子,刺激宿主肠道产生收缩使得宿主肠道内原有的常驻菌群被迫排出, 最终弧菌在宿主肠道微生物群落中占据主导地位, 然而在这一肠道微生物群落更替变化中似乎并不会对宿主的健康产生损害, 弧菌本身似乎也不受肠道运动增强的影响(Logan et al, 2018); 而Vezzulli 等人认为贻贝体内的弧菌与其宿主经历了一段较为漫长的共同进化史(Vezzulli et al, 2018); Septer等人的研究表明, 夏威夷鱿鱼在孵化后的数个小时内就会被费氏弧菌所感染, 这种感染将逐渐演变成一种共生, 并且持续至宿主的一生, 而这种共生关系和夏威夷鱿鱼的发光器官有直接的联系(Septer, 2019)。
4 结论
总的来说, 目前对于海洋双壳贝类共生菌的报道尚比较匮乏, 其识别微生物的机理及共生机制还尚不完全明确, 本文从厚壳贻贝体内分离得到的微生物是否和厚壳贻贝发生了共生关系, 亦或是对厚壳贻贝的某些生理功能产生影响等问题, 还需进一步探索。

