基于核心素养发展的“构成物质的微粒”专题复习课
甘 磊
(江苏省徐州市第三十三中学 221000)
在2019年5月举行的徐州市初中化学评优课中,笔者执教的“‘构成物质的微粒’专题复习课”获得一致好评,并得了一等奖.下面,就再现本节课的教学过程.
一、设计思路
初三复习课,不是原有新授课的重复,也不同于原来一般的单元复习.因为学生已学完整个初中的内容,已有的知识含量、思维层次得到很大的长进,所以复习不能只是简单的机械回忆、不能只是知识提取.更重要的是在对有关知识进行重组的基础上提升学生核心素养的能力.基于学生核心素养的形成,让兴趣成为学习的动力,让问题激发思维的碰撞,让智慧在学习中生成,这些都是围绕学生这一核心展开,是笔者教学设计的出发点.基于这种理念,笔者大胆的对本节复习课进行全新的教学设计,取得了较好的效果.
兴趣是学习的动力,笔者首先做了演示实验“干冰升华”,该实验的视觉效果较好,能极大调动学生学习的兴趣.学生易于从宏观的角度判断“干冰升华”属于物理变化,并能设计实验方案进行验证.如何让学生从微观的角度判断物理变化呢,这是本节课的重点也是难点.笔者让学生在白板上先模拟干冰的微观示意图,然后,再模拟干冰升华后的微观示意图,通过前后对比,得出物理变化的微观实质是微粒本身不变,变化的是微粒间的空隙.用白板和磁扣来模拟既形象又易于理解.同时,也为化学变化的微观实质的探究做好铺垫.接着笔者做了演示实验“一氧化碳在空气中燃烧”,根据实验现象,学生很轻松的判断出“一氧化碳燃烧”属于化学变化.那化学变化的微观实质是什么呢?笔者让学生在白板上用磁扣模拟一氧化碳燃烧的微观示意图.因为前面物理变化的微观探究作为基础,学生很容易模拟一氧化碳燃烧的微观示意图.从而得出化学变化的微观实质是分子分成原子,原子重新构成新的分子.
在探究物理变化和化学变化的微观实质后,笔者又做了测糖水和食盐水导电性的演示实验,从而引出离子.笔者没有拘泥于教材的内容,而是将离子与酸、碱、盐在溶液中发生的复分解反应相联系,通过分组实验,让学生从微观角度判断复分解反应发生的条件.通过上述实验探究,让学生从不同视角认识构成物质的微粒,在潜移默化中培养学生宏观辨识和微观探析的核心素养.
二、教学实录
师:世界是由物质组成,物质在宏观上是由元素组成,在微观上是由什么微粒构成?
生:分子、原子和离子.
师:这节课我们共同探究构成物质的微粒.首先我们做个实验”干冰升华”.
演示:“干冰升华”实验(取两药匙干冰放在100ml的烧杯中).
师:同学们,你们看到了什么现象?
生:产生大量白雾.
师:为什么将干冰放在烧杯中会出现大量白雾呢?
生:干冰升华吸热,会使周围的水蒸气凝结成小水珠,就是我们看到的白雾.
师:回答的非常好.同学们,干冰升华属于什么变化?
生:物理变化
师:如何设计实验证明干冰升华属于物理变化呢?
生:小组讨论.
师:巡视倾听.
师:下面哪组同学给大家展示实验方案.
生1:将干冰升华后的气体通入澄清石灰水中,如果澄清石灰水变浑浊,说明升华后的气体依然是二氧化碳,并没有生成新物质,所以,属于物理变化.
生2:在上述的实验方案之外,还需要再补做一个实验,要先证明干冰也是二氧化碳,要将澄清石灰水加入到干冰到,如果石灰水变浑浊,则干冰是固体二氧化碳.升华前后没有生成新物质,所以,干冰升华属于物理变化.
师:下面我们通过实验来验证.
演示:先往试管中加少量干冰,然后倒入澄清石灰水中,再往收集好的二氧化碳的集气瓶中加入澄清石灰水(石灰水都变浑浊了).
师:通过实验,我们发现,干冰升华没有生成新物质,都是二氧化碳,所以是物理变化.
师:刚才,我们从宏观辨识的角度分析了干冰升华,那么大家能否试着从微观的角度来探析干冰升华呢?请同学们在白板上模拟干冰升华前和升华后的微观示意图.其中蓝色的磁扣代表碳原子,黄色磁扣代表氧原子.
生:在白板上模拟展示干冰升华前后的微观示意图.
师:巡视指导.
师:请每个小组展示你们的示意图,并试着解释白板上示意图的含义.
生:二氧化碳是由分子构成,一个二氧化碳分子由一个碳原子和两个氧原子构成.干冰升华前,二氧化碳分子间的空隙较小,升华后,变成了气体,二氧化碳分子间的空隙会变大.
师:说的非常棒.
师:通过干冰升华的微观解释,我们可以得到物理变化的微观实质是什么?
生:在物理变化中,微粒本身没有改变,改变的是微粒间的空隙和作用力.
师:说的很好,物理变化的实质就是,微粒本身没有改变,改变的是微粒间的空隙和作用力.微粒间的作用力,大家以后会继续学习,本节课就不再赘言.
过渡:物理变化的微观实质是微粒本身不变,变化的是微粒间的空隙.那么化学变化的实质又是什么呢?让我们继续探究,先来认识一种物质.瓶中装的是一氧化碳气体,它能使澄清石灰水变浑浊么?
生:不能.
师:现在倒入澄清石灰水.请大家仔细观察.
演示:往一氧化碳气体中倒入澄清石灰水.
师:澄清石灰水有没有变浑浊?
生:没有.
师:一氧化碳不能使石灰水变浑浊.现在点燃一氧化碳,请同学们仔细观察现象.
演示:一氧化碳在空气中燃烧.
师:你们看到了什么现象?
生:产生淡蓝色火焰.
师:集气瓶中的澄清石灰水有变化么?振荡一下.
生:石灰水变浑浊了.
师:根据实验现象,你们认为一氧化碳燃烧属于什么变化?
生:化学变化
师:你们判断的依据是什么?
生:生成了新物质二氧化碳.
师:请同学们在学案上写出一氧化碳燃烧的化学方程式.
过渡:刚才我们从宏观辨识的角度分析,一氧化碳燃烧属于化学变化,下面请大家试着用微粒的观点来分析.请同学们在白板上模拟一氧化碳燃烧反应前和反应后的微观示意图.其中蓝色的磁扣代表碳原子,黄色磁扣代表氧原子.
生:小组讨论.
师:巡视指导.
师:请每个小组展示你们的示意图,并试着解释示意图的含义.
生1:两个一氧化碳分子和一个氧气分子在点燃的条件下生成了两个二氧化碳分子;
生2:反应前后,碳原子和氧原子的个数不变;
生3:反应前后,碳原子和氧原子的种类不变;
生4:反应前后,碳原子和氧原子的质量不变;
生5:反应前后,碳元素和氧元素的种类不变.
师:同学们说的非常好,原子的种类、质量和个数在反应前后,没有改变,正好验证了质量守恒定律.同学们通过刚才的分析,你们能否说出,化学变化的微观实质是什么?
生:在化学变化中,构成物质的分子分解成原子,原子重新构成新的分子.
师:请同学们试着从宏观和微观两方面归纳物理变化和化学变化的区别是什么?
生1:宏观上,发生物理变化时没有生成新物质,发生化学变化时生成了新物质;
生2:微观上,发生物理变化时,构成物质的分子没有改变,改变的是分子间的空隙,发生化学变化时,分子要分成原子,原子构成新的分子.原子是化学变化中的最小微粒.
师:同学们说的很好.下面教师再为大家做个实验,测定蔗糖水和食盐水的导电性.请同学们仔细观察现象.
演示:将简易导电性装置的电极分别伸入蔗糖水和食盐水中.
师:同学们看到了什么现象?
生:伸入蔗糖水导电装置的灯泡没有亮,伸入食盐水导电装置的灯泡亮了.
师:同学们知道原因吗?
生:因为蔗糖是由分子构成,不能导电.食盐是由离子构成,食盐水中有自由移动的钠离子和氯离子,所以能导电.
师:非常棒.你能说出哪些物质是由离子构成的么?
生:氯化钠、氢氧化钠、硫酸铜、氯化钙和硝酸铵等.
师:这些由离子构成的物质相互之间都能发生反应么?
HCl NaOH Na2CO3BaCl2
生:分组讨论并连线.
师:请小组汇报结果.
师:连线的物质是否真的能发生反应呢?实验是检验真理的最高法庭,请大家进行分组实验进行验证.
分组实验:
①往滴有酚酞的氢氧化钠溶液中加入稀盐酸
②将氯化钡溶液加入到碳酸钠溶液中
③将稀盐酸滴加到碳酸钠溶液中
生:分组实验.
师:巡视指导,强调实验操作的规范性.
师:请各位汇报实验现象.
生:实验1的现象是红色消失;实验2的现象是产生大量白色沉淀;实验3的现象是产生大量气泡.
师:请同学们结合图1分析实验1中红色消失的原因.
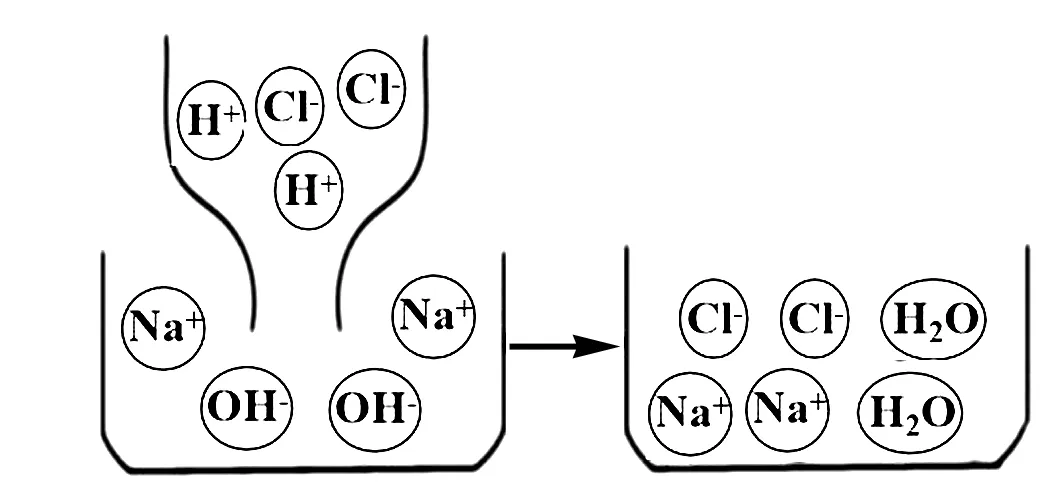
图1
生:使酚酞试液变红的是氢氧根离子,当加入稀盐酸之后,稀盐酸中的氢离子和氢氧化钠溶液中的氢氧根离子相互结合生成水,溶液中没有氢氧根离子,红色自然就消失了.
师:说的非常棒,请同学们结合图2继续分析实验2中产生白色沉淀的原因.

图2
生:氯化钡溶液中的钡离子和碳酸钠溶液中的碳酸根离子结合生成碳酸钡的白色沉淀.
师:观察的很仔细,说的也非常好.下面请同学们根据刚才的分析,继续探究
实验3中产生气泡的原因.
生:稀盐酸中的氢离子和碳酸钠溶液中的碳酸根离子结合生成碳酸,碳酸易分解,会生成二氧化碳,所以,我们能看到大量气泡.
师:刚才同学们的分析都非常到位.上述三个实验中的反应都属于什么基本反应类型?
生:复分解反应.
师:请同学们结合刚才的分析,试着总结出复分解反应的微观实质.
生:复分解反应的微观实质就是,离子间结合生成水或沉淀或气体.
师:请同学们根据刚才的分析,完成下图中的复分解反应离子网络图.
观察与思考:复分解反应离子网络图

生:氢氧根离子和铵根离子结合生成氨气和水,氢离子和碳酸根离子结合生成二氧化碳和水,碳酸根离子和钙离子结合生成碳酸钙白色沉淀,钡离子和硫酸根离子结合生成硫酸钡白色沉淀,银离子和氯离子结合生成氯化银白色沉淀.
师:说的非常好,这也是上述离子在溶液中不能共存的真正原因.
结课:今天这节课,我们通过实验探究从宏观和微观的角度探析了构成物质的微粒,希望同学们通过本节课的学习能在宏观辨识和微观探析的能力上有所提高.
三、教学反思
本节复习课,笔者针对于课本的原有知识结构进行了颠覆性的教学设计,让学生对复习课不再如同嚼蜡,让学生充满了期待.本节课充分利用化学实验为载体,让学生在实验中观察、思考,同时巧妙的利用白板和磁扣将微观和宏观结合起来逐一化解本节课的重难点.从而让学生深刻领会物理变化、化学变化和复分解反应的微观实质,较好的培养了学生的宏观辨识和微观探析的化学核心素养.
本节复习课的课堂实施始终围绕“立足于学而教,以致善学而不教”的教学理念.,到学生的自主探究活动,再到知识网络建立都是在学习小组的合作、讨论的基础上完成的.在快乐、愉悦的教学氛围下,学生的表现欲被激发,自豪感与成就感让学生成为了学习的主人,课堂的主体.充分培养了学生自主学习的意识和小组协作的精神.
在学生具体探究活动中,不足之处是对学生的指导还不够细致,还可以在课堂生成的应对上多下功夫.

