珍稀濒危物种双蕊兰根际土壤细菌多样性研究
周 强,孙冬伟,李海燕,岳 杰,陈旭辉,曲 波,张丽杰
(1.辽宁省林业发展服务中心,沈阳110031;2.抚顺市林业发展服务中心,辽宁 抚顺113006;3.辽宁老秃顶子国家级自然保护区抚顺管理站,辽宁 抚顺113208;4.沈阳市东陵公园管理中心, 沈阳110161;5.沈阳农业大学a.生物技术学院,b.林学院/辽宁省林木遗传育种与培育重点实验室, 沈阳110161)
兰科植物是被子植物分布最广范的科之一,全世界大约有736 属28000 种兰科植物,广泛分布于大部分陆地生态系统中[1-2]。我国野生兰科植物最为丰富,具有从原始兰科到高级兰科的一系列进化群以及复杂多样的地理分布类型[3]。兰科植物在系统演化上作为一类比较特殊的类群,已成为生物学的研究热点[4]。据现有资料表明,兰科植物多为珍稀濒危植物,全世界所有野生兰科植物均已列为《野生动植物濒危物种国际贸易公约》(CITES)的保护范围,兰科植物的保护也日趋受到国内外研究者的高度重视[5-7]。
双蕊兰(Diplandrorchis sinica)是兰科(Orchidaceae)双蕊兰属(Dipladrorchis)腐生小草本,为我国特有的单种属孓遗物种[8],是国家二级保护珍稀濒危植物[9]。 陈心启[8]提出双蕊兰属是一个极其原始和在系统发育上有重要意义的兰科新属。 何毅等[10]于2012 年和2013 年连续两年在秦岭和黄土高原对植被资源进行调查,首次发现该地区有双蕊兰变异种出现,丰富了对该珍稀濒危物种的认识。双蕊兰因其具有两枚生于蕊柱顶端腹背方向的能育雄蕊而得名。 植株具13~17 朵淡绿色或绿白色花;花瓣与唇瓣相似,花药宽卵状长圆形,柱头顶生,蕊喙不存在,其花被近辐射对称;花近直立几不扭转、柱头直立且无蕊喙等特征表明其应属于兰科鸟巢兰族中最为原始的类群之一[11]。 双蕊兰营腐生生活,对生长环境要求非常高,且生活周期短,仅20 余天[12-13]。 双蕊兰的分布区域极其狭窄,繁殖方式及传粉方式至今未知,极大地限制了双蕊兰的种群数量。 至今,双蕊兰濒危机制尚不清楚。 稀有和濒危植物的遗传学研究是国内外学者研究和讨论的热点[14]。 对稀有或濒危物种遗传多样性进行研究,有助于深层次了解物种进化历史及致濒机制,便于采取有效的科学措施进一步保护濒危物种,这也是保护生物学研究的核心[14-15]。物种遗传变异高低不仅仅与类群的分布范围有关而且也与类群的起源、进化历史、生殖特点、生物学特性以及环境条件等诸多因素有关[14-15]。因此,珍稀濒危植物致濒机制的研究就需要建立在对其物种本身遗传多样性和土壤生境微生物多样性充分了解的基础上,对珍稀濒危物种不仅要保护其种群数量,更要保护其遗传多样性和微生物多样性及进化潜力,这样才能有助于揭示物种濒危的内在机制。土壤微生物是生态系统的主要分解者,在改良土壤质量、促进养分循环过程中具有重要的作用[16]。 这些微生物中细菌作为主要组成菌种,以其对环境变化的敏感性和活跃性成为一个重要指示指标[17]。 土壤根际是一个特殊的生态系统,根际土壤易受植物根系的影响,是有益和有害微生物与宿主植物之间发生复杂相互作用的一个微小区域,在这个微小区域中蕴含着及其丰富的微生物资源[18]。 在这些微生物资源中,细菌则是根际土壤中数量最为丰富、种类最多的微生物类群,有些种类的细菌可以促进植物的生长发育,而有害微生物亦可抑制植物的正常生长发育[19-20]。近年来,很多学者运用微生物组学、蛋白质组学以及转录组学和Miseq 测序技术等分子生物学手段探索土壤微生物和植物生长之间的互作关系[19]。 因此,为探明环境中土壤细菌与双蕊兰生长的相互关系,以双蕊兰根际土壤为研究对象,基于Illumina Miseq 高通量测序技术对濒危双蕊兰根际土壤细菌16S rRNA 基因的V3~V4 区片段进行测序,拟从分子水平揭示双蕊兰根际土壤细菌群落多样性,以期为有效保护双蕊兰濒危植物资源提供科学借鉴和参考,并为进一步探讨双蕊兰的人工繁殖、仿生境栽培及濒危机制奠定研究基础。
1 材料与方法
1.1 土壤样品采集
土壤样品于2016 年8 月10 日采自辽宁省老秃顶子自然保护区抚顺管理局鸿雁护林防火站(124°41′13″~125°5′15″E,41°11′11″~41°21′34″N),在海拔500~632m 双蕊兰保护区内选取生长的3 株双蕊兰,以双蕊兰植株生长点为中心,取0~20cm 深度的土壤作为根区土壤。 根际土壤采用抖落法[21],先抖落根系上附着的大块土壤,然后轻轻抖落根系或用小镊子轻触附着在肉质根上的0~4mm 的土壤,收集起来为根际土。 将根际土装入无菌封口塑料袋中,置于冰盒中,带回实验室后立即将土壤样品进行混合,混匀后过筛去除杂质,均分为4 等份,分别标记为T1,T2,T3,T4。 样品置于-80℃冰箱内保存,供土壤微生物指标分析使用。
1.2 根际土壤基因组DNA 提取
使用MO BIO Power 土壤DNA 提取试剂盒提取根际土壤总DNA。 具体方法按照试剂盒说明书操作。 然后使用NanoDrop 分光光度计检查DNA 浓度和质量。 DNA 样品保存于-40°C 冰箱供后续试验使用。
1.3 PCR 扩增
以提取的双蕊兰根际土壤基因组DNA 为模板,进行PCR 扩增。 细菌16S rRNA 采用F515:5"-GTGCCAG CMGCCGCGG-3′和R909:5′-CCCCGYCAATTCMTTTRAGT-3′作为通用引物, 使用Miseq 测序仪扩增16S rRNA 基因的V4 高变区,进行焦磷酸测序[22-23]。 PCR 混合物反应体系为25μL,包含1x PCR 缓冲液,1.5mM Mg-Cl2,0.4μM 脱氧核苷三磷酸,1.0μM 引物,0.5U ExTaq(TaKaRa)和土壤基因组DNA10ng。 PCR 扩增程序包括初始变性。94℃3min,然后进行94℃40s,56℃60s 和72℃60s 30 个循环,最后72℃延伸10min。对每个样品进行两次PCR 反应, 使用1.0%琼脂糖凝胶对PCR 产物进行电泳。 使用DNA 凝胶提取试剂盒 (Sangon Biotech SK8132) 回收并纯化条带, 定量后将所有样品以等摩尔量混合制备测序样品。 应用于Illumina Miseq 系统Reagent Kit v22×250bp 进行测序。
1.4 数据处理及分析
通过高通量测序技术获得原始数据,借助于生物信息学软件进行序列拼接、过滤,最后获得高质量的Taqs 序列。 基于97%阈值对高质量序列进行分类单元聚类分析,并采用Mothur 软件对细菌群落多样性指数进行分析。
2 结果与分析
2.1 濒危双蕊兰根际土壤总DNA 提取
使用MO BIO Power 土壤DNA 提取试剂盒提取根际土壤总DNA。 并用分光光度计测定DNA 浓度和质量。 土壤总DNA 质量和浓度见表1。 由表1 可知,所获得的DNA 可以满足后续试验要求。
2.2 高通量测序数据分析
根据高通量测序数据,通过对双蕊兰根际土壤细菌16S rRNA 的V3~V4 可变区进行测序,共获得26690 条原始序列,有效序列26471 条。基于≥97%的相似度水平,利用QIIME 软件进行聚类分析,获得有效的OTUs 共9556 个(表2)。 使用稀疏曲线对双蕊兰根际土壤样品细菌的Alpha 多样性指数(香浓指数、Chao1 指数和辛普森指数)进行评估,结果表明,稀释曲线趋于饱和,证明此次测序的深度是合理的,继续测序不会再产生较多新的OTU(图1)。
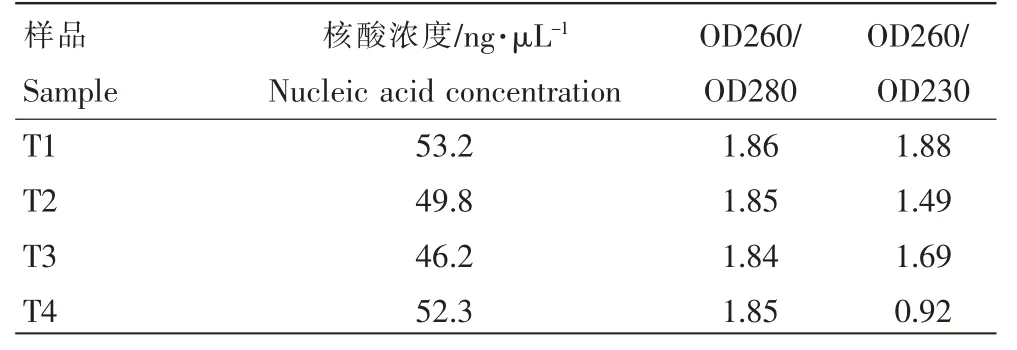
表1 双蕊兰根际土壤总DNA 质量和浓度Table 1 Total DNA quality and concentration in rhizosphere soil of Diplandrorchis sinica
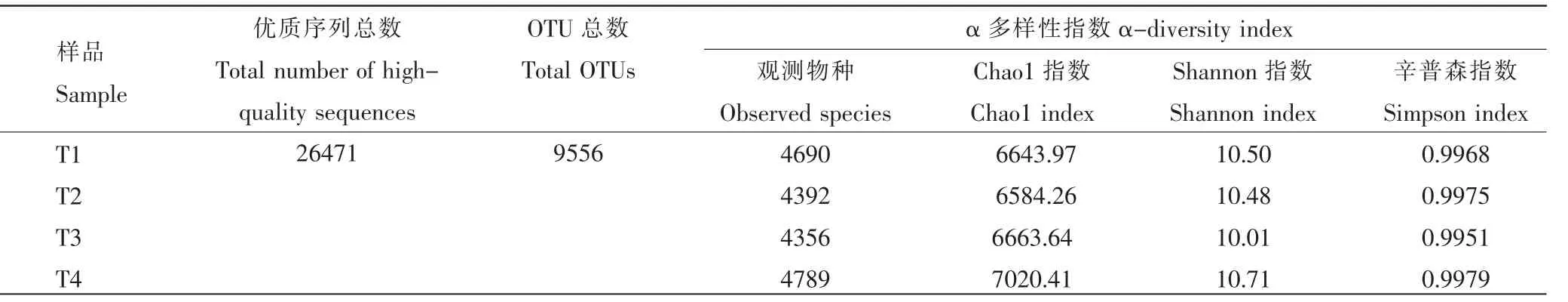
表2 双蕊兰根际土壤细菌微生物多样性指数Table 2 Soil sample sequence and α diversity index in rhizosphere of Diplandrorchis sinica
2.3 双蕊兰根际土壤细菌多样性
通过对双蕊兰根际土壤高通量测序分析,共获得9556 个OTUs,分属于33 门,108 纲,210 目,324 科,472属。 由图2a 可知,双蕊兰根际土壤中优势细菌类群分别为:变形菌门(Protecbacteria)占41.86%;为放线菌门(Actinbacteria)占19.93%;拟杆菌门(Bacteroidetes)占9.57%;酸杆菌门(Acidobacteria)占9.01%;疣微菌门(Verrucomicrobia)占7.67%;浮霉菌门(Planctomycetes)占3.81%;绿弯菌门(Chloroflexi)占2.73%;泉古菌门(Crenarchoeota)占1.92%;其他菌门占3.5%。
由图2b 可知,相对丰度在1%以上的15 个纲所占比例总和达到86.09%,分别为α-变形菌纲(Alphaproteobacteria) 占20.39%; 嗜热油菌纲(Thermoleophilia)9.76%;β-变形菌纲(Betaproteobacteria)占9.27%;γ-变形菌纲 (Gammaproteobacteria) 占8.13%; 疣微菌纲(Spartobacteria) 占7.43%; 拟杆菌纲 (Saprospirae)占5.67%;放线菌纲(Actinobacteria)占5.99%;鞘脂杆菌纲(Sphingobacteriia) 占2.35%;δ-变 形 菌 纲(Deltaproteobacteria) 占3.86%; 浮霉菌纲 (Planctomycetia)占3.06%;氯酸杆菌(Chloracidobacteria)纲占3.09%;酸微菌纲 (Acidimicrobiia) 占2.52%; 奇古菌纲(Thaumarchaeota)占1.90%;黄杆菌纲(Flavobacteriia)占1.21%,酸杆菌纲(Acidobacteria-6)占1.49%;其他菌纲占13.9%。
由图2c 可知,在相对丰度大于1%时的21 个目所占比例总数可以占77.40%。相对丰度占比较高的9 个目依次是根瘤菌目(Rhizobiales)占16.68%;盖勒氏菌目(Gaiellales)占7.01%;红杆菌目(Chthoniobaceterales)占7.43%;腐螺旋菌目(Saprospirales)占5.67%;放线菌目(Actinomycetales)占5.84%;鞘脂杆菌目(Sphingobacteriales)占2.35%;伯克氏菌目(Burkholderiales)占4.11%;假单胞菌目(Pseudomonadales)占4.63%;酸微菌目(Acidimicrobales)占2.52%;其他菌目占46.28%。
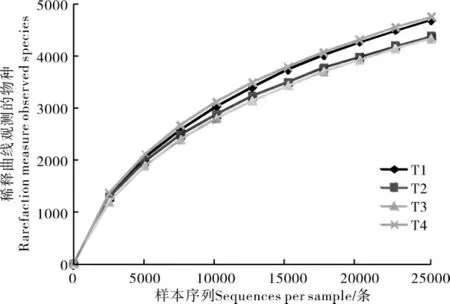
图1 双蕊兰根际土壤高通量测序稀释性曲线Figure 1 High-throughput sequencing of soil in rhizosphere of Diplandrorchis sinica
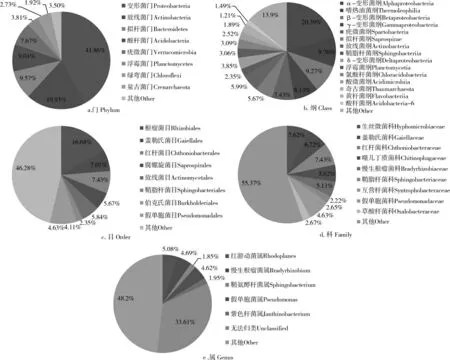
图2 濒危物种双蕊兰根际细菌群落丰度分析Figure 2 Abundance analysis of rhizosphere bacteria community of endangered species Diplandrorchis sinica
从细菌科水平划分,相对丰度大于1%的24 个科所占比例总数可达68.98%(图2d)。 丰度较高的优势菌科主要有8 个科,分别为生丝微菌科(Hyphomicrobiaceae)占7.62%;盖勒氏菌科(Gaiellaceae)占6.72%;红杆菌科(Chthoniobacteraceae)占7.43%;噬几丁质菌科(Chitinophagaceae)占5.62%;慢生根瘤菌科(Bradyrhizobiaceae)占5.11%;鞘脂杆菌科(Sphingobacteriaceae)占2.22%;互营杆菌科(Syntrophobacteracea)占2.65%;假单胞菌科(Pseudomonadaceae)占4.63%;草酸杆菌科(Oxalobacteraceae)占2.68%。 其他菌科占55.37%。
从细菌属的水平上(图2e)可知,相对丰度大于1%时的16 个属所占比例达到53.69%,相对丰度较大的有6 个属,依次为未分类的盖氏属(unclassified Gaiellaceae)占6.715%;红游动菌属(Rhodoplanes)占5.07%;慢生根瘤菌属(Bradyrhizobium)占4.69%;鞘氨醇杆菌属(Sphingobacterium)占4.69%;假单胞菌属(Pseudomonas)占4.62%;紫色杆菌属(Janthinobacterium)占1.95%;其他菌属占48%;还有一些无法归类的菌属占比为27.41%。
3 讨论与结论
双蕊兰为腐生小草本,依附群落主要是栎树、杨树和白桦树为主的天然混交林。 下层被压木主要有色木槭(A.mono Maxim.)、茶条槭(Ulmus pumila L.)、花曲柳(Fraxinus rhyncophylla)等,地被植物主要有忍冬(Lonicera japonica)、木贼(Equisetum hiemale L.)等。 双蕊兰主要生长在地被物稀少且坡度较缓的半阳坡山腹部。 这里土壤腐殖质层较厚并有枯落物覆盖[24]。 双蕊兰根际土壤pH 值可达到6.93,而非根际土壤pH 值仅为5.5,说明双蕊兰喜偏中性土壤生长,这可能也是影响双蕊兰生长的一个重要原因。 目前,关于兰科植物根际细菌多样性方面的研究较少,尤其针对濒临灭绝的单种属物种双蕊兰根际微生物多样性的研究尚未见报道。 本研究已初步获得双蕊兰根际土壤细菌在不同分类水平上的相对丰度及优势菌群。 这些优势细菌类群主要涵盖为八大类,其中变形菌门(Protecbacteria)是第一优势菌群,所占比例可达到41.87%;其次为放线菌门(Actinbacteria),占19.93%。 双蕊兰根际土壤细菌的优势菌属主要是红游动菌属、慢生根瘤菌属、鞘氨醇杆菌属、假单胞菌属、紫色杆菌属等。张剑等[25]通过研究大花杓兰根际土壤细菌多样性发现,其优势菌属为鞘氨醇单胞菌属、芽单胞菌属、慢生根瘤菌属、马赛菌属以及分枝杆菌属等,这与双蕊兰根际土壤细菌优势菌略有差异。 造成这种根际土壤细菌优势菌属差异显著的原因应该是与植物营养、土壤类型及植物所生长的环境和根系分泌物等因素有关。 已有的一些研究结果表明,慢生根瘤菌属、鞘氨醇杆菌属可以促进植物生长以及种子的萌发[25-26]。 国内很多学者也已从兰属(Cymbidium)、石斛属(Dendrobium)、斑叶兰属(Goodyera)等兰花品种内生细菌中分离鉴定出假单胞菌和芽孢杆菌为兰科植物的优势菌种[27-31]。 但是在双蕊兰根际土壤中存在的优势菌属是否也具有这些生物学功能,需要分离出双蕊兰根际土或肉质根中的相关菌株才能被证实。 另外,在濒危物种双蕊兰根际土壤中还存在大量的未确定分类地位的细菌,这些菌种资源还需充分挖掘和研究,才能从更深层次上揭示其濒危机制。在根际土壤微生物中,细菌有很多种类通过各种复杂的机制影响着植物的生长发育,直接或间接地改变着土壤结构及理化性质;同时,土壤中的一些病原菌产生的次生代谢产物影响着植物的生长和发育[32]。 植物在生长过程中利用根系从土壤中吸收水分及矿质营养满足自身生长[33-35],并通过根际向土壤中释放代谢产物影响土壤微生物群落多样性,通过各种途径影响根际土壤微环境。 因此,在土壤中,植物根际、微生物群落之间存在着重要的相互作用,在有限的生存空间中竞争着土壤微环境空间及营养资源。 目前,关于植物与土壤微生物之间的互相影响已愈来愈受到研究者的关注,但其互作的机理尚未深入研究,尤其是兰科植物。BEVER[36]研究发现,土壤微生物群落组成与森林植被类型关系密切,不同的植被类型影响着土壤微生物的组成和活性。 同一环境植被类型不同土壤微生物群落组成也会随着小环境的变化而不同,对于某一特定森林生态系统,环境因子稳定,土壤微生物数量和活性也会随着小环境的植被群落组成和结构而发生变化[35-36]。
本研究利用Illumina Miseq 高通量测序技术对珍稀濒危物种双蕊兰根际土壤细菌多样性进行初步研究,结果表明,濒危物种双蕊兰根际土壤细菌多样性较为丰富,在门、纲、目、科、属分类水平上双蕊兰根际土壤的优势细菌类群主要为变形菌门(Protecbacteria)、α-变形菌纲(Alphaproteobacteria)、根瘤菌目(Rhizobiales)、生丝微菌科(Hyphomicrobiaceae)和未被确定分类的盖氏菌属。 这些研究结果首次揭示了濒危物种双蕊兰根际土壤细菌群落的多样性,为进一步探讨双蕊兰及其与根际细菌的相互关系以及双蕊兰的繁殖及濒危机制奠定了研究基础。

