10 g·L-1聚维酮碘对大鼠眼表结构和泪膜稳定性的影响△
陈冬燕 王贺 张灿 郭建新 李明新
干眼是由多种因素引起的泪膜和眼表疾病,包括眼表不适症状、视力变化和泪膜不稳定,并常常伴有潜在的眼表损伤、泪液渗透压升高和眼表炎症[1-2],常见的症状有干涩、疲劳、瘙痒感、异物感、灼痛、畏光和对外界刺激的敏感性增加等。有时由于缺乏基础泪液,过度的眼干燥刺激反射性泪液分泌,导致频繁流泪,甚至出现眼红、充血和角质化。随着角膜上皮剥脱和炎症的发展,可导致角膜结膜化、鳞状上皮化生和新生血管长入,进而影响视力。
在过去十年中,玻璃体内注射药物成为治疗湿性老年性黄斑变性和糖尿病视网膜病变合并黄斑水肿等几种常见眼科疾病的首选方法[3-4]。这些患者往往需要频繁的玻璃体内给药操作,为减少感染性眼内炎的风险,每次注射前都必须对眼表进行无菌处理,目前国内外几乎所有的玻璃体内注药操作指南均推荐使用聚维酮碘进行手术区域的消毒[5-6]。然而我们前期研究表明,聚维酮碘本身会对角膜上皮细胞产生不利影响[7]。Saedon等[8]对玻璃体内注药后的患者进行流行病学研究结果显示,术前应用聚维酮碘会导致眼部不适、泪液渗透压增加及角膜荧光素染色阳性,提示出现类似干眼的临床表现。高频度的聚维酮碘使用是否会导致显著的眼表和泪膜稳定性损伤,以及这种损伤的严重程度尚未被深入研究。因此,本研究首次探讨了局部滴用10 g·L-1聚维酮碘对大鼠眼表结构和泪膜稳定性的影响,为临床反复使用聚维酮碘致患者眼表损害的预防和治疗提供科学依据。
1 材料与方法
1.1 实验动物选取30只SD雄性大鼠(SPF级,6~ 8周龄,体质量160~180 g,由徐州医科大学实验动物中心提供)。使用裂隙灯显微镜检查大鼠眼前节无异常。整个研究中30只大鼠均置于标准环境中饲养[9]:室温25 ℃±1 ℃,湿度60%±10%,以及交替的12 h明暗周期(早上8点到晚上8点)。本研究所涉及的全部研究方法均遵循《赫尔辛基宣言》,动物实验符合ARVO关于动物眼科和视觉研究的相关规定,同时获得了徐州医科大学实验动物伦理委员会的批准,批准号为XYFY201-KL033-07。
1.2 方法30只大鼠左眼作为对照眼为A组,右眼作为实验眼为B组。A组使用生理盐水滴眼,B组使用10 g·L-1聚维酮碘滴眼,均为每天2次。分别在干预前和干预后2 d、4 d、6 d、8 d、10 d、12 d、14 d 观察两组大鼠眼的泪膜破裂时间(BUT)、泪液分泌量、角膜荧光素染色评分和炎症指数评分,并于干预后14 d进行角膜共聚焦显微镜(HRTⅢ 德国海德堡公司)检查,随后腹腔注射过量水合氯醛处死大鼠,摘取眼球行组织病理学检查。
1.2.1 泪液分泌量检测所有大鼠均由同一操作者在相同时间(晚上9点)、相同地点、相同的照明强度和温度、湿度环境下测量大鼠基础泪液分泌量。固定大鼠头部后,将下眼睑轻轻拉下,露出结膜囊。将酚红棉线(天津晶明)弯曲5 mm至末端,并置于下睑中外1/3结膜囊处。15 s后,取出棉线,并测量泪液浸润的红色部分的长度。每眼重复测量3次取平均值。
1.2.2 BUT检测5 μL的1 g·L-1荧光素钠滴至大鼠结膜囊内,使其瞬目,瞬目后荧光素均匀涂布于角膜表面,在裂隙灯显微镜钴蓝光下观察角膜染色区出现第一个黑斑(破裂点)的时间,记录3次取平均值,即为BUT。
1.2.3 角膜荧光素染色评分参考Pauly等[10]报道的方法,在裂隙灯显微镜钴蓝光下观察各组大鼠角膜上皮缺损的位置及范围。角膜荧光素染色评分标准如下:0分:没有染色;1分:轻微的点状着染,少于30个点;2分:点状着染≥30个点,但没有成片;3分:严重弥漫性染色,但没有斑块;4分:有荧光素斑块。
1.2.4 炎症指数评分干预后不同时间点通过裂隙灯观察各组大鼠眼部炎症反应,并评估炎症指数,标准如下:睫状充血(0分:不存在;1分:小于1 mm;2分:1~2 mm;3分:大于2 mm);中央角膜水肿(0分:不存在;1分:存在可见的虹膜细节;2分:存在而没有可见的虹膜细节;3分:存在而无法窥见瞳孔);周围角膜水肿(0分:不存在;1分:可见虹膜细节;2分:虹膜细节不可见;3分:无法窥见虹膜),以上参数的得分之和除以9分即为炎症指数。
1.2.5 角膜共聚焦显微镜检查所有检查均由同一操作者进行。大鼠使用100 g·L-1水合氯醛按照2 mL·kg-1体质量腹腔注射麻醉。水浸式物镜表面加 2 g·L-1卡波姆眼用凝胶(美国BAUSCH &LOMB公司),一名操作者持大鼠头部使其固定于显微镜前,分开眼睑使角膜正对物镜中央,另一名操作者移动物镜使其与角膜中央接近,选择半自动扫描,待见至内皮层时按下记录键,则角膜各层的扫描图像被自动记录下来并存盘。使用软件自带的细胞计数模块手动对角膜内皮细胞密度进行分析。
1.2.6 组织病理学检查于干预14 d后腹腔注射过量水合氯醛处死所有大鼠,摘除双眼眼球,40 g·L-1多聚甲醛固定过夜,常规石蜡包埋、切片行组织病理学检查:所有结膜均行PAS染色观察杯状细胞数量及形态;随机选取两组各4只角膜行HE染色观察各层组织结构,两组剩余角膜均行PMN/ED1双重免疫组织化学染色观察中性粒细胞/巨噬细胞在组织层间的浸润情况。PMN/ED1双重免疫组织化学染色参照文献[11] 进行,角膜组织切片常规脱蜡至水,体积分数10%血清封闭1 h,随后与PMN一抗(14000,Fitzgerald公司,英国)、ED1一抗(1200,AbD Serotec公司,英国)一起孵育,使用不含任何一抗的PBS作为阴性对照。4 ℃湿房中过夜。将样品置于常温下复温20 min后,倾去一抗,PBS浸洗3次,随后加入碱性磷酸酶免疫复合物二抗(1500,Fitzgerald公司,英国)孵育2 h,倾去二抗,PBS浸洗3次,每次5 min。加AP-Fast Red工作液,显微镜下观察,当出现明显的红色显色反应时,PBS冲洗终止显色反应,随后加入过氧化物酶免疫复合物二抗(1500,Fitzgerald公司,英国)孵育2 h,倾去二抗,PBS浸洗3次,每次5 min。加DAB工作液,显微镜下观察,当出现明显的棕色反应时,PBS冲洗终止显色反应。使用封片液(甘油与PBS等容积混合)封片,显微照相系统下观察,并拍照储存。
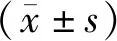
2 结果
2.1 裂隙灯检查及角膜荧光素染色结果裂隙灯检查结果显示,A组使用生理盐水滴眼14 d后,角膜透明、上皮完整,荧光素染色阴性;B组使用10 g·L-1聚维酮碘滴眼14 d后,角膜欠透明、上皮粗糙,荧光素染色阳性,呈点片状着染(图1)。

图1 两组大鼠裂隙灯检查及角膜荧光素染色结果
2.2 各评价指标检测结果
2.2.1 BUT干预前,A组与B组间BUT相比差异无统计学意义(P>0.05)。干预后2 d,B组即可观察到BUT缩短,且随时间延长,B组BUT降低趋势更加明显。干预后6 d、8 d、10 d、12 d、14 d,A、B两组间BUT相比差异均有统计学意义(均为P<0.05)(见图2A)。
2.2.2 泪液分泌量A组与B组干预前和干预后2 d、4 d泪液分泌量相比差异均无统计学意义(均为P>0.05),B组干预后泪液分泌量较干预前明显减少。干预后6 d、8 d、10 d、12 d、14 d,A、B两组间泪液分泌量相比差异均有统计学意义(均为P<0.05)(见图2B)。
2.2.3 角膜荧光素染色评分A组干预前及干预后不同时间点角膜荧光素染色均为阴性。B组干预前角膜荧光素染色阴性,但干预后2 d即可观察到角膜点状着染,随时间延长,B组角膜荧光素着染区域逐渐增加,并融合成片,提示较为严重的角膜上皮损伤。干预后不同时间点A、B两组间角膜荧光素染色评分差异均有统计学意义(均为P<0.05) (见图2C)。
2.2.4 炎症指数与A组相比,B组在干预后不同时间点的眼部炎症指数均显著增加,差异均有统计学意义(均为P<0.05)(见图2D)。B组以睫状充血为主,在干预后期甚至出现轻度的角膜水肿,可能与角膜上皮损伤和炎症细胞浸润有关,提示聚维酮碘局部滴眼可导致角结膜组织的炎症反应。

图2 两组大鼠不同时间点各临床指标的对比 A:BUT;B:泪液分泌量;C:角膜荧光素染色评分;D:炎症指数。注:与A组相比,*P<0.05。
2.3 角膜共聚焦显微镜检查共聚焦显微镜下观察显示,与A组相比,B组角膜上皮层可见少量高反光炎症细胞浸润,基质层亦可见炎症细胞聚集,基质细胞数量增多,提示可能出现基质细胞活化;两组角膜内皮细胞数量及形态大致相同(图3)。

图3 共聚焦显微镜观察两组角膜组织结构及细胞形态(×800)
2.4 组织病理学检查结果角膜HE染色结果显示,A组角膜上皮由排列整齐的4~6层上皮细胞构成;B组角膜上皮细胞层数增多,上皮厚度增加,基底细胞呈现“空泡样”结构,角膜厚度稍有增加,角膜表面欠光滑。结膜PAS染色结果显示,与A组相比,B组PAS染色阳性细胞数量显著降低,结膜上皮增厚,细胞层数增加,提示聚维酮碘局部滴眼可影响黏蛋白的合成与分泌,结膜杯状细胞数量显著降低。PMN/ED1双重免疫组织化学染色结果显示,A组无PMN/ED1染色阳性细胞;而B组角膜上皮细胞层间可见少量PMN染色阳性细胞,基质层,尤其是浅层基质,可见大量PMN/ED1染色阳性细胞,提示聚维酮碘局部滴眼可诱导炎症细胞聚集,导致明显的角膜炎症反应(图4)。

图4 两组组织病理学检查结果
3 讨论
近年来流行病学调查结果显示,随着生活习惯和工作环境的改变,人们干眼的患病率逐年升高,全球各年龄段的患病率为5%~35%[12]。干眼的病因众多,发病机制尚未完全明确,建立理想、稳定的动物模型是研究干眼病理生理变化进而指导临床治疗的基础。现有的干眼动物模型主要包括泪腺摘除[13]、降低周围环境湿度[14]、使用阿托品类药物[15]、局部滴用苯扎氯铵[16]或大气颗粒物[17]等,然而,人类干眼的病理变化并没有被精确再现,尤其缺乏符合临床特征的干眼动物模型。本研究使用10 g·L-1聚维酮碘成功诱导了蒸发过强型干眼模型,该模型制作简便、性质稳定,可作为研究眼表炎症的理想平台。
聚维酮碘是临床上使用最为广泛的皮肤黏膜消毒剂之一[18]。为了预防眼内炎的发生,晶状体超声乳化术、玻璃体切割术、青光眼滤过性手术等内眼手术术前均常规使用聚维酮碘消毒[19],尤其是玻璃体内注射抗VEGF药物前使用聚维酮碘进行结膜囊消毒已被写入多部指南和专家共识。一项使用浓度为6 g·L-1聚维酮碘局部滴眼治疗腺病毒性结膜炎的临床研究顺利通过Ⅱ期临床试验[20]。可见,聚维酮碘的广谱抗菌性和安全性得到了大多数临床医师的认可。然而,多篇临床报道指出,聚维酮碘本身具有眼表毒性,局部滴用聚维酮碘有引起结膜充血、角膜上皮剥脱甚至角膜炎的危险[21-22]。蒋劲等[23]观察使用不同浓度聚维酮碘兔结膜囊内一次滴眼对角膜的影响,发现低浓度(5 g·L-1)聚维酮碘未出现角膜毒性,而聚维酮碘原液(50 g·L-1)可引起严重的角膜上皮损伤并产生较重的角膜刺激症状。Lee等[24]采用国际通用的检测某种化学物质是否会导致角膜损伤的方法——牛角膜混浊和通透性实验,通过配置不同浓度的溶液处理牛角膜以评价聚维酮碘的安全性,结果发现,聚维酮碘对角膜组织的损伤随浓度增加而加剧,浓度为10 g·L-1的聚维酮碘使用后,角膜荧光素染色评分几乎与阳性对照(纯丙酮)相当。反复多次使用聚维酮碘(尤其是多次玻璃体内注射时)导致的眼表不良反应近年来越来越多地引起临床工作者的重视,眼表损伤的严重程度、药物剂量与损伤的关系、脱离接触后损伤能否完全恢复等一系列问题有待于进一步研究。
有关聚维酮碘所致眼表改变的病理生理机制目前知之甚少。Shibata等[25]观察聚维酮碘对培养的角膜上皮细胞的影响,提出聚维酮碘引起角膜上皮细胞损伤的主要原因在于游离碘的直接损伤、溶液中的低pH值以及聚桂醇表面活性剂的细胞毒性。我们在前期研究中[7]使用不同浓度聚维酮碘结膜囊内一次滴眼观察对大鼠角膜的影响,滴眼后12 h摘出眼球行组织病理学检查,发现浓度为10 g·L-1的聚维酮碘处理组的角膜出现少量上皮细胞脱落;浓度为50 g·L-1的聚维酮碘处理组的中央角膜上皮细胞全层缺失,基质细胞数量明显下降,TUNEL检测提示角膜上皮细胞和基质细胞凋亡,提示细胞凋亡可能在聚维酮碘所致眼表损伤中发挥作用。本研究使用10 g·L-1聚维酮碘局部滴眼建立干眼模型,角膜共聚焦显微镜检查及角膜组织切片均发现炎症细胞浸润,提示炎症可能在聚维酮碘引起的眼表损伤中发挥重要作用。炎症与干眼互为因果,相互促进,炎症细胞浸润通常是眼表损伤的关键环节,可能导致角膜上皮细胞凋亡以及鳞状上皮化生[26],慢性或严重炎症也可能降低杯状细胞的数量,这会恶化聚维酮碘诱导的眼表损伤,包括角膜染色评分增加和结膜PAS染色阳性的杯状细胞数量减少。干眼的发病机制复杂,多种炎症细胞和炎症因子在干眼的发生发展中发挥不同的作用,我们接下来进行的分子生物学研究将为揭示模型的具体病理生理机制提供有力的支持。
我们前期研究(5 g·L-1聚维酮碘结膜囊滴眼,一天2次,共滴眼14 d)发现,低浓度的聚维酮碘不会引起明显的泪膜稳定性变化,而临床常用的聚维酮碘原液(浓度为50 g·L-1)对角膜组织刺激性太大,预实验结果显示每天2次滴眼后SD大鼠角膜很快出现上皮剥脱和水肿,滴眼3 d后即可观察到角膜新生血管长入。因此,本研究我们选择10 g·L-1作为聚维酮碘的最佳滴眼液浓度诱发干眼。在将来的眼表毒性研究中,研究不同浓度聚维酮碘引起的眼表改变将是有趣的课题。除此之外,干眼是一个复杂的过程,泪膜稳态的失衡往往是多重因素共同作用的结果,在聚维酮碘诱导的干眼模型中,是否有氧化应激、细胞自噬、神经损伤等机制参与尚不得而知,需要更深入的研究加以探索。
综上所述,10 g·L-1聚维酮碘局部滴眼可引起实验大鼠眼表结构损伤和泪膜稳定性下降,聚维酮碘的眼表毒性有必要引起临床医师的高度重视。另外,我们通过10 g·L-1聚维酮碘局部滴眼成功诱导了蒸发过强型干眼模型,为研究干眼的病理生理学特点、发病机制和治疗提供了简便易行且稳定的造模方式,具有较强的理论和现实意义。

