尾静脉注射碘酸钠对小鼠视网膜形态结构变化的影响△
牛占宇 李建德 石永鹏 陈临池 杨鹏飞 田换兵 高岚
老年性黄斑病变(SMD)是世界范围内60岁以上老年人致盲的首要原因,明确SMD的发病过程和病理机制是进行有效治疗的关键。碘酸钠(NaIO3)是一种可以对视网膜色素上皮(RPE)细胞造成选择性损伤的稳定氧化剂[1],在多种哺乳动物中能诱发氧化应激反应产生视网膜毒性,包括猴、绵羊、猪、兔、大鼠、小鼠[2-3]。由于NaIO3诱导的视网膜变性过程与非渗出性SMD患者病变过程相似,因此NaIO3诱导视网膜变性常作为非渗出性SMD的动物模型[4-5]。尽管已有不少基于小鼠SMD模型的研究,但是对于NaIO3诱导的小鼠SMD模型视网膜形态结构随时间变化的研究较少。因此,本研究旨在于评估尾静脉单剂量注射NaIO3(35 mg·kg-1)后不同时间小鼠视网膜形态结构的损伤程度,以期为NaIO3诱导SMD动物模型的研究提供一定的理论支持。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组选取6~8周龄健康昆明小鼠36只,体质量25~30 g,雌性(兰州大学实验动物中心提供),饲养于符合医学实验动物要求的环境中。将小鼠分为对照组、损伤3 d组、损伤7 d组、损伤14 d组,每组9只小鼠,3只用于石蜡切片,3只用于冰冻切片,3只用于视网膜铺片。对照组不作任何处理,各损伤组小鼠经尾静脉单剂量注射NaIO3,分别于损伤后3 d、7 d、14 d取材。实验过程中无小鼠死亡,所有动物实验均符合医学动物实验伦理规定。
1.1.2 主要仪器与试剂石蜡切片机、冰冻切片机(德国Leaca公司),烤片机(天津天利航空机电有限公司),荧光显微镜(日本Olympus公司),体式显微镜(德国Zeiss公司)。NeuN抗兔多克隆抗体、Opn1mw抗兔多克隆抗体(北京博奥森生物技术有限公司),GFAP抗兔多克隆抗体(武汉博士德生物公司),Iba1抗兔多克隆抗体(英国Abcom公司),594标记的山羊抗兔二抗、兔SP试剂盒(北京中杉金桥生物技术有限公司),DAPI染色液、DAB显色试剂盒(北京索莱宝科技有限公司),NaIO3(美国Sigma公司)。
1.2 方法
1.2.1 动物模型建立称取0.07 g NaIO3溶于PBS中,配制成终浓度为70 g·L-1溶液。按5 μL·g-1(35 mg·kg-1)体质量尾静脉单剂量注射到小鼠体内,建立视网膜变性模型。将处理后的小鼠在干净、安静的环境中饲养。
1.2.2 取材分别于NaIO3注射后3 d、7 d、14 d取材,将小鼠用50 g·L-1水合氯醛深度麻醉,四肢伸直、腹部朝上固定于解剖盘,剪开胸腔暴露心脏,剪破右心耳,注射器吸取20 mL PBS从左心室进针冲洗血液,随后立即从同一位置注入40 g·L-1多聚甲醛20 mL,待小鼠全身僵硬后即完成心脏灌注。小心摘取双侧眼球,PBS中清洗后置于40 g·L-1多聚甲醛中于4 ℃固定24 h。
1.2.3 视网膜组织切片行HE染色将固定24 h的眼球在PBS中室温浸洗30 min,行梯度乙醇脱水、二甲苯透明、浸蜡、石蜡包埋过夜,做厚6 μm石蜡切片,40 ℃烤片机烘烤6 h,进行HE染色,中性树胶封片。每组随机选取6张切片,400倍光学显微镜下每张切片随机选取3个视野拍照,图像用Image J软件处理,统计视网膜组织每10 μm长度外核层(ONL)、内核层(INL)中细胞数。
1.2.4 视网膜组织切片NeuN免疫组织化学染色将固定24 h的眼球在PBS中室温浸洗30 min,行梯度蔗糖脱水,300 g·L-1蔗糖4 ℃脱水过夜,OCT包埋,做厚10 μm冰冻切片,室温自然干燥后于-20 ℃保存。将冻存的组织切片取出,室温复温30 min,按兔SP试剂盒说明书进行操作,DAB显色,苏木精复染,中性树胶封片。每组随机选取6张切片,400倍光学显微镜下每张切片随机选取3个视野拍照,图像用Image J软件处理,统计视网膜组织每100 μm长度视网膜神经节细胞(RGC)数。
1.2.5 视网膜组织铺片GFAP免疫荧光染色将固定过夜的眼球于体式显微镜下小心剥离视网膜组织,于96孔板中PBS浸洗30 min;体积分数0.3% Trition X-100通透30 min;体积分数10%山羊血清封闭1 h;加一抗(GFAP)4 ℃孵育过夜,室温复温30 min;加二抗室温避光孵育1 h,将视网膜组织置载玻片上,神经纤维层朝上平铺,向中心处剪4~5个切口,后用甘油PBS封片。每个视网膜组织在距视盘500 μm处选取3个视野拍照,图像用Image J软件处理并统计每200 μm×200 μm范围内被激活的Müller细胞数。
1.2.6 视网膜组织切片Opn1mw、Iba1免疫荧光染色将冻存的冰冻切片取出,室温复温30 min,体积分数0.3% Trition X-100通透20 min;体积分数10%山羊血清封闭40 min;加一抗(Opn1mw、Iba1)4 ℃孵育过夜,室温复温30 min;滴加二抗室温避光孵育1 h,DAPI室温避光复染8 min,甘油PBS封片。每组随机选取3张切片,200倍光学显微镜下观察拍照。图像用Image J软件处理,观察视锥细胞外节段厚度和小胶质细胞数。
1.3 统计学分析本研究数据应用SPSS 24.0软件进行分析,数据以均数±标准差表示,采用单因素方差分析和独立样本t检验进行组间比较。检验水准:α=0.05。
2 结果
2.1 NaIO3对视网膜形态学变化的影响对照组小鼠视网膜RPE层、光感受器细胞外节段、ONL、INL、神经节细胞层(GCL)形态结构完整、边界清晰,细胞排列密集;各损伤组中NaIO3注射不同时间后小鼠视网膜各层结构发生不同程度的变化,其中损伤7 d组、损伤14 d组小鼠视网膜ONL、INL厚度变薄,细胞数显著减少,结构出现波浪状,且与外网状层(OPL)边界模糊(图1)。

图1 各组小鼠视网膜HE染色结果(×400,标尺为50 μm) A:对照组;B:损伤3 d组;C:损伤7 d组;D:损伤14 d组。
损伤3 d组、损伤7 d组、损伤14 d组小鼠视网膜中ONL细胞数均低于对照组,损伤7 d组、损伤14 d组INL细胞数均低于对照组差异均有统计学意义(均为P<0.05)(见表1)。

表1 各组视网膜中ONL、INL、GCL各层细胞数比较
2.2 NaIO3对RGC数的影响NeuN作为神经元标记物,在本实验中用来标记GCL中的RGC。与对照组相比,损伤3 d组和损伤7 d组GCL中RGC数差异均无统计学意义(均为P>0.05),损伤14 d组小鼠每100 μm长度GCL中RGC数减少,差异有统计学意义(P<0.01)(见表1和图2)。

图2 各组小鼠视网膜NeuN染色结果(×400,标尺为50 μm) A:对照组;B:损伤3 d组;C:损伤7 d组;D:损伤14 d组。
2.3 NaIO3对Müller细胞活化的影响GFAP的表达在视网膜中可作为检测Müller细胞活化的指标,故在本实验中用GFAP抗体来标记Müller细胞。与对照组相比,NaIO3损伤组中每200 μm×200 μm 范围内Müller细胞激活数量均有所增加(图3)。损伤3 d组、损伤7 d组、损伤14 d组Müller细胞激活数量由对照组的(16.96±0.85)个分别增加至(20.42±1.64)个、(24.73±1.91)个、(30.04±3.76)个,与对照组相比差异均有统计学意义(均为P<0.05)。
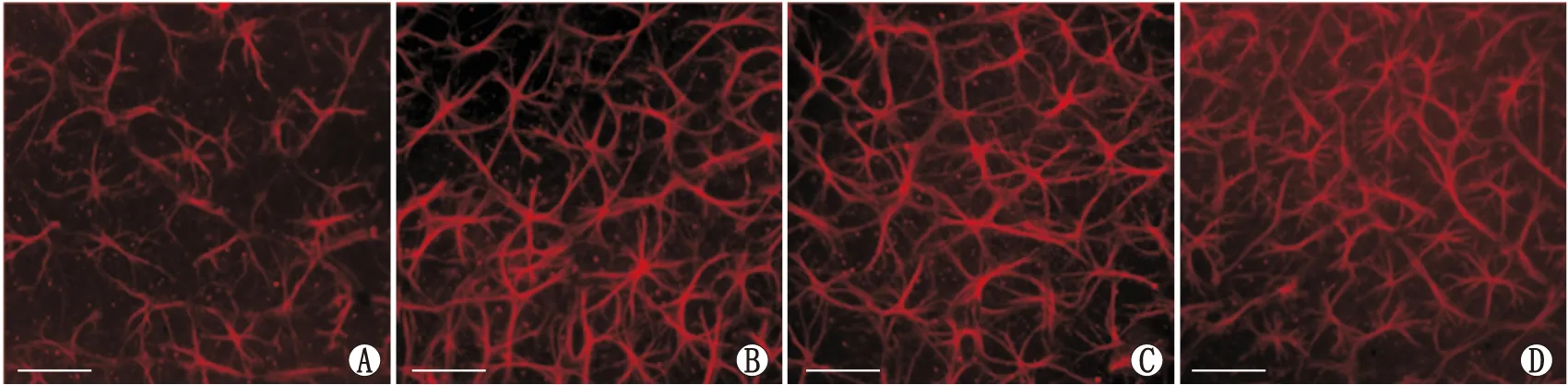
图3 各组小鼠视网膜GFAP免疫荧光染色结果(×200,标尺为50 μm) A:对照组;B:损伤3 d组;C:损伤7 d组;D:损伤14 d组。
2.4 NaIO3对小鼠视网膜中视锥细胞和小胶质细胞的影响本实验中Opn1mw抗体和Iba1抗体分别特异性标记视网膜中视锥细胞外节段和小胶质细胞。对照组小鼠视网膜中视锥细胞外节段整齐排列成束状,经NaIO3损伤后随着损伤时间延长,外节段排列逐渐紊乱,且外节段厚度与对照组相比明显变薄。
对照组中Iba1阳性细胞主要分布于GCL、INL,经NaIO3损伤后Iba1阳性细胞分布于整个视网膜,数量较对照组有所增加,且呈现出一种胞体增大、分支减少的“阿米巴”状形态(图4)。

图4 各组小鼠视网膜Opn1mw、Iba1染色结果(×200,标尺为50 μm) A、E:对照组;B、F:损伤3 d组;C、G:损伤7 d组;D、H:损伤14 d组。A 、B、C、D为Opn1mw染色结果;E、F、G、H为Iba1染色结果。
3 讨论
NaIO3作为一种稳定的强氧化剂,当小鼠体内注射剂量最低为20 mg·kg-1时,诱导视网膜产生氧化应激反应,氧自由基(ROS)、丙二醛(MDA)以及氧化应激相关蛋白Hmox1表达升高,超氧化物歧化酶(SOD)表达降低[2,6],并且引起RPE细胞坏死[2,7],致使脉络膜毛细血管萎缩[8]及全视网膜变性[9-10]。NaIO3引起的视网膜变性模型已被多次报道[11-13],并用于神经损伤方面治疗的评估[14-15],高剂量的NaIO3(30~100 mg·kg-1)诱导视网膜变性的主要原因是氧化应激[2],在2~12 h 内引起RPE细胞发生碎片化和细胞核丢失[10,16],随后对感光细胞外节段产生影响[9],但因细胞毒性发生太快,无法明确识别视网膜损伤的机制[2]。根据不同的研究目的,NaIO3的给药方式、浓度和损伤时间也不一致,在本实验中采取尾静脉单剂量注射的方式,浓度为35 mg·kg-1[17],损伤时间梯度为3 d、7 d、14 d,来研究NaIO3对视网膜形态结构的影响。本研究发现,经NaIO3处理后,小鼠视网膜结构发生明显的改变,与对照组对比,各损伤组中RPE结构被破坏,视网膜光感受器细胞外节段受损,ONL、INL呈现出波浪状的结构改变、厚度变薄,并且各层边界模糊,细胞排列散乱,且这种损伤具有时间依赖性;研究结果还显示,NaIO3作用后,ONL、INL每10 μm长度细胞总数具有显著的下降趋势,该结果与之前的研究结果一致[2,18]。
视杆细胞和视锥细胞作为视网膜输入的第一级神经元,对视功能具有非常重要的作用。RPE细胞顶部的微绒毛紧密包裹着视杆细胞和视锥细胞的外节,故注射高剂量NaIO3会引起RPE细胞、视杆细胞和视锥细胞的退化,最终致使ONL和RPE层完全融合[19]。NaIO3在小鼠体内所引发的氧化应激反应造成光感受器细胞中光传导基因表达量下降以及光感受器细胞外节段受损[2,20]。在本研究中,用Opn1mw抗体特异性标记视锥细胞外节段,采用免疫荧光染色技术即可以观察视锥细胞外节段损伤情况。本研究结果显示,对照组中由Opn1mw抗体所标记的细胞结构呈束状有规律排列,结构完整,经NaIO3作用后,随作用时间延长阳性信号区域面积逐渐减少、排列混乱且结合HE染色结果可知,视锥细胞外节段长度减少。说明NaIO3能引起视锥细胞结构损伤,且损伤程度具有时间依赖性。
RGC是视网膜中能唯一产生动作电位的神经元,其轴突形成视神经将视觉信号从视网膜传到大脑[21]。视网膜在缺氧缺血的情况下所诱发的氧化应激会损伤RGC甚至引起其凋亡[22]。NeuN作为神经元标记物可用来标记视网膜GCL中RGC。本研究采用NeuN免疫组织化学染色的方式来观察视网膜中RGC数的变化,结果显示,对照组中GCL细胞排列密集;经NaIO3作用后,GCL细胞排列紊乱,其中NaIO3作用14 d 后,RGC数目减少且与对照组相比有显著性差异,说明在体内环境下NaIO3会诱发RGC损伤。
Müller细胞作为视网膜中特有的一种星形胶质细胞,在视网膜发育、稳态维持、营养支持等方面发挥重要作用[23]。视网膜处于病理状态时会激活Müller细胞,使其发生反应性胶质化,激活后的Müller细胞会大量表达GFAP,因此可用GFAP抗体染色来检测Müller细胞的激活量,从而反映视网膜损伤程度。本研究中,通过视网膜铺片GFAP免疫荧光染色对Müller细胞的反应性胶质化程度进行评估。对视网膜每200 μm × 200 μm 范围内GFAP阳性细胞进行计数,结果显示,与对照组比较,NaIO3作用后单位面积内GFAP阳性细胞数量增加,说明NaIO3能激活Müller细胞。小胶质细胞作为脑和视网膜的免疫监视器,当组织受损后其可通过改变自身形态转化为吞噬细胞而响应组织损伤。利用Iba1可对小胶质细胞进行特异性染色,本研究发现,NaIO3作用后Iba1阳性细胞增多,且细胞形态发生改变,表现出胞体增大、分支减少的“阿米巴”状,说明NaIO3作用后能激活小胶质细胞。
综上所述,本研究结果表明,小鼠尾静脉单剂量注射NaIO3会引起小鼠视网膜ONL、INL、GCL的细胞数减少,同时激活Müller细胞胶质化反应和小胶质细胞,且NaIO3对视网膜的损伤具有时间依赖性。本研究以期为NaIO3诱导SMD动物模型的研究提供更多的实验数据与支持。

