非酒精性脂肪肝病小鼠模型的研究进展
蔡宗余,李 政
(广东药科大学 药学院,广东 广州 510006)
0 引言
非酒精性脂肪肝病(Nonalcoholic fatty liver disease,NAFLD)是一种严重危害人类健康的慢性代谢性疾病。据流行病学研究表明,目前全球已有超过25%的成年人患有NAFLD[1]。近年来,随着人们生活方式和饮食习惯的改变,肥胖和2型糖尿病的发生率随之升高,二者与NAFLD发生密切相关。NAFLD的发病率呈持续增高趋势,成为许多国家和地区常见的慢性肝脏疾病之一[2]。NAFLD是出现于非嗜酒的患者一种综合征,其主要特点表现为肝细胞内脂肪过度堆积,导致肝细胞大泡性脂肪性变,带来一系列恶化,包括脂肪性肝炎、肝纤维化、肝硬化,甚至死亡的发生等[3]。NAFLD 是由单纯的肝脂肪性变性(Nonalcoholic fatty liver,NAFL)发展为非酒精性脂肪性肝炎(Nonalcoholic steatohepatitis,NASH),严重时可发展为肝纤维化,肝硬化,甚至肝细胞癌的连续疾病谱[4]。目前,对NAFLD的治疗仍是一个全球性的严峻课题,由于其病因和发病机制复杂,仍未完全阐明。而NAFLD的发病机制的研究与治疗药物的筛选,在很大程度上依赖于人类NAFLD病理机制相似模型的建立和应用。截至目前,虽有几篇关于NAFLD小鼠模型的综述[5-7],但仍缺乏对NAFLD小鼠模型较为全面系统的综述,且对小鼠在实验周期内的病理特征鲜有涉及。此外,随着近两年大量的NAFLD临床研究陆续开展,国内外迅速掀起了研究热潮,也不断构建出能更好地模拟人类NAFLD病理特征的小鼠模型,这些新构建的小鼠模型将极大促进NAFLD相关研究的开展,亟需予以综述以便研究人员运用推广。因此,本文对近年来各研究机构报道的NAFLD小鼠模型研究进展进行全面总结综述。
1 营养失调性脂肪肝模型
1.1 高脂饮食(High fat diet,HFD)模型
高脂饮食模型是一种常见扰乱脂质代谢,导致脂肪肝变性,诱导NAFLD发生的造模方法。高脂饮食通常选用含有60%脂肪的高脂饲料,C57BL/6小鼠由于对高脂饲料比较敏感,容易形成高脂血症,故而是常用的复制NASH模型的动物。C57BL/6小鼠用高脂饮食喂养10-12 w后,出现高脂血症、高胰岛素血症和葡萄糖耐量异常的变化。长期喂养高脂饮食34-36 w后,Makoto Ito等[8]观察到小鼠血浆肝酶水平异常,即丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)水平升高。长期喂养80 w后,出现典型的脂肪变性、肝细胞损伤、肝小叶炎症和纤维化[9]。与其他小鼠模型不同,喂食高脂饮食的小鼠模型模拟了人类NAFLD的组织病理学和发病机制,因为它具有NAFLD患者中观察到的主要特征,包括肥胖和胰岛素抵抗。因此,该模型适于评估减重、低脂饮食及改善胰岛素抵抗的治疗药物。高脂饮食模型也有一定的局限性,如造模耗时较长(通常需要12-16 w),而且随着动物种系和饮食配方的不同呈现出多样性。
1.2 致动脉粥样硬化饮食(Atherogenic diet,ATH)模型
ATH含有0.5%胆酸盐和1.25%的胆固醇,通常应用于小鼠以构建粥样硬化斑块模型。Naoto Matsuzawa 等[10]研究发现,ATH可致C57BL/6小鼠出现血脂异常。与此同时,在6-24 w内,ATH还引发了NASH,且造模时间越长,病理状态越严重,如出现肝细胞大泡性脂肪性变,炎症以及肝纤维化等。此外,小鼠在6 w后也表现出丙氨酸氨基转移酶、总胆固醇和甘油三酯水平升高[10,11]。然而,ATH并不致体重增加,也没有明显的胰岛素抵抗现象,因此,与人类NASH病理机制有一定区别,成为该模型的缺陷。
1.3 高脂+致动脉粥样硬化饮食(High fat +Atherogenic diet,HFD+ATH)模型
HFD+ATH是在高脂饮食的基础上,添加0.5%的胆酸盐和1.25%的胆固醇。该模型结合了高脂模型及ATH模型的优点,可有效地促进非酒精性脂肪肝炎的进一步发展,主要病理特征为胰岛素抵抗、氧化应激、肝星状细胞激活[10]。Sophie A Montandon等[12]将HFD+ATH(60%脂肪+1.25%胆固醇+0.5%胆酸盐)与胆碱-蛋氨酸缺乏饮食进行分析比较,两者具有类似的NASH病理特征,HFD+ATH诱导的C57BL/6小鼠表现出肝胆固醇和游离脂肪酸增加,而胆碱-蛋氨酸缺乏饮食的小鼠为肝脏的甘油三酯水平升高为主。
1.4 高脂+胆固醇饮食模型
高脂+胆固醇饮食是在高脂饮食的基础上,添加21%的黄油和0.2%的胆固醇。短期喂养高脂+胆固醇饮食后,C57BL/6J小鼠仅发生肝脏脂肪变性。而雌性ldlr-/-和 APOE2ki小鼠会表现出严重的炎症和脂肪变性,其特征为巨噬细胞浸润和NF-kappaB介导的信号增强。有趣的是,雄性ldlr-/-和 APOE2ki小鼠也出现严重的肝脏炎症,但未有脂肪变性[13]。此外,一种西方饮食,其中有富含n-6-PUFA大豆油(100g大豆油含有25g的n-6-多不饱和脂肪酸)和0.75%胆固醇。C57BL/6小鼠被给予该饮食20 w后,小鼠表现出肝脂肪变性呈气球样变、氧化应激、炎性细胞浸润、Kupffer激活和肝纤维化,伴有体重增加、胰岛素抵抗的NAFLD特征[14]。
1.5 高脂+高糖饮食(American lifestyle induced obesity syndrome,ALIOS)模型
ALIOS是一种高脂与高糖饮食协同诱导的小鼠模型,ALIOS造模方法是高脂饲料(含30%的反式脂肪酸)及果葡糖浆喂养,16 w后,C57BL/6小鼠有明显的脂肪变性,伴有坏死性炎症,丙氨酸转氨酶水平升高[15]。与仅高脂饲料(含30%的反式脂肪酸)喂养相比,ALIOS组动物体重明显增加,食物摄入量增加,胰岛素抵抗增强,但脂肪变性程度和丙氨酸转氨酶水平几乎无变化。有文献报道,Takuma Tsuchida等[16]使用西方饮食(Teklad diets,TD.120528)饲料,辅以高果糖的饮用水,两周一次腹腔注射小剂量的CCl4时,发现C57BL/6小鼠可快速地从单纯性脂肪肝到脂肪性肝炎,肝纤维和肝细胞癌的演进,几乎符合人类NAFLD的病理过程。
1.6 高脂+高果糖+高胆固醇饮食(Amylin liver NASH diet,AMLN;Gubra Amylin NASH diet,GAN)模型
为了弥补先前报道的ALIOS小鼠模型的缺陷,更加客观评估动物肝脏病理进程,Jason R Clapper等[17]改良了ALIOS诱导模型,并提出了高脂+高果糖+高胆固醇(AMLN)饮食模型,其含40%的脂肪(其中约18%的反式脂肪酸),22%的果糖和2%的胆固醇。C57BL/6和ob/ob小鼠同时喂养AMLN(26-30 w)后,均出现明显的肝脂肪变性、肝小叶炎性细胞浸润和肝细胞形态肿胀。值得注意的是,C57BL/6小鼠需喂养26-30 w后,才会出现上述病理特征。相比于C57BL/6小鼠,ob/ob小鼠喂养AMLN 12 w后,则可表现出甘油三酯和丙氨酸氨基转移酶水平明显升高[18]。另外一种含有41%的脂肪,30%的果糖和2%的胆固醇的高脂+高胆固醇+高果糖饮食可很好地模拟西方饮食中高脂高糖高胆固醇的习惯,该饮食模型适用性更为广泛,已被用于建立多种基因型小鼠的非酒精性脂肪肝炎模型[19]。
2018年,FDA颁布了反式脂肪作为食物添加剂的禁令,因此,高脂+高胆固醇+高果糖饮食(AMLN)用于NAFLD小鼠模型的构建较为受限。Michelle L Boland等提出了GAN饮食模型,配方含40%的脂肪(无反式脂肪酸),22%的果糖,10%蔗糖和2%的胆固醇。ob/ob小鼠喂养GAN 8-16 w后,表现出明显的体重增加,且与人类NASH的病理特征十分相似。此外,与AMLN饮食的ob/ob小鼠的病理特征也具有一致性,但GAN饮食的ob/ob小鼠的体重增加更为明显。相比之下,C57BL/6小鼠则需要较长的喂养时间(通常需要28 w后)才能诱导出与上述一致的NASH模型[20]。
1.7 胆碱-蛋氨酸缺乏饮食(Methionine-Choline Deficiency,MCD)模型
胆碱-蛋氨酸缺乏饮食含40% 的蔗糖和10%的脂肪,但是不含有蛋氨酸和胆碱。最初2-4 w内小鼠就会出现NAFLD病理表型的主要特征,如小鼠的肝细胞大泡性脂肪性变,并随后出现明显的纤维化[21]。尽管MCD模型是研究NASH的重要工具,并用于早期药物的筛选,但MCD 模型也有一定的局限性,如胆碱-蛋氨酸缺乏饮食配制繁琐,不符合人类饮食规律,也与人类NASH患者的实际代谢状况完全不同,缺乏人类NASH所具有的全身性胰岛素抵抗特征。Mary E Rinella等[22]发现MCD模型呈现出低血清胰岛素、空腹血糖、瘦素和甘油三酯水平。与NASH患者多有肥胖不同,MCD模型较正常对照组出现严重体重下降,呈恶病质状态[23]。
1.8 胆碱缺乏L-氨基酸饮食(Choline deficient L-amino defined diet,CDAA)模型
CDAA饮食含有68.5%的碳水化合物、17.4%的蛋白质和14%的脂肪。CDAA饮食诱导模型与MCD小鼠模型类似,它可以抑制肝细胞的脂肪酸氧化,增加脂质合成,氧化应激和炎症,最终导致纤维化。长期喂食CDAA的小鼠也可出现体重增加、胰岛素抵抗和血脂水平显著升高[24]。另外,CDAA喂养小鼠出现代谢相关症状的时间长,目前仅限于肝脏疾病研究,不宜单独应用于NASH相关研究。以上模型的病理特征,造模时长,优缺点等内容归纳总结如表1所示。
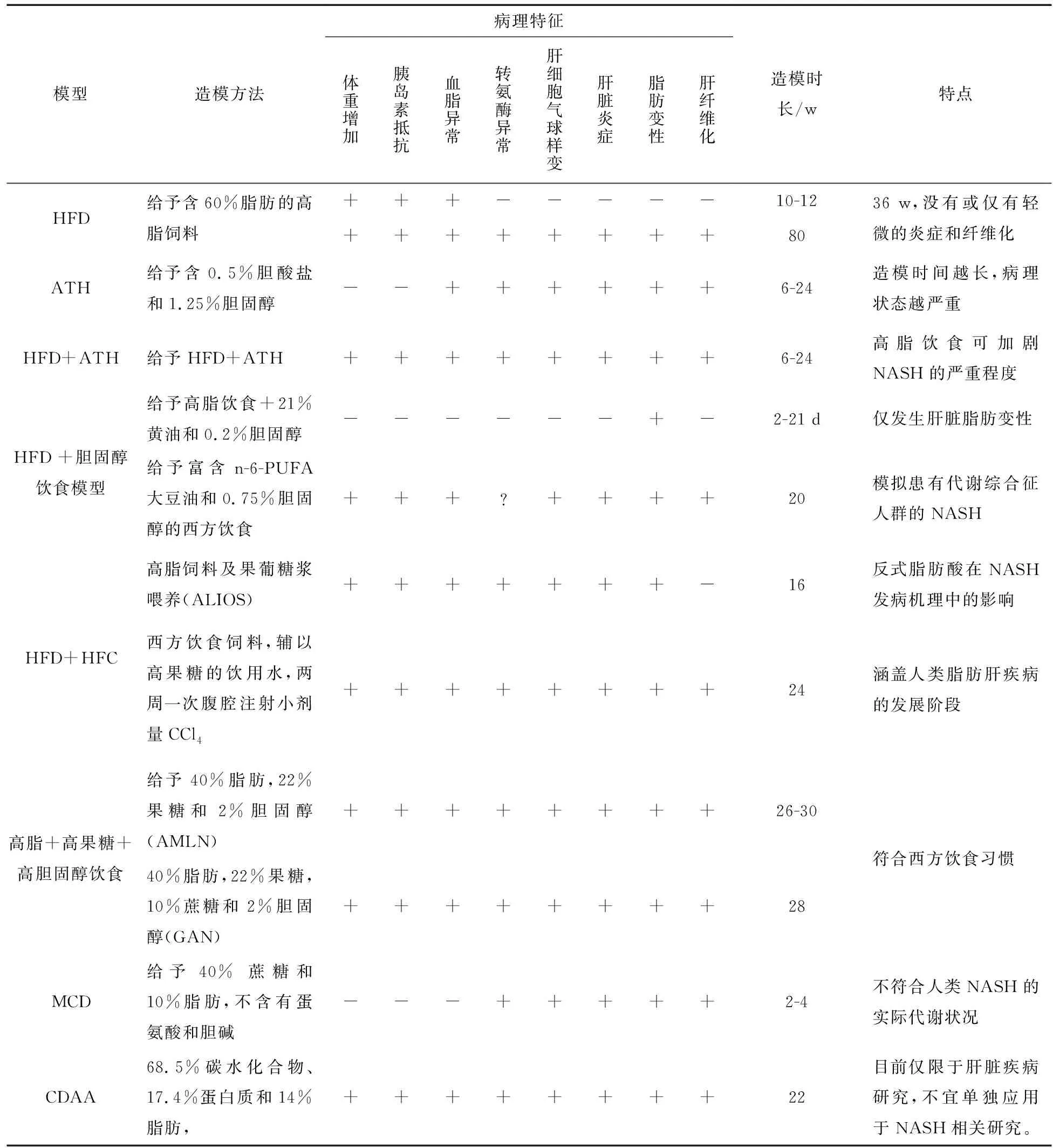
表1 非酒精性脂肪肝病营养失调性C57BL/6小鼠模型
2 药物毒性诱导脂肪肝模型
2.1 链脲佐菌素(Streptozotocin,STZ)诱导模型
链脲佐菌素诱导模型常见于诱导2型糖尿病的实验性模型,C57BL/6小鼠在出生2 d后,给予200 μg/L剂量,并结合高脂饮食喂养,大约20 w内出现脂肪性肝炎、纤维化甚至肝癌,可以作为NAFLD的小鼠模型[25]。STZ诱导模型小鼠6周龄出现单纯性肝脏脂肪变性,8 w时出现小叶炎症和肝细胞广泛气球样变,8-12 w时肝脏脂肪沉积向纤维化发展,20 w时小鼠高发肝细胞癌。造模期间,小鼠的转氨酶和血糖浓度一直呈现升高趋势[25]。该模型可以诱发氧化应激、炎症、纤维化和肝细胞凋亡,符合NAFLD的组织病理学。但与人类NAFLD的胰岛素抵抗不同的是,链脲佐菌素会破坏胰岛β细胞功能,而不会导致全身性的胰岛素抵抗。因此,这也限制该模型在临床前药物研究中的使用。
2.2 四氯化碳(CCl4)诱导模型
CCl4是最早采用的试验性脂肪肝模型诱导剂,可以诱导肝纤维化小鼠模型。CCl4诱导肝脏发生氧化应激反应,导致有毒脂质和蛋白质过氧化产物的积累,并发生严重的坏死反应。小鼠进行两周一次,腹腔注射CCl4会造成广泛性肝损伤,肝细胞变性坏死,单核细胞轻度浸润以及大、小泡混合性肝脏脂肪变性等特征。此外,转氨酶和甘油三酯的水平也明显高于正常对照组[26]。CCl4单独诱导模型仅出现肝纤维化,而不发生肥胖和胰岛素抵抗等病变,因此不属于NAFLD模型。因此,CCl4通常需要与饮食诱导模型相结合制备NASH模型,如CCl4可以促进高脂饮食对非酒精性脂肪肝炎和肝纤维化的发展[27]。以上模型的病理特征,造模时长,优缺点等内容归纳总结如表2所示。
3 基因缺陷模型
3.1 遗传性瘦素缺乏和瘦素抵抗小鼠模型(ob/ob小鼠、db/db小鼠)
瘦素是一种由白色脂肪组织产生的脂肪素,其通过下丘脑能使个体产生明显的厌食效应。ob/ob小鼠基因自然突变,造成瘦素缺失,表现为运动减少、贪食、极度肥胖、代谢减退和低体温的特点[28],在3-4周龄时表现为高血糖、胰岛素抵抗和高胰岛素血症[29]。但是该小鼠虽有明显的胰岛素抵抗,却不能自发地由单纯性脂肪肝发展成脂肪性肝炎,需联合胆碱-蛋氨酸缺乏饮食、高脂饮食、脂多糖等,才可演变为NASH[30]。由于瘦素缺乏,ob/ob小鼠肝纤维化的发生率极低。即使在CCl4干预下,也几乎不会出现纤维化,甚至抵抗肝纤维化的产生,这说明瘦素在肝纤维化进程中具有重要作用。人类极少出现瘦素缺乏的情况,因此该模型与人类NASH发病机制仍有差别。db/db小鼠瘦素受体基因的自然突变,使瘦素无法发挥作用,所以小鼠的表现类似ob/ob小鼠,但瘦素较正常水平升高[31]。db/db小鼠也不自发形成脂肪性肝炎的特性,需联合胆碱-蛋氨酸缺乏饮食、高脂饮食等,如结合MCD饮食诱导会形成明显的肝纤维化,可作为典型的NASH模型用于药物筛选评估[30]。
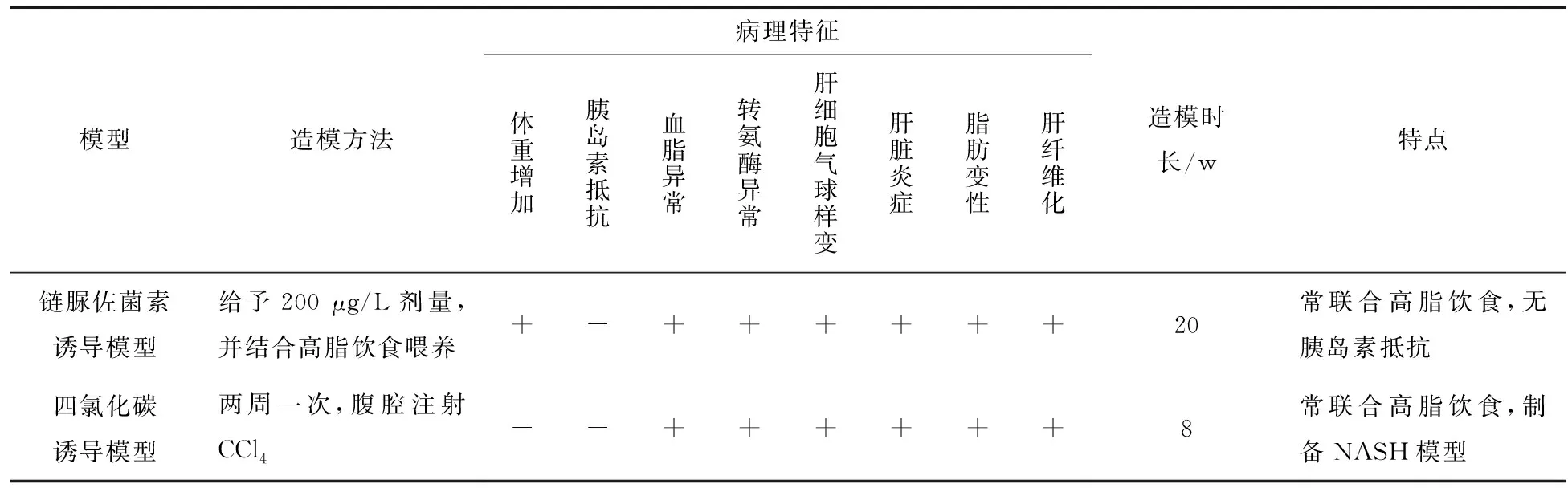
表2 非酒精性脂肪肝病药物毒性诱导C57BL/6小鼠模型
3.2 脂肪肝综合征(Fatty liver Shionogi,FLS)小鼠
正常环境条件下,FLS小鼠是不贪食、无肥胖和可自发地形成胰岛素抵抗、高脂血症和脂肪性肝炎模型[32]。FLS小鼠模型的肝纤维化较轻,目前主要用于降脂化合物的筛选和评估。为更好模拟建立人类NAFLD的病理特征,Takaaki Sugihara等[33]通过FLS小鼠与ob/ob小鼠相结合,FLS-ob/ob小鼠的表型结合了这两种模型的优点,FLS-ob/ob小鼠相对于FLS小鼠更易发生严重的肝脂肪变性和肝纤维化。因此,FLS-ob/ob小鼠模型可以用于非肥胖伴有脂肪肝变性和进行性肝纤维化的药物筛选[34]。
3.3 黑皮质素4受体敲除模型(Mc4r-/-小鼠)
黑皮质素 4(Melanocortin receptor 4,MC4R)是参与调控食物摄入和动物体重的一种重要因素[35]。Mc4r-/-小鼠表现为晚期肥胖、高胰岛素血症、高血糖症。通过动态增强磁共振成像的技术,Tomomi Yamada等发现Mc4r-/-小鼠喂食HFD(20 w)出现肥胖和NASH,并有明显的纤维化。该模型具有研究NASH晚期肝功能障碍的潜力[36]。
3.4 脂肪酸转位酶FAT/CD36缺陷小鼠模型
FAT/CD36是介导长链脂肪酸跨膜转运和营养利用的重要蛋白。正常状态下, FAT/CD36在肝脏中的表达量很低,然而NAFLD患者相关基因研究显示肝细胞内FAT/CD36的表达量明显增加[37]。FAT/CD36缺陷小鼠的脂肪酸储存和利用,与正常小鼠比较,减少>60%。脂肪酸和甘油三酯水平显著性升高,过多的脂肪酸转运到肝脏,超过其氧化能力,引起脂质代谢紊乱及胰岛素抵抗,最终形成脂肪肝[38,39]。
3.5 微粒体前列腺素E合酶1缺陷小鼠模型(Microsomal prostaglandin E synthase-1,mPGES-1)
一般来说,前列腺素E2是前列腺素家族的成员之一,已知在类风湿性关节炎和骨关节炎等疾病的炎症过程中发挥重要作用。然而,Janin Henkel[40]等发现小鼠前列腺素E2合成的酶的表达不足,可引发肝脏依赖肿瘤坏死因子(TNF-α)的炎症反应,从而加重了饮食诱导的小鼠NASH的严重程度。
3.6 肝细胞特异性磷酸酶和紧张素同源缺陷小鼠模型(Hepatocyte-specific phosphatase and tensin homolog deficiency,Pten-/-)
最初,Pten为新发现的抑癌基因,其蛋白产物可能通过去磷酸化参与细胞调控。然而,作为调节细胞活动的重要因素,它在肝脏中的表现也受到越多的学者关注[41]。40 w龄的Pten-/-小鼠肝脏出现脂肪变性、炎症和纤维化。74-78 w后,83%的雄性小鼠和50%的雌性小鼠都出现肝癌[42]。Pten-/-小鼠表现与人类NAFLD病理进展相似,有脂肪过度堆积,之后出现肝纤维化和肝癌[42,43]。以上模型的病理特征,造模时长,优缺点等内容归纳总结如表3所示。

表3 非酒精性脂肪肝病基因缺陷模型
4 复合模型
国内外的学者主要在基因缺陷模型基础上结合营养失调性模型,为构建出能更好地模拟人类NAFLD病理特征的小鼠模型。个别的复合模型在前面的章节中已有介绍,这里不再赘述。
4.1 Alms1基因缺乏模型(foz/foz小鼠)
foz/foz小鼠有一个突变的Alms1基因,foz/foz小鼠表型上与ob/ob和db/db小鼠都相似,三者都不能自发地由单纯性脂肪肝发展成脂肪性肝炎,都需联合胆碱-蛋氨酸缺乏饮食、高脂饮食、脂多糖等。同样foz/foz小鼠也表现出类似的代谢紊乱特征,foz/foz小鼠采用高脂肪致动脉粥样硬化饮食喂养24 w后,小鼠出现肝脏脂肪积聚和严重的脂肪性肝炎,并伴有明显的肝纤维化[44]。
4.2 代谢综合征-非酒精性脂肪肝炎小鼠模型(Metabolic syndrome-NASH,MS-NASH)
MS-NASH小鼠,旧称为FATZO/Pco小鼠。该动物种系是野生型C57BL/6J和易肥胖的AKR/J杂交的小鼠,表现自发地发生肥胖[45]。该小鼠模型喂食补充果糖的西方饮食,可快速产生进行性的NAFLD和NASH的病理特征。
4.3 脂蛋白功能缺失模型(ApoE-/-小鼠、Ldlr-/-小鼠)
甘油三酯在肝脏内主要代谢途径是通过极低密度脂向组织细胞输出。因此,如果血中低密度脂蛋白和极低密度脂蛋白升高一般被认为是NAFLD的危险因素[46]。NASH发病机制复杂,单一的基因缺陷动物模型未能模拟人类NASH,脂蛋白功能受损的小鼠模型结合了饮食诱导可适用于NASH研究,包括ApoE-/-小鼠、Ldlr-/-小鼠等。Robert Schierwagen等[47]ApoE-/-小鼠+高脂/胆固醇饮食(1.25%胆固醇) 后,发现肝脏脂肪变性更加明显,包括血中极低密度蛋白、高脂血症等。Ldlr-/-小鼠+高脂/高碳水化合物/低胆固醇饮食(0.2%胆固醇)也可以表现出与ApoE-/-小鼠相似的NASH的病理特征[48]。
4.4 Gankyrin肝特异性基因敲除(Gankyrin liver specific knockout,GLKO)小鼠模型
Gankyrin(Gank),是一种癌基因,通常会引起肝脏细胞增值。GLKO小鼠模型的动物种系是Cre-Alb和LoxP-Gank回交的小鼠,与野生型小鼠相比,GLKO小鼠联合高脂饮食(6-7 m)的肝脏脂肪变性程度加重,但停止肝纤维化的发展[49]。因此,该模型可作为治疗NAFLD的一种策略,用于评估抑制肝细胞增殖潜力的药物。
4.5 饮食诱导非酒精脂肪肝病模型(Diet induced animal model of NAFLD,DIAMOND)
DIAMOND模型的动物种系是C57BL/6与S129S1/svlmJ杂交的小鼠,S129S1/svlmJ小鼠是常用于制作定点突变小鼠最广泛的一个品系。DIAMOND饮食含有40%的脂肪,0.1%胆固醇,23.1 g/L果糖和18.9 g/L葡萄糖溶液,小鼠被给予DIAMOND饮食16 w后,出现肥胖、胰岛素抵抗和血脂水平异常[50]。伴有肝脂肪变性,然后到非酒精性脂肪肝炎,继而发展为肝纤维化,概括了人类NAFLD的代谢特征和主要病理特点。在NAFLD疾病发展的不同阶段方面,与胆碱-蛋氨酸缺乏饮食、链脲佐菌素+高脂饮食比较之下,DIAMOND模型克服上述小鼠模型的局限性,其与人类NAFLD也具备很好的一致性。但是,DIAMOND模型与人类NAFLD其最大的区别是其抑制胆固醇合成和高发生率的肝细胞癌[50]。以上模型的病理特征,造模时长,优缺点等内容归纳总结如表4所示。
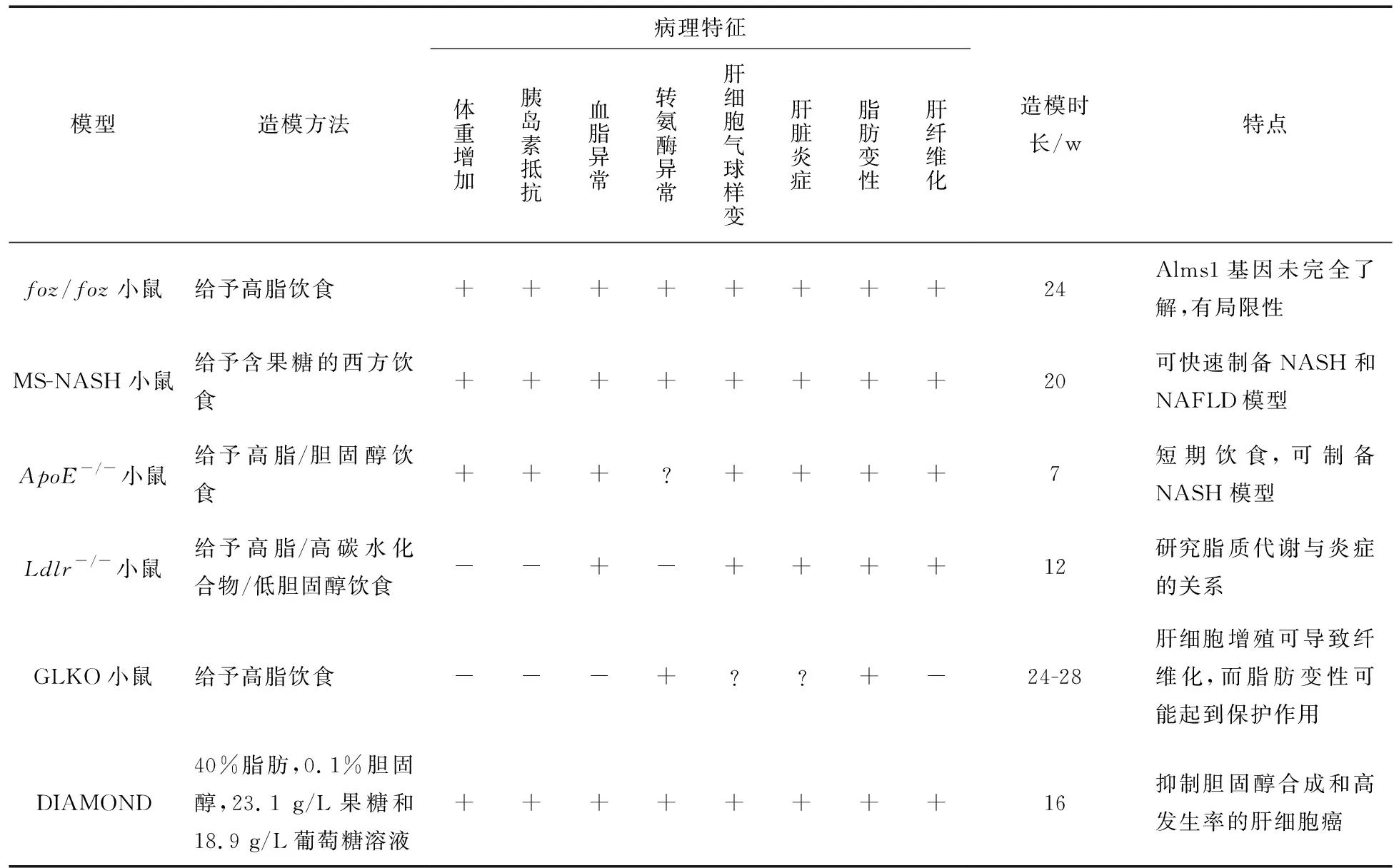
表4 非酒精性脂肪肝病复合模型
5 结语
NAFLD作为当前研究的热门领域,亟需深入研究其发病机制,评估相关药物疗效及寻找潜在的治疗靶标,NAFLD小鼠模型贯穿研究全程,在抗NAFLD领域中扮演不可或缺的角色。近年来,随着NAFLD领域大量的候选药物相继进入临床研究,一系列的NAFLD小鼠模型也相继被报道。不同致病因素所致NAFLD小鼠模型的形成机制及病理改变各异,各有其优点和缺陷,研究者需按照研究的目标选择适合的小鼠模型。随着NAFLD小鼠模型被不断优化,也为今后的NAFLD研究奠定了良好的实验物质基础,此外,构建能更好地模拟人类NAFLD病理特征的小鼠模型是近年来该领域的热点研究方向,优化为更理想的、能模仿NAFLD疾病谱的小鼠模型仍是今后亟待解决的关键问题。

