口腔黏膜拭子法可用于无创检测线粒体tRNAThr15927G>A突变
唐志宁,唐霄雯,薛 凌,管敏鑫
温州医科大学检验医学院(生命科学学院)//Attardi线粒体生物医学研究院,浙江 温州 325035
线粒体是哺乳动物除细胞核外唯一能产生DNA(mtDNA)的细胞器[1]。mtDNA共包含37个基因,其中13个基因编码蛋白,22个基因编码线粒体中的转运RNA(tRNA),2个基因编码核糖体RNA(rRNA,12S rRNA和16S rRNA)[2]。线粒体基因组的遗传缺陷可能会对患者造成特别严重的破坏,此外,近年来人们对人类线粒体疾病的关注显著增加。线粒体DNA在大多数真核生物中是母系遗传的[3],突变的mtDNA是通过母亲卵子细胞质的线粒体传递给子女,卵母细胞中的mtDNA突变可传给后代,并导致严重疾病,而父亲通过精子细胞质的线粒体把突变的mtDNA传给子女的情况十分罕见[4]。
线粒体tRNA在线粒体行使正常功能中起着重要作用。线粒体tRNA突变会造成线粒体功能紊乱、产能下降、活性氧类物质增加以及诱导激活线粒体介导的细胞凋亡途径[5-11],从而引发母系遗传性线粒体疾病。全球数据表明,线粒体疾病患者的最低出生率为0.2‰,这给许多国家、社会、家庭和个人带来了巨大的经济负担。而其中80%患者的发病原因是由于mtDNA突变[12]。在中国人群家系中线粒体tRNAThr15927G>A突变(以下简称为m.15927G>A)与母系遗传性原发性高血压、耳聋和Leber遗传性视神经病等紧密相关[13-15],说明m.15927G>A突变有重要的临床意义。因此检测mtDNA突变在诊断、治疗线粒体疾病中扮演着至关重要的角色。目前,国内外有几种母系遗传性线粒体疾病基因诊断方法,包括:直接测序法、荧光定量PCR检测法和基因芯片检测法等。但由于费时费力、操作繁琐及检测费用高而不易在临床进行推广。因此临床上急需寻找一种快速、灵敏、准确、低价的诊断母系遗传性线粒体疾病的检测方法。外周血含有大量的DNA可用来检测线粒体突变,然而血样采集存在以下几个问题:(1)创伤较大;(2)有感染风险;(3)操作要求较高;(4)患者疼痛感较强。相较而言,口腔黏膜拭子法具有无创、安全、易操作等临床优点。因此,本研究将探讨口腔黏膜拭子法是否能够检测母系遗传性m.15927G>A突变以及它的临床应用可行性。
1 材料和方法
1.1 材料
对温州医科大学附属第一医院2070例母系遗传性线粒体疾病病例的血样进行线粒体全序突变筛查后,将筛选出的3个携带m.15927G>A突变的病例(NT635,NT676,NT772)纳入突变组,并根据相同单体型原则筛选出3个正常志愿者(CO41,CO42,CO52)纳入对照组。根据温州医科大学伦理委员会规定管理的办法,获得两组实验对象的血液样本和口腔黏膜样本及知情同意书。
1.2 方法
1.2.1 致病评分系统 根据Yarham JW团队2011年更新的致病性线粒体tRNA突变评分系统标准对m.15927G>A突变的致病性做出判断[16]。
1.2.2 口腔拭子的获取 取样前1 h,禁烟、禁饮及禁食,从而减少食物或外源性因素对采样过程的影响[17]。采样前10 s,所有参与者清水漱口,用第1根口腔黏膜拭子对参与者右侧脸颊部/右侧上下牙床处刮拭取样;第2根黏膜口腔拭子对参与者左侧对应位置处刮拭取样;第3根口腔黏膜拭子再次对参与者右侧对应位置处刮拭取样。取样完成将拭子在洁净通风处烘干后装入密封干燥塑料袋中,样本迅速送回实验室储存于4℃。
1.2.3 DNA的提取 (1)手工法:在2 mL无菌EP管内加入3 μL蛋白酶K和600 μL细胞裂解缓冲液,用消毒过的镊子将口腔拭子上风干的棉花撕脱后置入上述EP管,并将EP管放入55℃恒温水浴箱内孵育90 min。孵育结束后,向EP管内加入600 μL4℃预冷的醋酸钾,充分颠倒混匀后静置冰上10 min。静置完成后,将混合物进行离心(12 000 r/min,10 min),将离心后的上清液转入装有600 μL预冷异丙醇的1.5 mLEP管中,充分混匀后转入-20℃冰箱沉淀30 min,随后在常温下离心(12000r/min,10min),弃上清液。加入600μL75%无水乙醇溶液,充分轻柔混匀后常温离心(12 000 r/min,5 min),弃上清液后重复1次上述步骤。EP管放入65℃金属浴40 min(管内酒精挥发至无味),加入20 μL无菌去离子水充分混匀;(2)试剂盒法:用HiPure Tissue DNA Mini Kits(Magen)试剂盒提取血样中的DNA;并使用QIA amp DNA Mini Kits(50)(QIAGEN)试剂盒提取口腔黏膜细胞DNA。
将以上DNA使用分光光度法测量260 nm和280 nm处的吸光度值来检测其浓度及纯度。
1.2.4 m.15927G>A突变检测 PCR使用内、外引物进行两轮扩增,克服了单次扩增引起的平台期效应限制,PCR的敏感性和特异性也相应增加[18]。以DNA为模版,使用两对引物进行巢式PCR。对产物进行纯化后送至测序公司,并将得到的结果与修订的剑桥标准序列比对[19],利用Codoncode Aligner进行突变检测(表1~2,图1)。
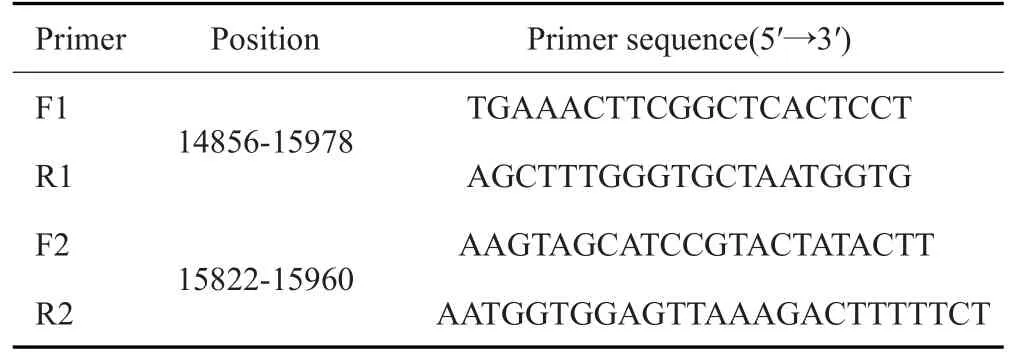
表1 引物信息Tab.1 Primer information
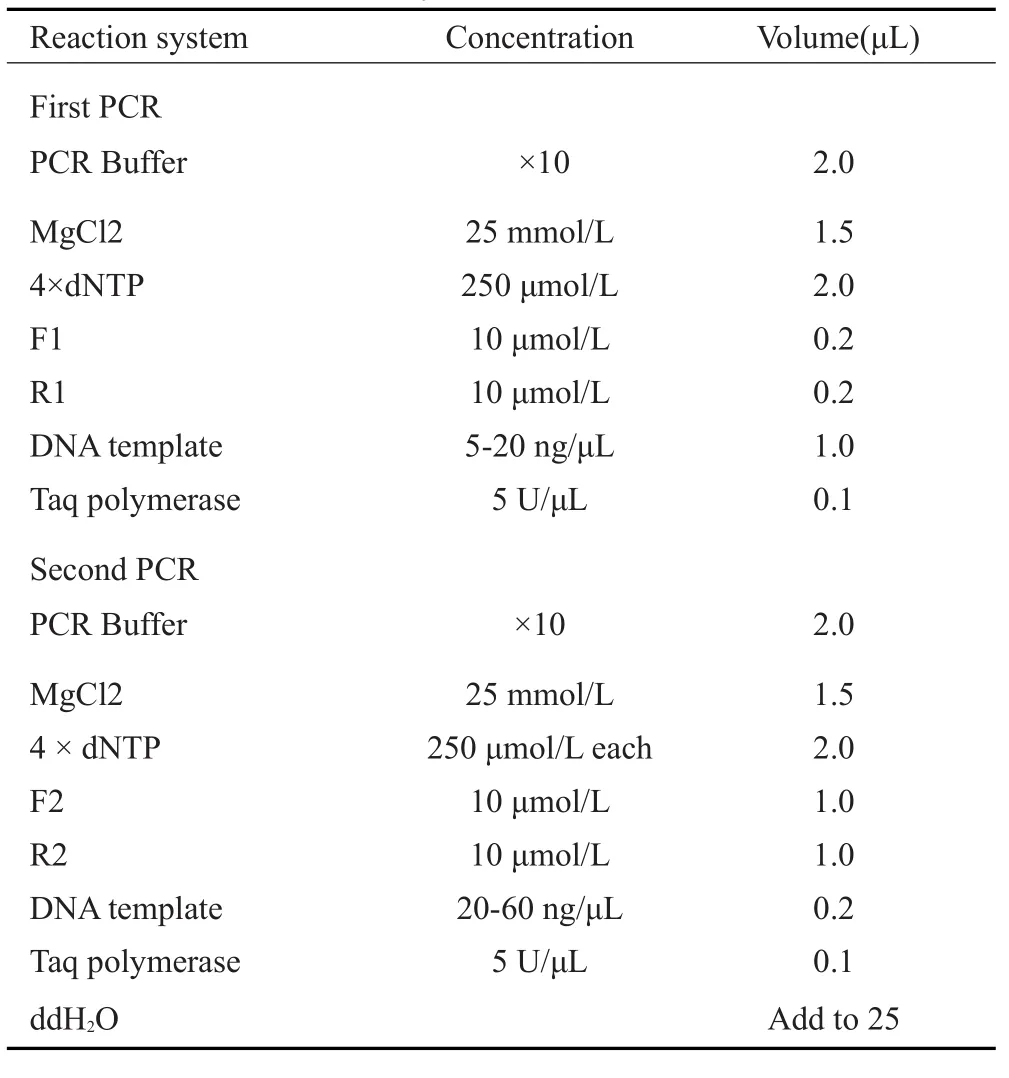
表2 巢式PCR反应体系Tab.2 Nested PCR reaction system
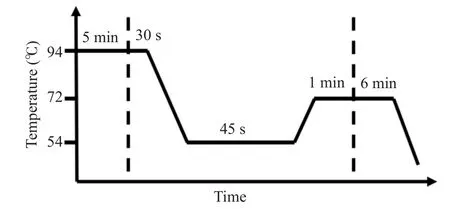
图1 巢式PCRFig.1 Nested PCR.
1.2.5 斑点印迹杂交 斑点印迹杂交是将变性的DNA点在固体基质膜上,用标记的特异性探针杂交,采用放射或非放射的方法检测杂交强度。突变引起产物能否与探针进行结合,从产生的阳性或阴性反应结果即可判断是否发生突变,此法具有稳健及结果可见性的优点[20]。在尼龙膜(Roche)上加入DNA,用特异非放射性地高辛(DIG)标记的寡脱氧核苷酸5'-CCTTGGAAAAAGGT TTTCATCTCC-3'探针(生工生物工程(上海)股份有限公司)检测tRNAThr15927G>A突变。膜在55℃下与加入探针的DIG Easy Hyb杂交液(Roche)杂交16 h后,室温下将膜在2×SSC,0.1% SDS(Ambion)中洗涤2次,5 min/次;然后在37℃下将膜放入0.5×SSC,0.1% SDS(Ambion)中洗涤2次,15 min/次。用DIG Wash和Block缓冲(Roche)液、抗DIG碱性磷酸酶(Roche)和CDP-Star(Roche)检测DIG标记的探针[21-22]。
1.2.6 Southern blot取50 ng上述PCR产物在10%聚丙烯酰胺胶内进行电泳,结束后将胶上的PCR产物通过电转至尼龙膜(Roche)上。膜与地高辛标记的探针进行杂交后即可检测,方法同上。
1.2.7 统计学分析 采用Graph Pad Prism 5软件和SPSS22.0进行统计学分析。P<0.05认为差异具有统计学意义。
2 结果
2.1 m.15927G>A突变的致病性评分
根据致病评分系统标准,m.15927G>A突变的最终评分为13(表3)。

表3 m.15927G>A致病评分系统Tab.3 m.15927G>A pathogenic scoring system
2.2 DNA浓度及纯度分析
从口腔黏膜样本和血液样本中提取的DNA浓度和纯度均服从正态分布。我们发现口腔黏膜样本DNA和血液样本DNA之间的DNA浓度没有显著性差异(P>0.05,表4),而手工法提取的口腔黏膜DNA的纯度要显著低于试剂盒提取的口腔黏膜DNA和全血DNA(P<0.05,表4)。口腔黏膜DNA产量与血液DNA产量相似。
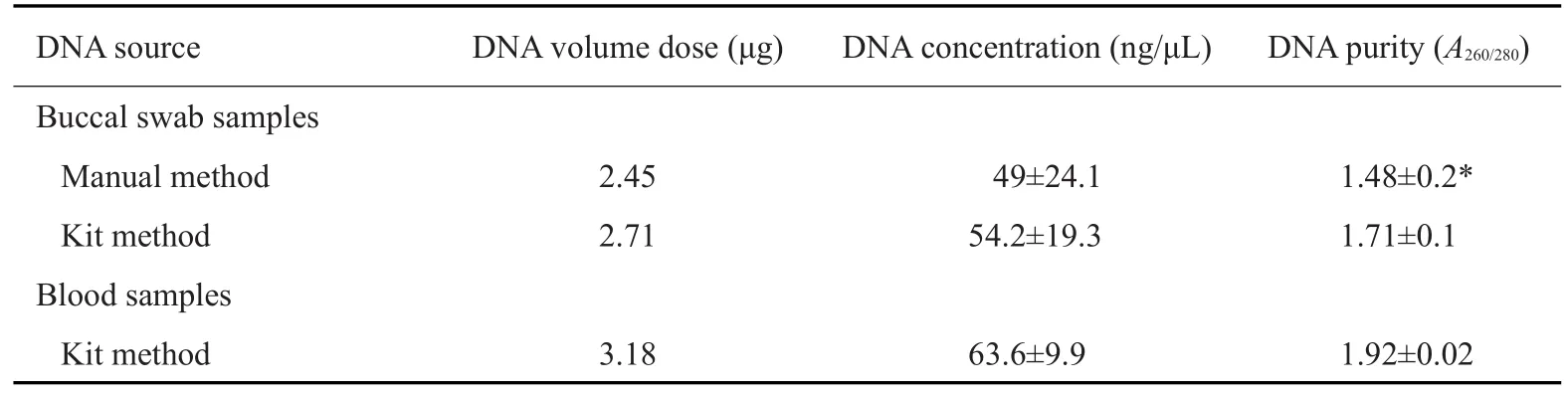
表4 DNA浓度和纯度分析Tab.4 DNA concentration and purity analysis(n=6)
2.3 m.15927G>A突变的DNA测序分析
对口腔黏膜样本进行扩增、测序,结果显示对照组(CO41、CO42、CO52)线粒体15927位点上为鸟嘌呤(G,图2),突变组(NT653、NT676、NT772)为腺嘌呤(A,图2)。
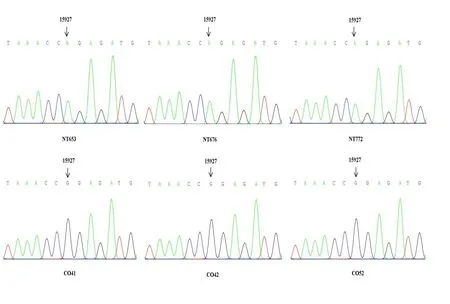
图2 口腔黏膜样本DNA测序峰图Fig.2 Sanger sequencing of PCR products amplified from genomic DNA extracted from buccal swabs.
2.4 m.15927G>A突变的斑点印迹杂交与Southern blot印迹杂交分析
斑点印迹杂交与Southern blot印迹杂交分析结果显示,对照组(CO41、CO42、CO52)口腔黏膜DNA和血液DNA的PCR扩增产物能与特异非放射性DIG标记的探针结合,检测到探针信号而呈阳性反应;突变组(NT635、NT676、NT772)口腔黏膜DNA和血液DNA的PCR扩增产物因为单碱基突变不能与探针结合而呈阴性反应(图3)。此外,手工法提取的口腔黏膜DNA1、试剂盒法提取的口腔黏膜DNA2和试剂盒法提取的血液DNA3扩增得到的3种PCR产物之间不存在显著差异(P>0.05)。

图3 口腔黏膜样本和血液样本的斑点印迹杂交和Southern blot印迹杂交分析Fig.3 Dot blot hybridization and Southern blot hybridization analysis of buccal swab samples and blood samples.A:Dot blot hybridization analysis;B:Southern Blot hybridization analysis.DNA1:DNA extracted manually from buccal swab samples;DNA2:DNA extracted from buccal swab samples using QIA amp DNA Mini Kits;DNA3:DNA extracted from blood samples using HiPure Tissue DNA Mini Kits.
3 讨论
线粒体苏氨酸tRNA(tRNAThr)由线粒体基因组编码,负责翻译线粒体中所有苏氨酸密码子,对于线粒体结构、功能与稳态具有重要意义。线粒体15927位点位于tRNAThr反密码子茎环上第42位,该突变破坏了tRNAThr反密码子茎环上高保守碱基对(28 C~42 G),从而改变tRNA的结构和功能[11,23-24]。在中国人群家系中线粒体m.15927G>A突变与母系遗传性原发性高血压、耳聋和Leber遗传性视神经病等紧密相关[13-15]。本研究发现m.15927G>A突变致病评分为13,说明此突变具有致病性。因此,准确、高效地检测m.15927G>A突变具有重要的临床意义。
目前,国内除了采用外周血DNA来检测母系遗传性线粒体疾病中的mtDNA突变外,尚未有其他检测方法得到报道。外周血采集带有创伤性并伴有疼痛感,样本运输耗费大量人力与物力,且现有相关诊断方法不易在临床上进行推广。因此,临床上急需一种快速、灵敏、准确、低价的基因检测方法来满足检测、筛查mtDNA突变的需求。含有细胞核的样本均可能得到DNA,包括血液、唾液、毛囊及口腔黏膜细胞等[16,25-28]。有研究发现,从口腔黏膜细胞中提取DNA的方法具有简单快速、廉价无创的特点[29],能极大减少患者负担[30]。目前的医学研究可从口腔黏膜拭子、口腔细胞刷、唾液以及漱口法来获取口腔黏膜细胞。其中漱口法的DNA产量相对较高,但样本处理过程相对复杂,而口腔黏膜拭子法凭借采样和处理简易的优点被运用于许多遗传研究领域[31-32]。口腔黏膜拭子法是一种简便无创、无需消毒且所需成本低的采样技术,不需要针头采样或皮肤活检,采集过程也无需训练有素的技术人员,这对于不易抽血的婴幼儿、老弱病残或精神病人等尤为重要。口腔黏膜拭子法是否可以代替血样来检测突变,关键在于DNA的产量和纯度以及样本在运送过程中的稳定性。有研究发现,无论是保存在室温还是-20℃的口腔黏膜拭子,其提取的DNA产量在拭子保存7 d或90 d时并无明显差异;口腔黏膜拭子在保存90 d后提取DNA的量会有所减少,但并不影响突变的检出;收集的样本在常规邮寄装运后仍产生可用的DNA[33-34]。本研究发现,在DNA浓度上,口腔黏膜DNA与血液DNA无显著差异;在纯度上,试剂盒法提取的口腔黏膜DNA与试剂盒法提取的血液DNA无显著差异,而手工法提取的口腔黏膜DNA显著低于前二者。通过斑点印迹杂交、Southern blot印迹杂交和DNA测序分析发现,口腔黏膜DNA同样可以准确检测到m.15927G>A突变,具有临床应用的可行性。运用口腔黏膜拭子法,从采样到m.15927G>A突变的检出仅需1~2 d,具有出报告快、周期短的优势,其临床应用前景广泛。当然,不同参与者或不同采集手法会导致口腔拭子中提取的DNA在产量、质量及完整性上具有差异,但可以通过方法的标准化来避免此缺陷[35]。
综上所述,口腔黏膜拭子可以代替血液成为m.15927G>A突变检测的另一来源。口腔黏膜拭子法是一种操作简易的诊断母系遗传性线粒体疾病的无创检测方法,具有较高的临床应用价值。

