洱海总有机碳的时空分布特征及其影响因素
黄明雨,窦嘉顺,杨四坤,高登成,张葵东,董琼蕃
(大理州洱海湖泊研究院,云南 大理 671000)
0 前言
洱海(25°36′~25°58′N,100°5′~100°18′E)位于云南省大理市境内,是云南省第二大淡水湖泊;形似人耳,南北长,东西窄;当水位1966m时,湖面积252km2,南北长42.5km,平均水深10.5m,最深处达20.5m,最大湖宽8.4km,湖容量28.8亿m3,湖水不存在温跃层,上下温差小,冬季湖面无冰。
洱海流域面积2565km2,洱海流域的降雨集中在雨季(5—10月),占全年降雨量85%以上,多年平均降水量1048mm,湖面蒸发量多年平均1208.6mm。湖区常年主导风向西南风,年平均风速4.1m/s,最大风速40m/s。流域境内有弥苴河、永安江、罗时江、波罗江及苍山十八溪等大小河溪117条,多年平均入湖总地表径流量约5.7×108m3[1]。
洱海是大理市的主要水源地,它的蓄水是大理地区居民的生活用水、农业用水、旅游与发电及维护生态环境的重要来源,在地区经济发展中发挥着巨大的作用[2]。
总有机碳(TOC)为水中的有机物质用碳量来表示,它是反映水体中有机物污染程度的重要指标[3-4]。水体中的有机碳是生物圈最大的活性有机碳库,约占全球活性有机碳库的1/6,在生物、地质和化学过程发挥着主要作用[5]。总有机碳是碳循环尤其是生物泵过程的主要参与者,主要来源于浮游植物的光合作用、浮游生物的死亡和排泄物的降解、陆地有机物质的大量输入和湖泊沉积物的自然溶解,它与人类的生态环境相互影响、相互制约。另外TOC是衡量水体有机污染程度的一项综合指标,对有机污染起指示作用。水体中有机物浓度监测技术中,TOC测定方法比COD和BOD的测定更方便快捷和准确,而且能全面反映水体含碳有机物污染状况,因此对水体中TOC的研究越来越引起人们的重视[6]。
本文以中国新三湖之一——洱海为研究对象,重点研究洱海TOC 含量在时间和空间上的分布规律,同时分析了TOC与水温、pH值、透明度、溶解氧、CODCr、CODMn、总磷、总氮、叶绿素a、藻类细胞密度等环境因子之间的关系,以期为进一步保护治理洱海提供参考。
1 材料与方法
1.1 采样点位和采样时间
根据“洱海及其主要入湖河流水质监测评价工作方案”,洱海水质监测点位采用原有5条国控垂线及6条省控垂线共11个监测点,南部点位3个(286、287、288),中部点位5个(280、281、283、284、285),北部点位3个(631、632、633)。2018年3月—2019年2月每个月8日左右采集11个点位上下层混合水样,用便携式采水器在各样点表层(0.5m)和底层(离底泥0.5m)采集水样现场混合。水样装入样品瓶中冰盒内保存,带回实验室测定各项指标。
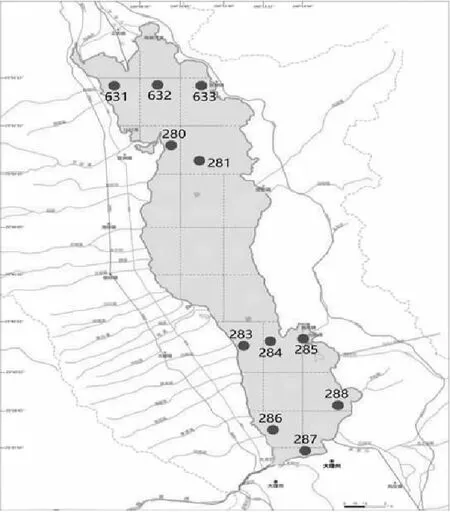
图1 采样点位
1.2 样品采集和测定方法
1.2.1 理化指标测定
水体中总氮采用碱性过硫酸钾消解-紫外分光光度计Cary 60 UV-Vis(Agilent,美国)测定,总磷用钼酸铵分光光度法Cary 60 UV-Vis(Agilent,美国)测定,CODCr采用快速消解分光光度法DR5000(HACH,美国)测定,CODMn采用高锰酸钾滴定法测定,水温和溶解氧用便携式多参数水质分析仪U-53(HORIBA,日本)测定,pH值用Eutech pH510(CyberScan,新加坡)酸度计测定,透明度用Secchi透明度盘测得[7]。
1.2.2 叶绿素a测定
将1L水样用玻璃纤维膜过滤,收集藻类,使用反复冻融法对藻类细胞进行破碎,用90%丙酮溶液提取叶绿素,根据叶绿素光谱特性,用安捷伦Cary60紫外分光光度计(Agilent,美国)依次测定750nm、664nm、630nm波长下的吸光度,计算叶绿素的含量[7]。
1.2.3 藻类细胞密度测定
藻类分类计数采用镜检法。取0.1mL水样注入0.1mL计数框内,在10×40倍显微镜下计数分类。计数采用视野计数法,在显微镜下观察100个视野,计数两片,两次数值偏差<15%。藻类种属分类在计数200个藻体的基础上,用划“正”的方法,记录每个种属的个体数[7]。
1.2.4 总有机碳测定
TOC的测定采用燃烧氧化-非分散红外吸收法,水样直接用ET1020A总有机碳分析仪(欧陆科仪,中国)测定总碳(TC)和无机碳(TIC),用差减法测定总有机碳(TOC)[8]。
1.3 数据分析
数据统计分析采用SPSS 20.0和EXCEL 2007软件进行,数据图采用SURFER 16软件进行。
2 结果
2.1 洱海水质物理因子的变化特征
洱海春夏季节水温呈逐月升高的趋势(图2),9月温度最高,达25.55℃,秋冬季节逐月降低,1月温度最低,达13.55℃。洱海水体透明度(图3)整体处于波动水平,月度趋势与水温变化相反。春夏季透明度逐月降低,9月最低,为138cm。秋冬季节逐月升高,3月透明度最高,达239cm。水体溶解氧(图4)的变化范围为4.37~8.86mg/L,平均值为7.15mg/L,其中1月水体的溶解氧量达到最大值(8.29mg/L),而8月水体出现最小溶解氧值(5.52mg/L)。
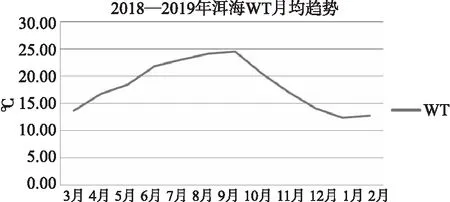
图2 洱海月均水温变化趋势

图3 洱海月均透明度变化趋势

图4 洱海月均溶解氧变化趋势
2.2 洱海水质化学因子的变化特征
总体上洱海湖水pH值比较稳定(图5),全年pH值范围在8.45~8.94,全年均值为8.72。全湖看来,北部8.80>中部8.70>南部8.68。
总磷浓度呈现明显的季节变化(图6),其变动范围为0.010~0.054mg/L,平均值0.027mg/L,8月和9月的总磷浓度明显高于其他月份。总氮(图7)浓度在0.28~0.95mg/L,总平均值为0.62mg/L,9月的总氮浓度明显高于其他月份。氨氮(图8)浓度在0.020~0.126mg/L,总平均值为0.068mg/L,6月和7月的氨氮浓度明显高于其他月份。全湖来看,北部0.073mg/L>南部0.069mg/L>中部0.064mg/L。
洱海春夏季节化学需氧量CODCr呈逐月升高的趋势(图9),9月温度最高,秋冬季节逐月降低,1月温度最低。高锰酸盐指数(图10)CODMn在2.90~4.91mg/L,总平均值为3.80mg/L,6月的高锰酸盐指数明显高于其他月份。
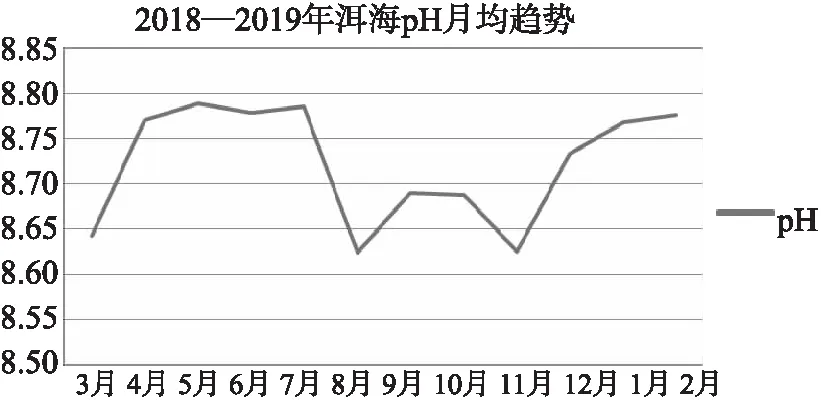
图5 洱海月均pH变化趋势

图6 洱海月均总磷变化趋势
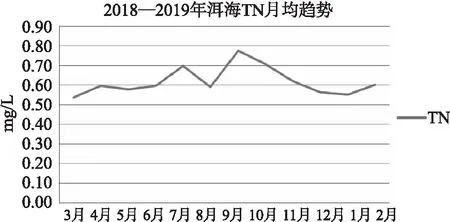
图7 洱海月均总氮变化趋势

图8 洱海月均总氮变化趋势
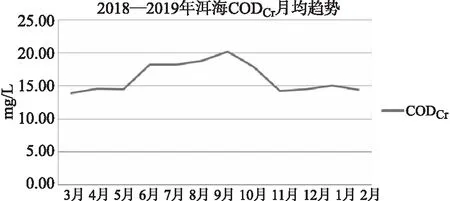
图9 洱海月均化学需氧量变化趋势
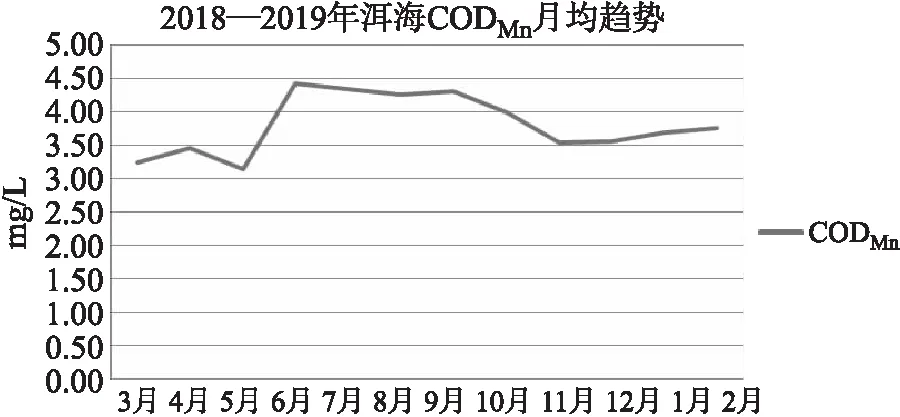
图10 洱海月均高锰酸盐指数变化趋势
2.3 洱海藻类细胞密度D和叶绿素a的时空分布情况
采样期间检测到的藻类细胞密度为:234~4904万个/L,平均值1548万个/L(图12)。9月、10月的藻类细胞密度明显高于其他月份,全湖看来(图11),北部1817万个/L>中部1496万个/L>南部1365万个/L。
研究期间同时测定了叶绿素a的浓度,其范围为:0.003~0.026mg/L,平均值0.012mg/L,9月、10月、11月的叶绿素a浓度明显高于其他月份(图13)。
2.4 洱海总有机碳的时空分布特征
2018年3月—2019年2月洱海TOC的季节变化明显(图14),春夏季节呈逐月升高的趋势,9月温度最高,均值达到8.30mg/L,秋冬季节逐月降低,3月TOC最低,均值为4.16mg/L。TOC浓度变化范围在3.04~10.83mg/L,总平均值为6.10mg/L,全湖来看,TOC浓度北部6.93mg/L>南部5.84mg/L>中部5.76mg/L。
洱海水体同一点位不同时间的TOC波动较大(图15),洱海水体同一时间不同点位之间的TOC差异明显(图16),全湖均值浓度6.10±1.72mg/L。
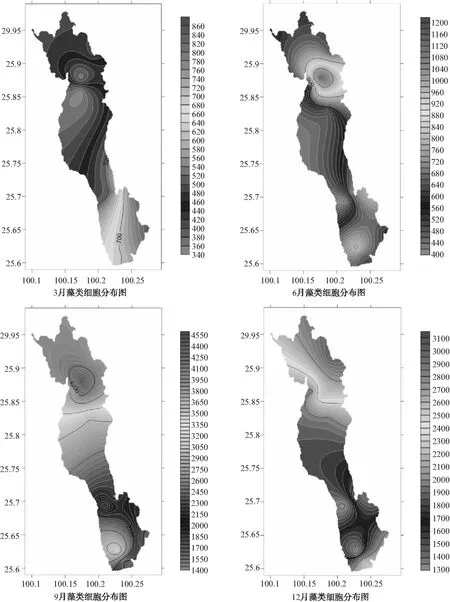
图11 洱海典型月份藻类细胞分布
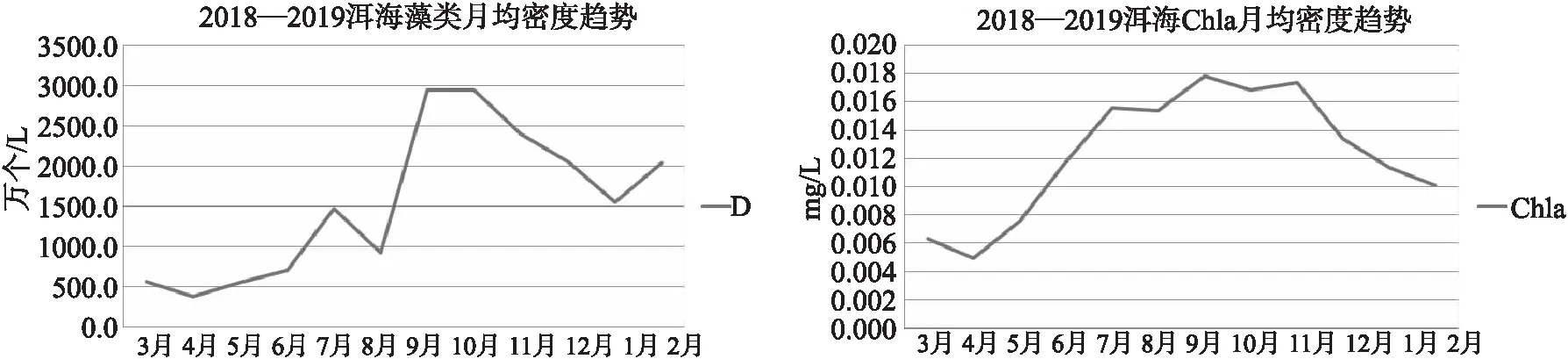
图12 洱海月均藻类细胞数变化趋势 图13 洱海月均叶绿素a变化趋势

图14 洱海典型月份TOC分布

图15 同一点位不同时期TOC波动范围 图16 同一时期不同点位TOC波动范围
2.5 TOC与环境因子Pearson相关性分析

表1 TOC与环境因子Pearson(双侧)相关性分析结果
3 讨论
3.1 洱海TOC分布与理化因子的相互关系
3.1.1 化学需氧量CODCr
化学需氧量(CODCr)被用来反映水体有机物的相对含量,也可反映水体中受还原性物质污染的程度,包括亚硝酸盐、亚铁盐和硫化物等,此类物质具有COD值,却不具有TOC值[9]。CODCr氧化率高,再现性好,能氧化水体有机污染物的80%,适用于测定水样中有机物的总量[10]。洱海TOC与CODCr在一定程度上存在极显著正相关性(r=0.913,p<0.01,n=132),但二者之间存在差别,特别是在经济社会快速发展的时期,在水体有机污染物来源发生较大变化的情况下,其水体CODCr的变化并不能真实地反映水体被有机物污染的程度[11]。
3.1.2 水温WT
从全年来看,TOC浓度随水温升高而增加,水温是TOC的限制因子[12]。随着水温升高,使生物体内酶的活性增强,藻类和微生物大量繁殖,大量消耗水体中的CO2,浮游植物生物量显著增加[13]。经光合作用产生的溶解性有机碳和颗粒性有机碳增加,致使水体中总有机碳的浓度明显增大,洱海TOC与水温(r=0.801,p<0.01,n=132)呈显著正相关。
3.1.3 总磷TP
一般来说,磷的增加能促进藻类的生长,洱海的营养现状是磷浓度还未达到饱和(阈值0.20mg/L),因此洱海总磷浓度的增加对藻类生产的促进作用非常明显[14]。本研究中,6—9月洱海的总磷浓度明显高于其他月份,与浮游植物暴发性的生长相吻合,相对洱海来说总磷对TOC 的影响就比较显著(r=0.730,p<0.01,n=132)。
3.1.4 高锰酸盐指数CODMn
高锰酸盐指数(CODMn)是传统的反映水体有机污染状况的指标,其基本原理是利用高锰酸钾氧化水中有机物进行测定,由于高锰酸钾的氧化能力较弱且对各类有机污染成分的氧化率高低不一,选择性强,故该项指标在指示水体有机污染方面已有了较大的局限性[15]。洱海全年TOC的变化趋势与CODMn的变化趋势基本一致(r=0.689,p<0.01,n=132)。但在6—9月份TOC浓度远大于CODMn浓度,这说明也有少数污染成分的流入是突发性的、季节性的,且破坏了水中各类有机成分的平衡。这主要有两方面的原因,一是雨季带来的暴雨径流,二是季节性的农田耕作。
3.1.5 氨氮NH3-N
氨氮是水体中的营养素,可导致水体富营养化现象产生,对鱼类及某些水生生物有毒害。氨氮是硝化反应的重要反应物,是水体中的主要耗氧污染物,所以对水体中的TOC贡献很大。氨氮与TOC浓度呈显著正相关(r=0.615,p<0.01,n=132)。
3.1.6 总氮TN
氮是影响和限制浮游植物生长的重要营养盐,是湖泊富营养化的主要原因,影响着水体中总有机碳浓度的变化[16]。一般来说,氮的增加能促进藻类的生长,但过量的氮(阈值0.80mg/L)并不能更好地促进藻类生长。洱海9月份总氮均值浓度为0.78mg/L,接近阈值,TOC均值浓度也达到最大8.30mg/L,总氮与TOC浓度呈显著正相关(r=0.383,p<0.01,n=132)。
3.1.7 酸碱度pH
洱海水体pH值比较稳定,全年pH值范围在8.45~8.94,全年均值为8.72。总有机碳和pH的Pearson相关系数仅为0.183,p<0.05,相关性不显著。
3.1.8 透明度SD
湖水中的悬浮物质和浮游生物越多,对光的散射和吸收越强,透明度就越小。另外,入湖径流、风和季节变化对透明度也有一定影响。透明度的日变,决定于悬浮物质和浮游生物的数量与迁移规律,洱海水体的透明度和TOC浓度呈极显著负相关(r=-0.654,p<0.01,n=132)。
3.1.9 溶解氧DO
溶解氧是水体中存在的分子态氧,其浓度高低可反映细胞新陈代谢速度的快慢,影响微生物对有机物利用的方式[17]。溶解氧较高时生物新陈代谢旺盛,有机物消耗增多,总有机碳含量偏低;溶解氧较低时有机物在缺氧条件下分解,出现腐败发酵现象,水质变差,TOC浓度上升。因此洱海水体中溶解氧与TOC浓度呈负相关(r=-0.461,p<0.01,n=132)。
3.2 洱海TOC分布与叶绿素a、藻类分类计数密度D的相互关系
叶绿素a 是浮游植物进行光合作用的主要色素,江志坚等的研究显示大亚湾TOC 与叶绿素a呈现显著的正相关关系[18],与洱海水体TOC 与叶绿素a 有显著性结论一致(r=0.530,p<0.01,n=132)。同时,洱海水体TOC 与藻类细胞密度D显著相关(r=0.301,p<0.01,n=132)。
于海燕等的研究表明,当微囊藻占藻种比例>40%时,叶绿素a和藻类密度D直线回归分析相关性R2达到0.913;微囊藻占藻种比例≤40%时,叶绿素a和藻类密度D直线回归分析相关性R2为0.668[19]。本研究中,叶绿素a和藻类密度D呈显著相关(r=0.628,p<0.01,n=132),洱海藻类密度不断增加,种类不断减少,浮游植物小型化趋势明显,优势种从微囊藻转变为伪鱼腥藻。
4 结论
洱海水体中的TOC含量是外源输入、内源产生、湖内迁移转化等多个过程动态平衡的结果。入湖径流携带的有机物是洱海TOC的重要来源,这部分有机物由流域内陆地生态系统产生,并在径流形成过程中由土壤进入水体,最终汇入洱海;藻类等浮游植物以及水草通过光合作用合成的有机物是洱海水源中TOC的另一重要来源,藻类、水草生长过程中会以胞外有机物的形式向水中分泌有机物,而当藻类、水草进入衰亡期后胞内有机物和构成细胞结构本身的有机物均会分解进入水中;无论是外源TOC还是内源TOC,在洱海中均会发生复杂的迁移转化过程,包括物理作用下的沉降与扩散释放、化学和生物作用下的氧化还原与矿化、部分随出水流出洱海[20]。洱海TOC浓度的时空分布也受到流域内降雨、农事活动、污水排放、施工、旅游活动、生物活动等的影响。
(1)洱海2018—2019年水体TOC质量浓度范围为3.04~10.83mg/L,年平均值为6.10mg/L,夏季(6—8 月)、秋季(9—11 月)、冬季(12—2 月)、春季(3—5月)TOC浓度呈现由大变小的趋势,浓度频率分布符合正态分布。
(2)洱海水体TOC浓度中,CODCr贡献最大,TOC与CODCr在一定程度上存在极显著正相关性。从全年来看,TOC浓度随水温升高而增加,水温是TOC的限制因子。氮、磷的增加能促进藻类的生长,总氮、总磷对TOC 的影响比较显著。洱海全年TOC的变化趋势与CODMn的变化趋势基本一致。但在6—9月TOC浓度远大于CODMn浓度。氨氮是水体中的营养素,也是水体中的主要耗氧污染物,所以对水体中的TOC贡献很大。
(3)水中的悬浮物质和浮游生物越多,透明度就越小,TOC浓度越高,TOC与SD呈显著负相关。溶解氧较高时生物新陈代谢旺盛,有机物消耗增多,总有机碳含量偏低;溶解氧较低时有机物在缺氧条件下分解,出现腐败发酵现象,水质变差,TOC浓度上升,TOC与DO呈显著负相关。
(4)洱海TOC浓度与pH值相关性不显著。
(5)在洱海水域11个采样点,TOC与叶绿素a、藻类细胞密度D的分布趋势表现出明显的一致性,说明浮游植物对水体中的TOC有一定的贡献,控藻有利于降低水体总有机碳水平。

