全麻下单纯影像学引导的帕金森病丘脑底核脑深部电刺激手术的效果分析
党圆圆 夏小雨 杨艺 刘楠 单桐辉 杜少鹏 张志强 何江弘
丘脑底核-脑深部电刺激(subthalamic nucleus deep brain stimulation,STN-DBS)手术已作为中晚期帕金森病(Parkinson’s disease,PD)的重要治疗方法被广泛应用。在经典的手术流程中,脑深部刺激(deep brain stimulation,DBS)电极在局麻下植入,通过术中微电极记录(microelectrode recording,MER)及术中临床测试验证植入位置及效果。其代价是患者需要在药物关期状态下采用固定体位忍受耗时较长的手术,这可能限制部分耐受性差的患者通过手术获益。近年来,影像学的进步让核团定位精度增加,这使国内外开展单纯依赖影像定位的全麻手术呈增多趋势。但是,随之而来的是围绕其优势及效果的各种争议[1,2]。鉴于此,不少大的中心仍坚持采用局麻下神经生理验证(术中临床测试加MER)或全麻下MER 等验证方法以保证电极植入效果。本中心近年来采用了全麻下DBS 电极植入,辅以术中CT验证的手术流程。现将上述病例与传统的局麻下电极植入加术中神经生理验证的手术病例进行比较,观察其手术时间、植入准确性及术后效果,现报道如下。
资料与方法
一、研究对象
回顾分析2017 年6 月至2019 年1 月在解放军总医院第七医学中心功能神经外科接受双侧STNDBS 手术的PD 患者,共21 例。其中2017 年6 月至2018 年2 月的8 例患者采用局麻植入颅内电极(局麻组),2018 年3 月至2019 年1 月的13 例患者采用全麻植入颅内电极(全麻组)。全部患者均依据国际运动障碍协会2015 年版标准诊断为PD。纳入标准:(1)病程4 年以上,H-Y 分期Ⅱ~Ⅲ期;(2)左旋多巴冲击试验统一帕金森病评定量表第三部分(unified Parkinson’s disease rating scale Ⅲ,UPDRS-Ⅲ)评分改善率40%以上;(3)有症状波动、“开关现象”或异动症等药物不良反应;(4)无其他明显手术禁忌证。排除标准:(1)中重度认知功能障碍;(2)严重的情感障碍及精神疾病;(3)明显影响患者生存期的共存疾病。研究获得解放军总医院第七医学中心伦理委员会批准(审批号:XJS2018-11),患者及家属均知情同意并签署知情同意书。
二、术前计划
患者入院后行UPDRS-Ⅲ评分,记录服药的每日左旋多巴等效计量(levodopa equivalent daily dose,LEDD)、汉密尔顿抑郁量表(Hamilton depression scale,HAMD)、日常生活能力量表(activity of daily living scale,ADL)、帕金森病患者生活质量量表简化版本(Theshort-form8-itemParkinson’sdiseasequestionnaire,PDQ-8)等基线资料[3]。
所有患者术前1 周内行MRI(3.0T,GE)扫描,包括3D-T1、轴位及冠状位T2 加权像及磁敏感加权成像(susceptibility weighted imaging,SWI)。扫描参数:260×260 矩阵;3D-T1 为1 mm 层距,T2 像为2 mm,SWI 为2 mm,均为连续成像。由1 名手术医生在Leksell 手术计划系统[Leksell SurgiPlan,医科达(北京)医疗器械有限公司]确立STN 背外侧区底部为手术靶点,同时设计好穿刺路径。
三、手术流程
手术当日全部患者局麻在手术室安装Leksell立体定向头架[医科达(北京)医疗器械有限公司]后行MR 扫描。局麻组患者完成MRI 扫描后,将扫描图像融合至术前计划,确定靶点框架坐标,实施手术。电极植入顺序为先右后左。采用双额直切口,颅骨钻孔后安装电极锁外环,切开硬膜,在电极套管进入硬膜后立即在硬膜破口外注入适量猪源纤维蛋白粘合剂(倍绣胶) 以防止脑脊液流失并控制创面渗血。术中在患者清醒状态下使用MER 系统(Leadpoint)记录神经电生理信号,并行刺激试验进行生理定位,丘脑底核感觉运动区电生理信号应>4 mm,并有明确的感觉运动诱发,否则应考虑调整穿刺位置,直至电生理信号长度满意。确定电极最终穿刺针道后,植入DBS 电极(品驰L301 型,北京品驰医疗设备有限公司)至丘脑底核感觉运动区底端。通过宏电极刺激做术中临床测试,包括语言、四肢运动障碍改善效果及不良反应。双侧电极植入后缝合头部切口,转为全麻,植入脉冲发生器(品驰G102R 或G102,北京品驰医疗设备有限公司)。
全麻组患者完成MRI 扫描后即实施全麻,将扫描数据与术前计划融合后实施手术,手术基本操作与局麻组相同,术中不做MER 及宏电极刺激临床测试,电极植入后使用国产16 排移动CT(江苏摩科特医疗科技有限公司)行术中扫描(层厚1.1 mm),数据导入手术计划系统,与术前MRI 3D-T1 像融合,计算计划靶点与实际植入的偏差。绝对误差为最低触点与设计靶点的直线距离,径向误差指最低触点与设计路径的最短距离。如植入位置与计划位置径向误差>2 mm 则需调整穿刺位置(需再次行术中CT 确认植入位置)或深度,确认电极位置满意后缝合头部切口,继续完成脉冲发生器一期植入。2 组的手术时间均定义为患者在手术室逗留的总时间。
四、术后程控
全部患者术后行1.5T MRI 检查,结果导入lead DBS 系统及手术计划系统,比较2 组电极最终的绝对误差及径向误差。术后1 个月内试开机,由1 名程控医生根据术后重建的电极与核团的相对位置选择程控触点,随后确定最佳初始刺激参数。出院后定期随访程控。记录2 组患者手术后半年UPDRS-Ⅲ评分改善情况、药物使用情况及并发症。
五、统计学分析
采用SPSS24.0 软件进行统计学分析,正态分布的计量资料以均数±标准差(±s)表示,组间比较采用两样本t 检验。以P<0.05 为差异有统计学意义。
结果
一、2 组患者基线情况比较
局麻组患者8 例,其中男性3 例,女性5 例,年龄范围50~80 岁,PD 病程4~12 年;全麻组患者13例,其中男性4 例,女性9 例,年龄范围44~75 岁,PD 病程4~23 年。2 组患者在年龄、病程、术前UPDRS-Ⅲ(药物开、关期)评分、LEDD、HAMD、ADL、PDQ-8 等分值差异无统计学意义(P>0.05)(表1)。
二、术中植入位置验证情况
局麻组8 例(16 侧)患者均行术中局麻MER,首次穿刺的MER 显示丘脑底核感觉运动区信号均>4 mm。微电极记录的丘脑底核感觉运动区核团进入点和出离点分别位于影像学标记的STN 背外侧区进入点和出离点的(0.9±0.57)mm 和(0.2±0.41)mm。最终植入位置为丘脑底核感觉运动区信号靶点下端。术中测试无因信号不佳调整穿刺通道的情况。术中临床测试均可观察到运动障碍的改善。
表1 全麻组和局麻组患者STN-DBS 术前基线资料对比(±s)
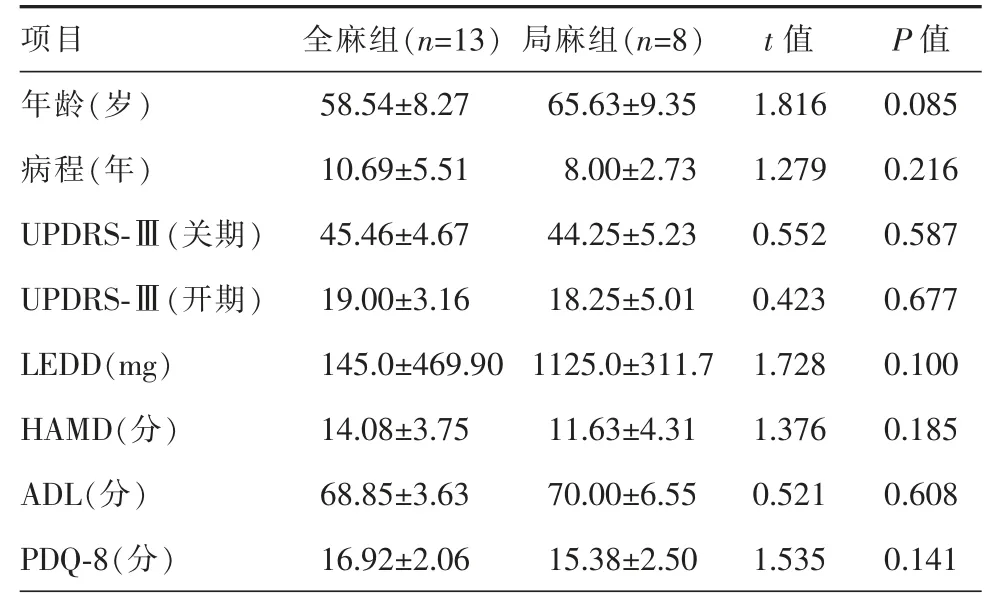
表1 全麻组和局麻组患者STN-DBS 术前基线资料对比(±s)
STN-DBS:丘脑底核脑深部电刺激;UPDRS-Ⅲ:统一帕金森病评定量表第三部分;LEDD:左旋多巴等效计量;HAMD:汉密尔顿抑郁量表;ADL:日常生活能力量表;PDQ-8:帕金森病患者生活质量量表简化版本
全麻组13 例(26 侧)患者手术植入DBS 电极后行术中CT,导入手术计划系统可见径向误差均<2 mm,故无需调整穿刺通道(图1)。其中有3 侧电极的位置偏深,均通过直尺测量,将电极位置在原通道上提1 mm。再次复查术中CT 可见位置满意。
三、植入位置及准确性的比较
2 种手术方式两侧的设计靶点坐标、手术路径在冠、矢状面的角度差异均无统计学意义(P>0.05);局麻手术两侧的平均绝对误差均大于全麻手术,差异有统计学意义(P<0.05);而平均径向误差在2 组中差异无统计学意义(P>0.05)。由此可见2 种手术方式的左右侧靶点、路径角度及电极植入偏移均无明显差异(表2)。
四、手术时间、并发症及术后效果比较
全部患者一期植入脉冲发生器。全麻组手术时间明显少于局麻组,差异有统计学意义(P<0.05)。全部患者未发生脑内出血、植入物感染或移位等与手术相关的并发症。术后半年随访可见全部患者运动症状均有不同程度改善,服药剂量均较术前减少,2组开机后UPDRS-Ⅲ评分、改善率及LEDD 下降差值差异均无统计学意义(P>0.05)(表3)。
讨论
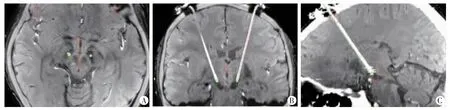
图1 术中CT 与术前SWI 融合像所示电极与靶点的关系
表2 全麻组和局麻组设计靶点坐标、路径角度及植入误差的对比(±s)
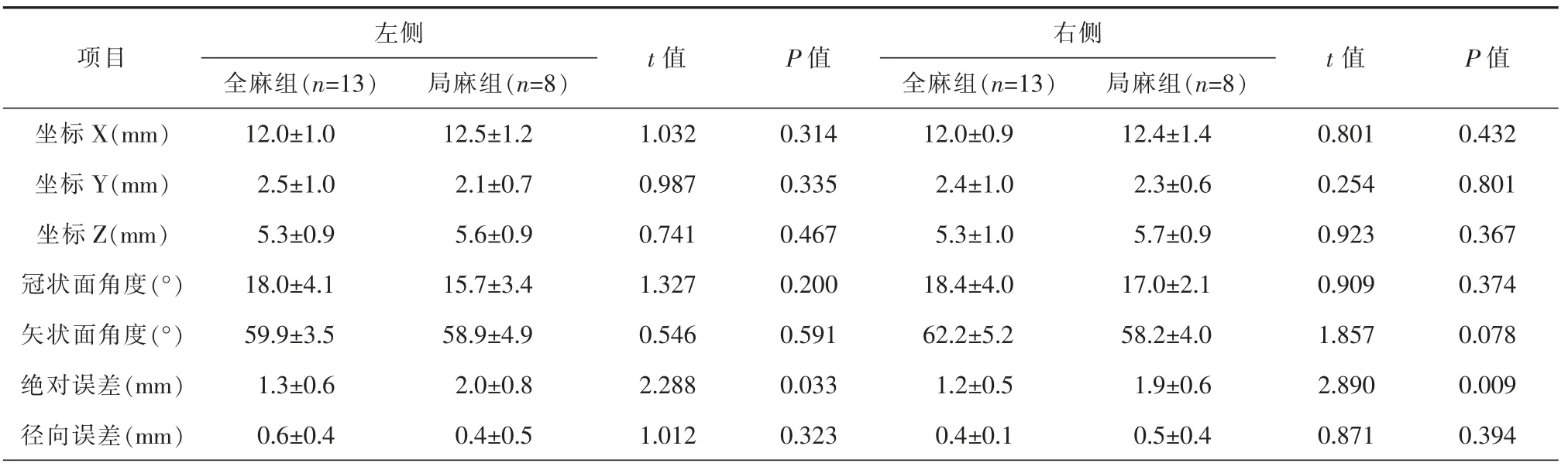
表2 全麻组和局麻组设计靶点坐标、路径角度及植入误差的对比(±s)
表3 全麻组和局麻组手术时间及术后半年运动症状及服药改善率对比(±s)
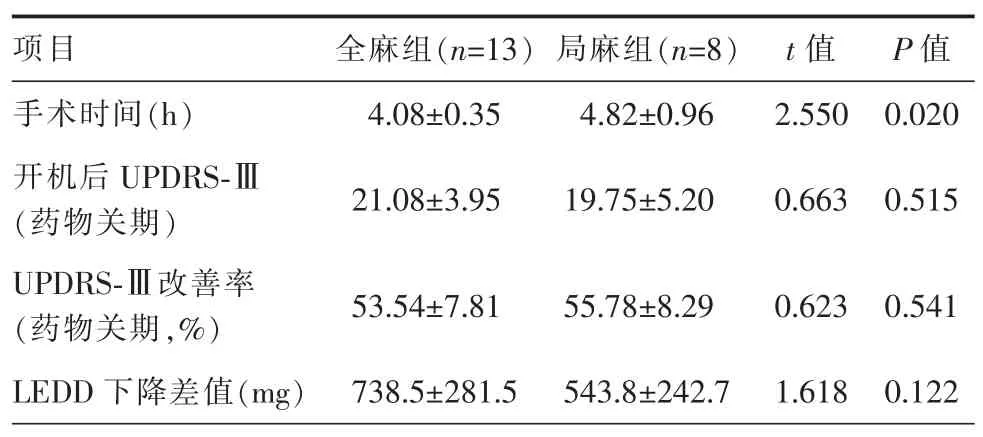
表3 全麻组和局麻组手术时间及术后半年运动症状及服药改善率对比(±s)
UPDRS-Ⅲ:统一帕金森病评定量表第三部分;LEDD:左旋多巴等效计量
PD 患者STN-DBS 的治疗目的是提高生活质量,这对手术安全性及电极植入精度都提出了很高的要求。全麻STN-DBS 可用于不能耐受局麻的PD患者,术中不进行临床测试,但通常保留微电极记录的电生理验证步骤。随着影像定位准确度的提高,有学者认为可视解剖靶点的精确植入是保证疗效的关键,并尝试MR 影像引导,无术中微电极记录的电极植入[4]。本研究中,前期局麻组采用传统的局麻手术流程,通过术中神经生理定位确认植入位置;后期全麻组为单纯影像定位,在全麻下植入电极后增加了术中CT 检查确认植入位置的步骤,2 组的手术时间比较,全麻手术时间小于局麻手术时间。手术效果通过两方面验证,即植入位置的误差和术后远期疗效。事实上,局麻组植入的绝对误差稍高,但因为2 种手术流程下的径向误差均很小且没有显著差别,所以绝对误差带来的影响可以通过术后程控触点选择得以消除,影响不大。从手术效果看,2 组患者术后均未出现明显与手术操作相关的并发症。术后6 个月随访中,本研究考察了运动症状改善情况及药物减少情况,即STN-DBS 手术对运动功能的主要疗效评估指标。2 组疗效未发现明显差异,这与大多数临床研究的结果吻合[5,6]。
准确植入解剖靶点是决定全麻下STN-DBS 术后疗效的根本保障,其主要受3 个因素影响,即靶点设计、植入技术及有效的验证矫正方法。STN 是可视靶点,MR 下STN 的定位技术不断进步,意味着靶点设计精度不断提高。T2 加权成像首先实现了STN 的可视化定位,至今仍应用最广。高场强(3.0T 以上)下SWI 序列对STN 范围边界描画更加清晰,与MER 所示STN 范围吻合度较好,且与术中CT 融合效果良好,故本研究靶点设计及电极验证均以SWI序列作为主要参照序列[7,8]。但高场强SWI 存在晕状伪影现象,使磁敏感区域看起来更大。定量磁化率(quantitative susceptibility mapping,QSM) 这一图像后处理技术克服了几何失真,信噪比高,能最准确地区分STN 与下方黑质及上方未定带的边界,增加了STN 的可视度,甚至可以区分STN 内部磁敏感源分布梯度,有助于亚结构的辨识[9-11]。在图像处理及融合技术改进后,QSM 可能是未来单纯影像引导的STN-DBS 最有前途的成像方式。另外,越来越细化的功能改善的要求也依赖于MRI 下STN 亚结构的辨识能力的增强,已有研究证实刺激根据纤维束成像的定义的STN 亚结构与DBS 临床效果具有相关性[12]。总之,成像技术的进步保证了靶点设计准确,这是全麻下STN-DBS 的前提。
良好的植入技术是将电极准确置入设计靶点的保证,与术者经验、立体定向设备的精度及术中脑组织移位有关。本研究术者技术稳定,所使用的框架式Leksell 立体定向系统定期维护矫正,精度达标,植入操作准确性良好。全麻组在初次穿刺后,仅有3 侧电极在术中CT 验证后做了穿刺深度调整,局麻组在MER 验证下亦无重新调整穿刺通道的情况。术中脑组织移位是造成电极植入误差的重要原因,尤其影响后穿刺侧电极准确性,常因脑脊液流失和气颅造成。本研究采用了倍绣胶封堵硬膜破口的方法控制脑脊液流出及气体进入,2 组中几乎都没有发生气颅。本文将全部病例左右侧电极植入情况作比较,在靶点坐标、穿刺角度及植入误差方面均未见明显差异,提示术中脑组织移位控制良好。
全麻术中有效的验证矫正方法是必不可少的。即使靶点选择十分精准,亦或以机器人手术为代表的植入技术使植入准确性进一步达到亚毫米级,放弃术中验证手段仍是冒险的做法[13]。有研究者通过MER 发现约20%的初次穿刺位置欠理想,并需加以矫正[1]。所以,DBS 手术有必要在术中验证电极位置。在诸多电极位置的验证方式中,术中临床测试可作为预测植入电极对患者运动功能改善的最直观依据,但其必须在局麻手术中开展,占用一定的手术时间,并需要患者在药物关期状态下做一定的配合。另外,术中临床测试可能高估术后程控的有效治疗窗[14]。这些都使术中临床测试具有一定的局限性。术中MER 是可靠的验证电极位置的方法,可记录每条穿刺路径的神经电生理特征,为术后程控提供参考,同时是脑功能研究重要而珍贵的依据。不少学者将MER 作为验证电极是否植入目标即STN 感觉运动区的金标准。MER 可在局麻或全麻下进行,全麻药物特别是丙泊酚等静脉麻醉药物会对其信号特征产生影响,但并不影响电极植入的准确性[15]。然而,MER 特别是多通道MER 的缺点是增加了脑部穿刺的次数,具有潜在的并发症风险;切口暴露时间增加还可能增加颅内积气等风险,影响电极植入的准确性;信号不满意时,根据核团信号特点间接判断偏差方向,重新设计穿刺路径需要丰富的神经电生理知识和经验[16]。以上问题促使人们尝试单纯影像学验证方法,主要包括术中MR 和术中CT。1.5T 及以下场强的术中MR 可安全用于植入脑深部电极后的验证,其特点是靶点可视化,可实现在脑移位时“实时”观察植入情况,调整坐标。现在已有专用于MRI 引导下的电极导线植入(Clearpoint system)的工作台,使电极调整更为方便。术中CT 则是通过与术前MR融合的方式观察植入电极是否在设计靶点可接受的误差范围内,并指导必要的电极调整的验证方法[17,18]。操作方便及良好的CT-MR 融合效果是保证术中CT验证效果的要素。本研究使用的16 排移动CT 具有轻便、辐射剂量低及分辨率高等特点,与术前MR 融合顺利,图像清晰易于测量,最终电极验证效果满意[19]。事实上,已有述评性文章指出无论采用MER 还是采用术中CT、术中MR 等验证方式,都能使全麻下DBS 达到同样的精度[5]。
在植入精度与疗效相当的情况下,全麻手术有其明显的优势。手术时间是考察手术流程合理性的一个指标,本研究全麻组手术时间相对较短,原因之一是术中CT 比术中MER 用时要短。此外,全麻组的麻醉诱导和气管插管可以与手术计划同时进行,也使手术流程更加紧凑。关于并发症,全麻手术除前文所述可减少脑组织穿刺次数外,还能实现对血压更好的控制,这些都减少了颅内出血的风险。由于多数颅内出血的临床症状都要滞后,故局麻植入电极并不能保证更早地发现颅内出血,全麻手术辅以术中影像则更易及时确诊或排除颅内出血[20]。气颅也是DBS 常见并发症,可影响植入准确性并可能造成早期不良反应,据报道,全麻手术气颅发生率更低[21]。除此之外,全麻下操作的患者无痛苦,围手术期的精神压力较低;术前不必刻意停药减少了术后撤药反应,符合加速康复外科理念;对于术者,全麻手术体位摆放更方便,术中操作亦可免受患者不适症状的干扰;但是,单纯影像学引导全麻手术也有其局限性,包括对术中移动CT 或术中MR 等硬件设备及其精度的要求。对新开展STN-DBS 手术的单位,建议首先采用局麻手术,增加术中验证手段,待经验成熟后可开展全麻手术。对新尝试的核团靶点,应采用MER 全程记录其电生理特征,以利于经验总结及科学研究。
本文为回顾性研究,样本量较小,临床效果中未加入日常生活能力、情绪与认知以及术后程控参数的比较,以上构成了本研究的局限性。未来的研究将纳入更多的病例,并更关注运动症状之外的术后短期及中长期预后指标。
综上所述,使用术中CT 做电极位置验证的全麻STN-DBS 手术与常规局麻手术相比用时更短,电极植入同样精准,在安全性及术后运动症状改善效果等方面未发现显著差别,对不能耐受局麻手术的患者可作为常规手术方案。
利益冲突所有作者均声明不存在利益冲突

