CT影像组学对中轴骨脊索瘤与骨巨细胞瘤的鉴别诊断价值
聂佩,郝大鹏,王宁,杨光杰,颜蕾,苗文杰,段绍峰,左盼莉,徐文坚
脊索瘤和骨巨细胞瘤是中轴骨较常见的原发性骨肿瘤。脊索瘤为低度恶性肿瘤,骨巨细胞瘤多为良性病变,部分表现为交界性和恶性特征[1,2]。根据2020版NCCN《骨肿瘤临床实践指南》,脊索瘤推荐广泛手术切除联合放疗,而骨巨细胞瘤推荐手术切除或地舒单抗治疗[3],术前正确诊断对治疗方案的选择至关重要。脊索瘤与骨巨细胞瘤的临床症状相似,术前鉴别诊断主要依靠X线、CT、MRI等影像学检查方法,但两者影像上均表现为溶骨性骨质破坏,密度/信号多不均匀,可伴囊变、钙化或残留骨等,传统影像学鉴别困难[4]。影像组学将高通量提取的影像中的量化特征转化为可挖掘的数据信息,建立预测模型辅助临床决策[5]。本文旨在探讨基于CT的影像组学对中轴骨脊索瘤与骨巨细胞瘤的鉴别诊断价值。
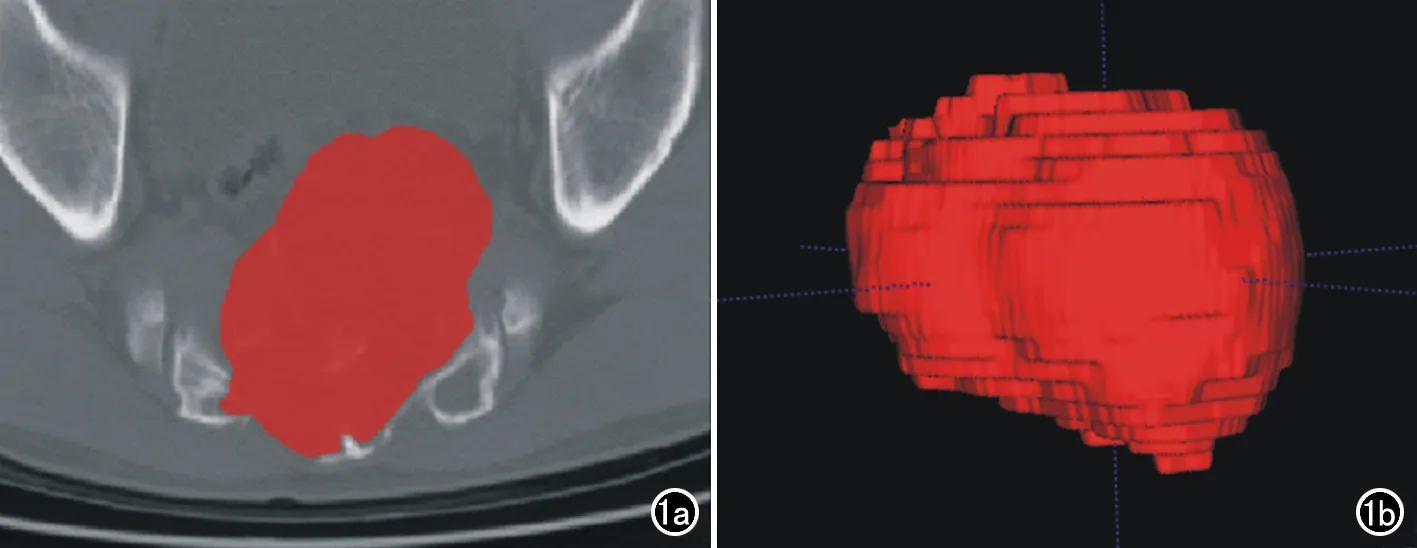
图1 肿瘤3D ROI勾画。a)肿瘤横轴面2D ROI勾画;b)2D ROI融合成3D ROI。
材料与方法
1.研究对象
回顾性纳入2010年7月-2020年7月青岛大学附属医院及山东省立医院经病理证实的中轴骨脊索瘤患者59例(男34例,女25例,年龄25~83岁,中位年龄59岁)和骨巨细胞瘤患者33例(男11例,女22例,年龄19~62岁,中位年龄33岁)。病例纳入标准如下:①经手术病理证实;②术前2周内行CT平扫且图像质量满足诊断要求;③术前未行治疗。青岛大学附属医院64例(脊索瘤41例,骨巨细胞瘤23例)作为训练集,山东省立医院28例(脊索瘤18例,骨巨细胞瘤10例)作为验证集。本研究经医院伦理委员会批准通过。
2.检查方法
CT扫描采用64层螺旋CT(Somatom Sensation 64,Siemens Healthcare;Discovery 750,GE Healthcare),球管旋转时间为0.5 s,管电压120 kV,管电流200 mAs或250~400 mA(自动管电流调节技术),探测器准直64×0.6 mm、64×0.625 mm,矩阵512×512,螺距1、1.375,层厚5 mm,层间距5 mm,采用骨及软组织算法重建。
3.临床特征与CT征象分析
由两位分别有6年(医师1)及5年(医师2)CT诊断经验的医师独立分析以下征象:位于中轴骨两端(即斜坡和骶尾骨,是/否)、单/多中轴骨受累、椎间盘受累(是/否)、邻近非中轴骨受累(是/否)、膨胀性生长(是/否)、最大径(mm)、密度均匀(是/否)、钙化或残留骨(有/无)、骨壳完整(是/否)、硬化边(有/无)、软组织肿块(有/无),两者意见不一致时通过协商达成一致意见。采用单因素分析患者年龄、性别及以上CT征象的组间差异,经Logistic多因素回归分析获得独立临床鉴别因素,计算OR值及95%CI。
4.CT图像分割、影像组学特征提取及组学模型建立
医师1和医师2采用ITK-SNAP软件(Version 3.8,www.itksnap.org)独立逐层手工勾画病灶边界,获得病灶3D容积ROI(图1)。本研究纳入的病例采用2种不同的检查设备,扫描参数不同,为减少图像差异的影响,首先对图像进行重采样及灰度标准化等预处理,之后提取影像组学特征,并计算观察者自身及观察者间的组内相关系数(intraclass correlation coefficient,ICC)。随机抽取20例,由医师1勾画ROI 1次,1周后再进行第2次ROI勾画,用于评估观察者自身ICC;医师2仅进行1次ROI勾画,用于评价与医师1之间的ICC。ICC>0.75认为一致性好。
采用影像组学云平台(Huiying Medical Technology Co.,Ltd)共提取1409个影像组学参数,分为强度特征、形状特征、纹理特征和图像滤波特征4组。为了避免组学标签的过拟合,采用以下步骤进行降维:首先,保留观察者间及观察者自身ICC均>0.75的稳定且重复性好的组学特征;其次,将筛选出的组学特征纳入LASSO回归模型,经10倍交叉验证选择模型中的最优调和参数λ获得压缩模型系数,建立影像组学模型,并计算影像组学得分(Rad-score)。
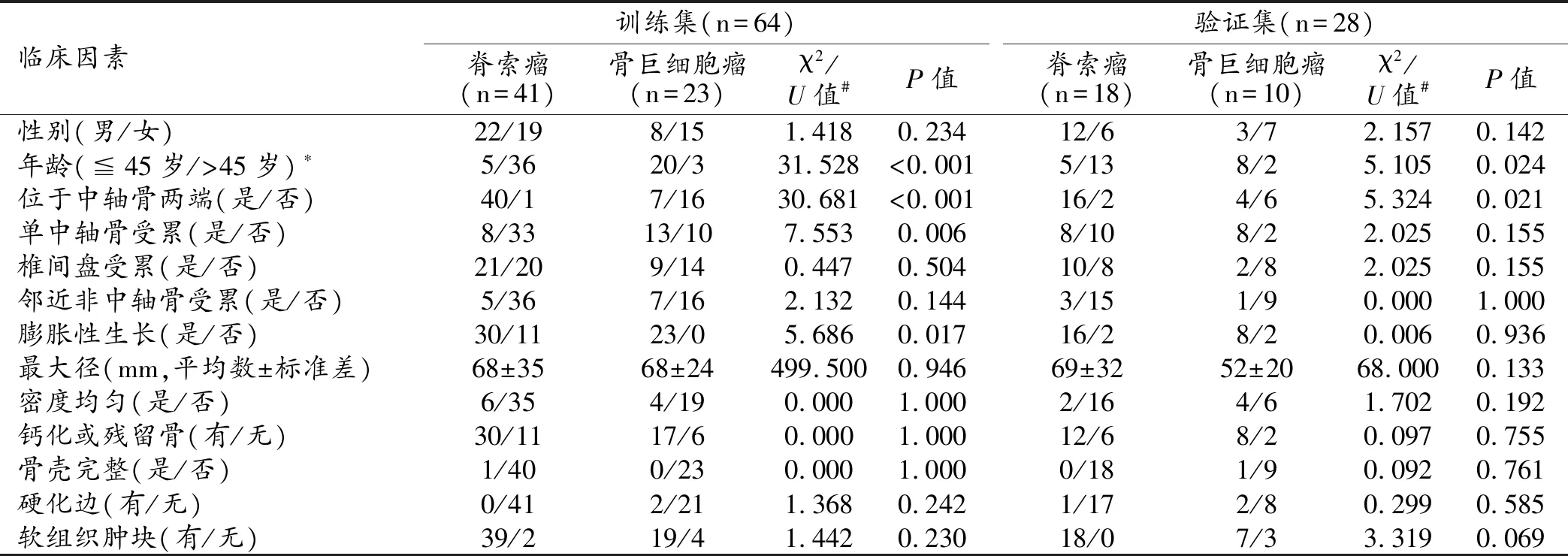
表1 中轴骨脊索瘤与骨巨细胞瘤患者的临床因素

表2 组学模型、组学联合临床因素的综合模型对骨巨细胞瘤的诊断效能
5.影像组学综合模型建立及效能验证
将独立的临床鉴别因素联合Rad-score建立综合模型,并绘制列线图。采用Hosmer-Lemeshow拟合优度检验评价列线图的拟合度。以受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under curve,AUC)分析模型的鉴别效能,以决策曲线(decision curve analysis,DCA)评价模型鉴别中轴骨脊索瘤与骨巨细胞瘤的净获益。
6.统计学分析
采用SPSS软件(Version 25.0,IBM)进行组间单因素分析(包括卡方检验和Mann-WhitneyU检验),采用R语言软件(Version 3.3.3,https://www.r-project.org)进行多因素Logistic回归分析、ICC、LASSO回归分析、ROC、Hosmer-Lemeshow检验、Delong检验和DCA分析。以P<0.05为差异有统计学意义。
结 果
1.临床特征和CT征象分析
训练集和验证集临床因素见表1。多因素Logistic回归分析结果显示,年龄(P<0.001)和位于中轴骨两端(P=0.003)是鉴别中轴骨脊索瘤与骨巨细胞瘤的独立预测因素。45岁以下 (OR:0.040,95% CI:0.010~0.260) 、发生于非中轴骨两端 (OR:0.020,95% CI:0.000~0.290) 更倾向于诊断为骨巨细胞瘤。
2.影像组学模型
CT图像提取的1409个组学特征中,1083个特征一致性好(观察者内及观察者间ICC>0.75),经LASSO回归模型分析,最终筛选出7个组学特征,建立组学模型(图2),得到Rad-score公式:
Rad-score = -0.080×wavelet_LLL.glszm.LowGrayLevelZoneEmphasis-0.319×wavelet_LLL.glszm.ZoneVariance+0.616×wavelet_LLH.glcm.JointAverage+0.847×wavelet_HLL.firstorder.Maximum-0.648×wavelet_LHH.firstorder.Median+0.153×wavelet_LLH.firstorder.Median+0.216×wavelet_LLL.firstorder.InterquartileRange -0.680。
3.综合模型建立及效能验证
将年龄、位于中轴骨两端和Rad-score进行Logistic多元回归分析并建模,得到综合模型,并绘制列线图(图3)。列线图的Hosmer-Lemeshow检验差异无统计学意义(训练集P=0.767,验证集P=0.895),提示模型未偏离拟合。组学模型、综合模型的鉴别诊断效能见表2。训练集和验证集中两个模型的ROC曲线见图4。训练集中,综合模型AUC优于组学模型(Z=2.092,P=0.036);验证集中,两模型AUC差异无统计学意义(Z=1.226,P=0.220)。决策曲线(图5)显示综合模型高于组学模型,提示其鉴别中轴骨脊索瘤与骨巨细胞瘤具有更高的临床净获益。
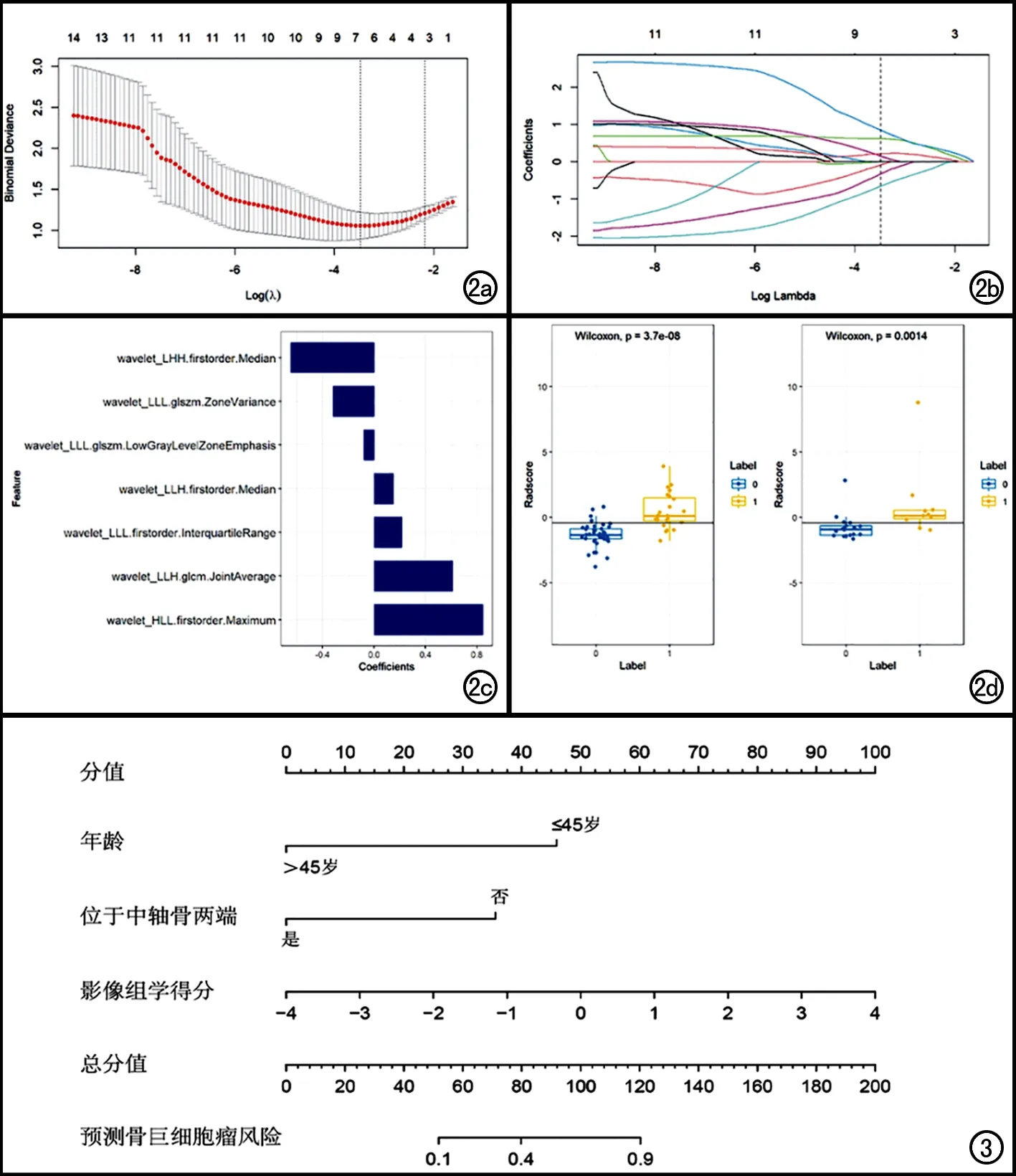
图2 组学模型。a、b)采用LASSO回归模型筛选组学特征;c)筛选出7个组学特征及其对应系数的绝对值;d)训练集和验证集中每例患者的影像组学得分(Rad-score),注:图中0为脊索瘤;1为骨巨细胞瘤。 图3 基于年龄、位于中轴骨两端联合影像组学得分构建综合模型列线图。
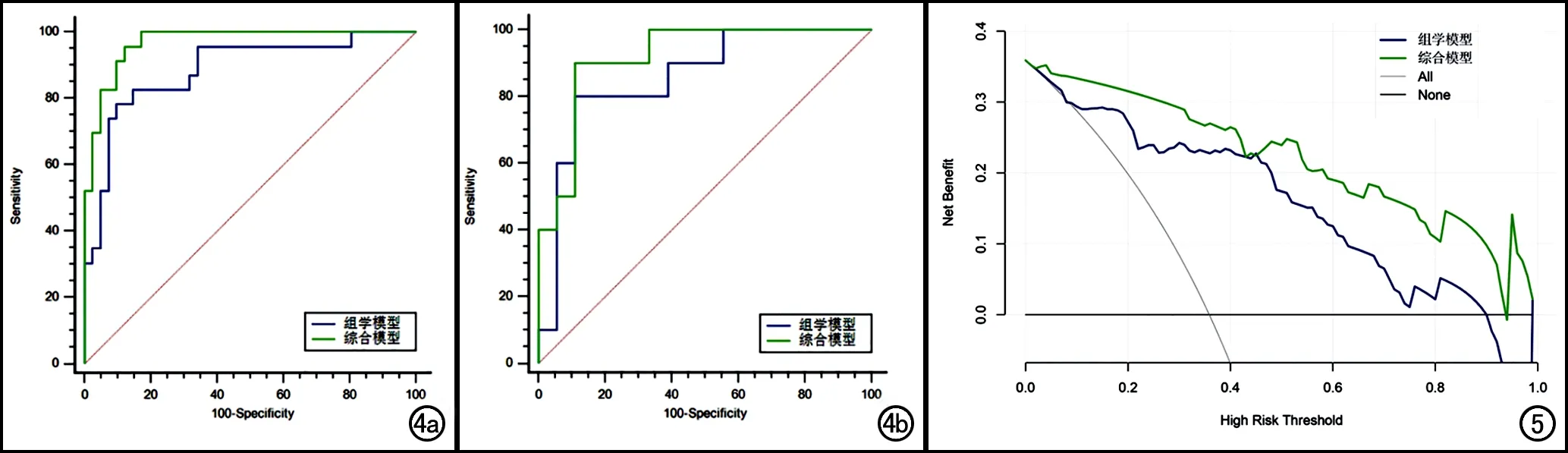
图4 训练集和验证集中组学模型与综合模型的ROC曲线。a)训练集;b)验证集。 图5 组学模型和综合模型的决策曲线,Y轴和X轴分别代表净获益和阈概率。
讨 论
脊索瘤是起源于胚胎时期残余脊索的低度恶性骨肿瘤,占所有恶性骨肿瘤的1%~4%,好发于50~60岁男性,以中轴骨的两端最为多见。近年来,发生于活动节段脊索瘤的报道也日益增多[6]。骨巨细胞瘤好发于四肢长骨的骨端,以20~40岁女性多见[7]。中轴骨骨巨细胞瘤少见,占所有骨巨细胞瘤的2.5%~5.6%[8]。脊索瘤与骨巨细胞瘤的生物学行为及治疗方案不同,术前准确诊断至关重要。本研究建立了基于临床特征和CT影像组学的综合模型,发现该模型对于中轴骨脊索瘤与骨巨细胞瘤的鉴别效能较高,训练集及验证集AUC分别为0.970、0.920。
既往研究表明,定性和定量影像有助于脊索瘤与骨巨细胞瘤的鉴别。Tsuji等[9]比较了9例脊柱骨巨细胞瘤与9例脊索瘤的临床特征、CT和MRI征象,发现年龄、部位、骨质破坏方式、T2信号、骨性间隔、骨包壳等在两组间差异有统计学意义,基于以上6个因素构建的评分系统有助于两者的鉴别。Si等[10]分析了22例骶骨脊索瘤与19例骶骨骨巨细胞瘤的临床及影像特征,发现年龄、部位、残存骨、囊变、出血、骨分隔、膨胀性骨破坏、肌肉及骶髂关节侵犯等征象可作为鉴别诊断依据。朗宁等[8]对13例中轴骨脊索瘤与17例中轴骨骨巨细胞瘤的MR动态增强定量参数进行比较,发现骨巨细胞瘤的转运常数(Ktrans)和速率常数(Kep)均显著高于脊索瘤,利用Ktrans和Kep诊断骨巨细胞瘤的AUC分别为0.826和0.980。汤文瑞等[11]分析了15例骶骨脊索瘤与16例骶骨骨巨细胞瘤的DWI和动态增强MRI(dynamic contrast enhanced -MRI,DCE-MRI)表现,发现ADC值、最大对比增强率、增强峰值等定量参数有助于两者的鉴别。本研究纳入了59例中轴骨脊索瘤与33例骨巨细胞瘤,分析患者年龄、性别、位于中轴骨两端、单/多中轴骨受累、椎间盘受累、邻近非中轴骨受累、膨胀性生长、最大径、密度均匀、钙化或残留骨、骨壳完整、硬化边和软组织肿块等13个临床因素,发现年龄和位于中轴骨两端是鉴别中轴骨脊索瘤与骨巨细胞瘤的独立临床预测因素,45岁以上、位于中轴骨两端的肿瘤更倾向于脊索瘤,与既往部分研究结果一致,脊索瘤发病部位的特殊性可能与胚胎残留脊索组织的分布有关。
影像组学在骨肿瘤研究中应用广泛[12],包括不同病理类型及病理亚型的骨肿瘤鉴别[13,14]、疗效评价[15,16]、预后预测[17,18]等。既往研究表明,基于影像组学定量分析对骶骨脊索瘤与骨巨细胞瘤具有良好的鉴别效能。Yin等[19]运用3种特征选择方法(Relief、LASSO、随机森林[RF])和3种分类法(广义线性模型[GLM]、支持向量机[SVM] 、RF)对基于CT图像的53例骶骨脊索瘤与42例骶骨骨巨细胞瘤进行鉴别,发现LASSO联合GLM的鉴别诊断效能最高,AUC为0.984。Yin等[20]还分析了83例骶骨脊索瘤与54例骶骨骨巨细胞瘤的临床特点和基于CT、MRI的影像组学特征,发现基于CT的临床-组学模型鉴别诊断效能优于MRI组学模型,AUC达0.948。另外,基于MRI的影像组学模型还有助于鉴别骶骨脊索瘤、骨巨细胞瘤和转移瘤[21]。本研究最终筛选出7个经小波变换的强度特征和纹理特征用于构建组学模型,该模型能有效鉴别中轴骨脊索瘤与骨巨细胞瘤,训练集和验证集的AUC分别为0.890、0.860。与传统影像学只能提供肿瘤大小、形态、密度或信号等大体信息不同,影像组学特征能从微观上反映肿瘤的异质性,与肿瘤组织学成分及分化程度密切相关,因此能够有效地辅助鉴别诊断。
在既往研究的基础上,本研究在课题设计和方法上做了以下优化:首先,选择中轴骨脊索瘤和骨巨细胞瘤作为研究对象,扩展了鉴别诊断模型的适用范围;其次,分析了两组患者的临床特点和十余个CT征象,筛选出年龄和发病部位两个独立的临床预测因素,这是对传统影像征象的总结和比较,更贴近临床应用;第三,基于3DROI进行特征提取,与以往基于肿瘤最大层面勾画的二维ROI相比,能更充分地反映肿瘤整体的异质性[22];第四,将组学得分联合临床因素构建了综合模型,并以列线图的形式直观地表达出来,发现列线图的鉴别效能优于组学模型,提示影像组学联合临床因素更有助于中轴骨脊索瘤与骨巨细胞瘤的鉴别。
本研究存在一定的局限性:首先,本研究为双中心回顾性研究,样本量较小,检查参数不一,部分病例的病理亚型和分化程度信息不全,模型效能有待多中心、大样本、前瞻性研究进一步验证;其次,3DROI勾画工作量大,期待基于深度学习的半自动或自动勾画方法;第三,影像组学特征与肿瘤异质性及生物学行为的确切关联不明,有待于影像基因组学研究进一步探索。
综上所述,基于CT影像组学联合临床特征建立的综合模型对术前鉴别中轴骨脊索瘤与骨巨细胞瘤具有较高的诊断效能,有助于临床决策。