牛多杀性巴氏杆菌的分离鉴定与药敏试验
毛畅思,党 乔,魏 星,孔令聪,3*
(1.中国农业大学动物医学院,北京 100093;2.吉林农业大学动物科学技术学院,吉林长春 130118;3.动物生产及产品质量安全教育部重点实验室,吉林长春 130118;4.辽源市动物疫病预防控制中心,吉林辽源 136220)
牛呼吸系统疾病(Bovine respiratory disease,BRD)已成为制约肉牛养殖的主要因素,危害着世界各地养牛业的健康发展,据统计全球每年因BRD造成的经济损失高达3亿美元,其中英国每年约有190万头牛患BRD,死亡达15.7万头[1]。在我国该病主要发生在经外地引进的育肥牛中,老百姓称之为“烂肺病或运输热”,其发病率高达80%,单场病死率高达60%[2],给我国肉牛养殖业造成了巨大的经济损失,部分养殖户已不敢远距离运牛。引发BRD的病原主要为牛支原体(Mycoplasmabovis)、牛多杀性巴氏杆菌(Pasteurellamultocida,Pm)和溶血曼氏杆菌(Mannheimiahaemolytica,Mh),且部分混合感染的病例发病率和病死率更高[3]。时至今日,该病的发生并未减缓,相关研究推测其主要病原可通过肉牛的异地转运而发生传播,而我国“北牛南调,西牛东运”的肉牛育肥模式更为该病的发生和传播提供了便利的条件[4]。某牛场经异地引进牛后,多头牛发病,经抗菌药物治疗后并未好转,亟需对主要病原进行分离鉴定并对其药物敏感性进行检测。为此,本研究拟对某牛场运输后的患牛进行主要病原的分离鉴定,对药物敏感性、致病性进行了检测,进一步对分离菌进行脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)分型,以对其主要病原是否发生克隆传播进行确证,为我国BRD的防控提供了科学依据。
1 材料与方法
1.1 材料
1.1.1 病料 某肉牛养殖场经“北牛南调”的临床健康牛鼻腔拭子12份;运输后发生呼吸系统疾病死亡病死牛2头,无菌采集病死牛的心脏、肺脏和肝脏等脏器。
1.1.2 培养基与药品 所需培养基,中国青岛日水公司产品;PCR试剂、胶回收试剂等分子生物学试剂,宝生物工程(大连)有限公司产品;细菌基因组提取试剂盒,生工生物工程(上海)股份有限公司产品;环丙沙星、恩诺沙星、磺胺氯氰钠、四环素、氟苯尼考、替米考星、红霉素、克林霉素、新诺明等药品,中国兽医药品监察所产品;部分药品由康地恩生物有限公司惠赠。
1.1.3 实验动物 SPF级小鼠,体重20 g~25 g,购自吉林大学实验动物中心。
1.2 方法
1.2.1 临床症状检查 对运输后出现咳嗽、喘的病牛进行临床症状检查。
1.2.2 病例剖检 对运输后以咳嗽、喘为主要症状死亡的病牛进行剖检,观察主要脏器的病理变化,进一步制备病变较明显脏器的病理组织切片。
1.2.3 细菌学检查
1.2.3.1 分离培养 将采集的健康牛鼻腔拭子、病死牛肺脏接种于脑心浸液肉汤,置37 ℃温箱培养18 h后,再接种于脑心浸液固体培养基和鲜血琼脂平板,观察细菌生长情况,菌落形态,以及是否发生溶血。同时,将病料无菌研磨后接种于改良的PPLO培养基,观察其是否有牛支原体生长。
1.2.3.2 生化及分子生物学鉴定 分离菌的生化鉴定按常规方法进行。同时,采用16S rRNA引物和多杀性巴氏杆菌特异性引物kmt1及capA、capB、capD、capE、capF荚膜分型引物对疑似巴氏杆菌进行PCR扩增及荚膜分型。
1.2.3.3 致病性试验 采用改良寇氏法对分离的3株Pm进行LD50的测定。每株菌进行菌落计数,通过预实验设置浓度为104、105、106CFU/mL 3个剂量组,每个剂量组随机取8只小鼠,雌雄各半。每个剂量组腹腔注射不同梯度浓度菌液0.3 mL。每组小鼠隔离饲养,连续3 d观察死亡情况,计算LD50值。
1.2.3.4 药敏试验 采用2种方法对分离菌进行药物敏感性检测(微量肉汤稀释法和平皿二倍稀释法)。试验药物为环丙沙星、恩诺沙星、磺胺氯氰钠、四环素、氟苯尼考、替米考星、红霉素、克林霉素和新诺明等9种抗菌药物。每个试验重复3次。Pm的药物敏感性判定折点见表1。
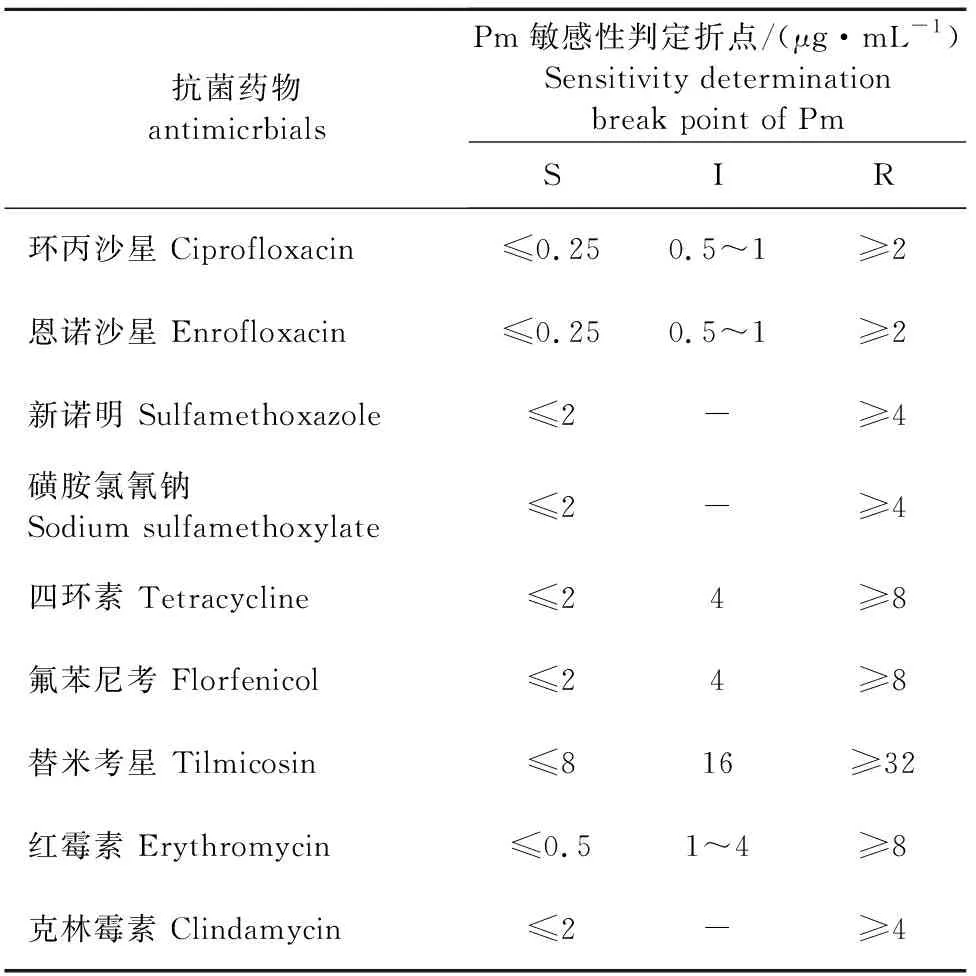
表1 Pm对部分抗菌药物敏感性判定折点
1.2.3.5 PFGE分型 参考Ahmed M.Moustafa等的方法,结合Pm脉冲场凝胶电泳试验方法、步骤对这3株分离菌进行分型[5]。
2 结果
2.1 临床症状观察
运输后共12头牛发生咳嗽、气喘等症状,食欲减退,反刍迟缓,体温升高达40 ℃~42℃,但病牛未出现跛行等症状。
2.2 病理剖检及切片观察
剖检可见肺脏病变最为明显,肺脏广泛出血,胸膜粘连,肺组织切面呈大理石样,胸腔可见纤维素样渗出。其他脏器未见异常。病理切片观察可见支气管及周围肺泡腔内腔充满大量中性粒细胞(图1A和图1B),肺泡腔扩张,肺泡腔及细支气管内散在炎性细胞浸润(图1C和图1D),以中性粒细胞为主。间质轻度增生。

A、B.100×;C、D.400×A,B.100×; C,D.400×
2.3 细菌学诊断
2.3.1 细菌形态及培养特性 病死牛的肺脏、心血触片瑞特染色镜检,可见两极浓染的短杆菌,革兰氏染色呈阴性。分离菌在脑心浸液培养基生长较好,菌落呈半透明露滴状;改良PPLO肉汤未见支原体生长。
2.3.2 生化及分子生物学鉴定 3株分离菌均能发酵葡萄糖、蔗糖、果糖、单奶糖和甘露糖,靛基质反应阳性,不能发酵鼠李糖、乳糖,V-P试验和H2S试验阴性。采用Kmt1引物对3株分离株进行鉴定,得到460 bp的片段,结果如图2所示,采用16S rDNA引物进行PCR扩增得到1 600 bp的目标片段,将目的片段纯化、连接、转化、筛选并测序,将测序结果用Blast软件与GenBank已登录序列进行比对分析,其与Pm的同源性高达99%,结果如图3所示;进一步以3株Pm抽提的基因组为模板,经荚膜分型多重PCR扩增,均扩增出1 000 bp左右的特异条带,其大小与capA相符,PCR结果如图4所示。因此可以判定分离的3株Pm为荚膜A型Pm,分别编号为TL0501-1、HN0510-1、HN0510-2。

M.DNA标准DL 1 000;1~3.TL0501-1、HN0510-1、HN0510-2;4.阳性对照M.DNA Marker DL 1 000; 1-3.TL0501-1,HN0510-1,HN0510-2; 4.Positive control

M.DNA标准DL 2 000;1.capA阳性对照;2.阴性对照;3-5.TL0501-1、HN0510-1、HN0510-2M.DNA Marker DL 2 000; 1.CapA positive control; 2.Negative control; 3-5.TL0501-1,HN0510-1,HN0510-2
2.3.3 小鼠致病性试结果 采用改良寇氏法测定了3株Pm的LD50,TL0501-1 LD50为1.4×105,HN0510-1 LD50为2.2×105,HN0510-2 LD50为2.6×105。剖检死亡小鼠,用瑞特染色镜检可见两极浓染的短杆菌。
2.4 分离菌的药物敏感性检测及分析
采用微量肉汤稀释法和平皿二倍稀释法对分离菌进行了常用药物的敏感性检测,结果如表2所示,3株分离菌药物敏感性相同,均对四环素、氟苯尼较敏感,对喹诺酮类、磺胺类、大环内酯类药物已呈不同程度耐药性。

表2 3株分离菌的MIC结果
2.5 脉冲场凝胶电泳分型
将3株牛A型Pm基因组酶切后进行PFGE电泳,根据条带数和所在位置,3株分离菌具具有同一谱型,证明3株菌属于同一克隆。

M.沙门氏菌H9812分子质量标准;1~3.分别为TL0501-1、HN0510-1、HN0510-2M.Salmonella H9812 molecular weight Marker; 1-3.TL0501-1,HN0510-1 and HN0510-2,respectively
3 讨论
近年来,随着世界肉牛产业的快速发展,牲畜的异地运输已成为生产过程中必不可少的环节,极大的提高了肉牛生产的效率,但育肥牛的运输作为一种压力源,已引发了经济和动物福利等多方面的担忧[6-7]。其中,BRD已被认为是经长途运输的育肥牛中多发的疾病,与BRD和运输应激之间的许多假设已被提出,相关研究认为,育肥牛在运输过程中经受的多重压力导致了整体免疫水平的降低,使许多病原体趁机入侵,最终导致疾病的发生[8-9]。
国内外相关科研工作者已对运输后BRD展开了研究,在国外,引发该病的主要病原主要为牛支原体、牛荚膜A型多杀性巴氏杆菌和睡眠嗜血杆菌等,其中混合感染病例较多[10-11]。我国BRD的主要病原与国外略有差异,在我国主要病原是牛支原体和多杀性巴氏杆菌,其他病原的混合感染并不多见[12]。本研究对某肉牛育肥场运输后的BRD进行跟踪调查,并对运输后健康牛鼻腔拭子和运输后因BRD死亡的2头病牛进行了剖检和病原分离,共分离到3株牛荚膜A型Pm,3株分离菌不但具有较强的小鼠致病性,还均具有同一基因型,证明其随着肉牛的运输发生了克隆传播。该研究未分离到牛支原体和溶血曼氏杆菌。
多杀性巴氏杆菌引发疾病主要依赖抗菌药物治疗,但大量研究表明,随着抗菌药物的使用,不同国家和地区的分离菌已对临床常用药物呈现了不同的耐药谱,为该菌引发疾病的治疗造成了困扰[13-15]。为此,本研究对3株分离菌进行了常用药物的敏感性检测,以期优化临床用药方案,结果显示分离菌耐药谱相同,3株菌均对新诺明、磺胺氯氰钠及克林霉素、环丙沙星、恩诺沙星呈现了不同程度的耐药性,仅对对替米考星、四环素和氟苯尼考较敏感。值得注意的是,该场分离菌已对喹诺酮类和大环内酯类药物产生了抗性,而该2类药物是兽医临床治疗BRD的首选药。总之,通过该研究证明引发BRD的主要病原可随育肥牛的异地运输而发生传播,为此建议在育肥牛运输之前,应采用敏感药物对BRD进行预防性治疗。根据引发BRD病原菌及其对临床常用药物产生耐药性的特点,我们进一步对该病主要病原菌进行跟踪监测,及时筛选出敏感药物,已达到针对性治疗的目的,防止因病原菌耐药性产生而造成的抗感染失败。