绵羊肺炎支原体对肺上皮细胞自噬影响的研究
罗海霞,孙远航,徐兆坤,冯婷婷,郝秀静,李 敏
(宁夏大学生命科学学院西部特色生物资源保护与利用教育部重点实验室,宁夏 银川 750021)
绵羊肺炎支原体(Mycoplasma ovipneumoniae,MO)可引起绵羊及山羊传染性胸膜肺炎(非典型性肺炎)[1],表现为高热、喘气、咳嗽、贫血、渐进性消瘦、生长发育迟缓、胸膜炎及纤维性肺炎等临床症状[1-2]。该病分布广泛,给养羊业造成重大的经济损失。研究表明支原体能够黏附到绵羊肺脏细胞,并对宿主细胞造成极大危害[3-4],但宿主细胞与MO 感染的关系仍不明确。
细胞自噬(Autophagy)是真核生物中维持细胞内环境稳态的一种降解途径[5],可降解细胞内的衰老细胞器和长寿蛋白,也可降解侵入性病原体[6]。在细胞的生存、抗感染免疫等方面起着重要作用[7]。研究发现解脲支原体感染细胞可以诱导细胞自噬,并且可以利用宿主细胞膜隔室(Host cellular membrane compartments)逃避宿主细胞的自噬和免疫损伤[5-8];肺炎支原体可通过黏附细胞诱导自噬炎性反应[9]。目前关于MO 能否引起细胞自噬尚无报道,基于此本研究检测MO 感染TC-1 细胞后自噬相关基因的转录及蛋白的表达水平、自噬流的形成及干扰自噬后MO 在细胞内的增殖情况,对MO 诱导TC-1 细胞的自噬进行初步探究,为进一步揭示MO 的感染机制提供研究思路,进而为治疗该病提供参考依据。
1 材料与方法
1.1 主要实验材料支原体肉汤培养基购自Hope⁃bio 生物技术有限公司;TAE 缓冲液(10×)购自Com⁃Win Biotech 生物科技有限公司;RNAsimple Total RNA Kit 购自北京TIANGEN 有限公司;SYBR®Pre⁃mix ExTaqTMII 和PrimeScripTMMaster Mix 购 自TaKaRa公司;胰蛋白酶(Trypsin-EDTA)、胎牛血清(FBS)、DMEM 购自Hyclone 公司;全蛋白提取试剂盒购自江苏凯基生物公司;蛋白BCA 定量检测试剂盒购自赛默飞生物公司;小干扰RNA 转染试剂SiRNA-Mate购自吉玛基因生物公司;anti-P62、anti-LC3、anti-Atg7、anti-β-actin 抗体购自Cell Signalling Technolo⁃gy 公司;HRP 标记的山羊抗兔IgG 购自Proteintech Group 公司;自噬双标腺病毒(mRFP-GFP-LC3)、P62-siRNA、Atg7-siRNA 购自上海汉恒生物科技有限公司;蛋白Marker、ECL 化学发光试剂购自PageRuler 公司。
1.2 细胞系、MO 及其培养方法小鼠肺上皮细胞(TC-1)购自American Type Culture Collection 公司,在含10%胎牛血清的DMEM 中,置于37 ℃,5% CO2培养成单层细胞。MO 标准株Y98(MO-Y98)由宁夏大学西部特色生物资源保护与利用教育部重点实验室保存。在超净工作台内取5 mL MO 按1∶5 比例加入25 mL 新鲜配制的MO 液体培养基(支原体基础培养基含10%灭活小牛血清),置于37 ℃,5% CO2中培养,4 d~7 d 观察颜色变化,当颜色明显由红色变为澄黄色时,传代。
1.3 MO 感染TC-1 细胞自噬相关基因的转录水平检测根据NCBI 登录的小鼠mRNA 序列,利用Primer Premier 5.0 设计扩增目的基因的引物,由上海生工生物工程技术服务有限公司合成(表1)。待12 孔板中的TC-1 细胞密度达70%以上时,以感染复数(MOI)10 的MO 感染TC-1 细胞,收集感染前、感染后6 h、12 h、24 h 的细胞提取总RNA 并反转录为cDNA 为模板,利用SYBR Premix ExTaqTMIIS试剂盒检测LC3I、LC3II、P62、Atg7基因在感染后各时间点的转录水平,设未感染MO的TC-1细胞为对照。

表1 自噬相关基因检测的qRT-PCR 引物Table 1 The primers for qRT-PCR
1.4 MO 感染TC-1 细胞后自噬相关蛋白的检测利用上述方法将MOI 10 的MO 感染TC-1 细胞。收集感染前、感染后6 h、12 h、24 h 的细胞,利用细胞蛋白提取试剂盒提取总蛋白并通过BCA 试剂盒定量。取感染后不同时间点的100 μg 蛋白上样,经SDS-PAGE 分离,转膜,封闭后,分别孵育抗LC3(1∶1 000)、P62(1∶1 000)、Atg7 抗体(1∶1 000)为一抗,以HRP 标记的山羊抗兔IgG(1∶10 000)为二抗,经western blot 检测自噬相关蛋白LC3II、P62、Atg7 的表达水平,并通过Image J 软件对western blot结果进行灰度值分析。
1.5 MO 感染TC-1 细胞后细胞自噬流的检测将1×105个/mL TC-1细胞接种12孔细胞培养板,37 ℃5%CO2过夜培养后加入腺病毒mRFP-GFP-LC3(MOI 20),转染24 h 后将MO 以MOI 10 感染细胞,分别于感染后6 h、12 h、24 h 固定细胞、封片。设腺病毒mRFP-GFP-LC3转染的不感染MO的细胞对照组(Con⁃trol)。由于GFP 蛋白对酸性敏感,在自噬溶酶体中荧光会迅速淬灭,而RFP是一种耐酸性的荧光,因此以mRFP-GFP-LC3追踪自噬流。利用JEM-2100F荧光显微观察GFP、RFP的表达情况,并利用Image J 软件分析细胞内荧光斑点的数量分别作图统计分析细胞内绿色及红色斑点数量,同时以绿色和红色叠加图中的黄色与红色荧光图的斑点数量作图分析MO 感染TC- 1 细 胞 后 是 否 形 成 自 噬 流 。
1.6 siRNA 沉默P62、Atg7 基因表达效果的检测P62 和Atg7 siRNA 序列由上海吉玛公司设计并合成(表2)。在100 μL 无血清的1640 中分别加入3 μL 1 μmol/L siRNA-p62 和siRNA-Atg7 溶 液 后,加 入1 μL 1 μmol/L siRNA 储存液,混匀,室温放置5 min。再将2 μL 试剂盒中的siRNA-Mate 加到上述混合液中,室温放置10 min,以形成siRNA oligo-siRNAmate 复合物。待12 孔板中的TC-1 密度达75%时,将siRNA oligo-siRNA-mate 复合物缓慢加入细胞培养孔中,混匀,37 ℃5% CO2培养48 h,经1.4 的west⁃ern blot 检测P62 和Atg7 蛋白的表达水平,同时设空白对照(Control)、阴性对照-siRNA 对照组(NC)。利用灰度值做图分析TC-1 细胞中各siRNA 对P62 和Atg7 基因表达的沉默效果。
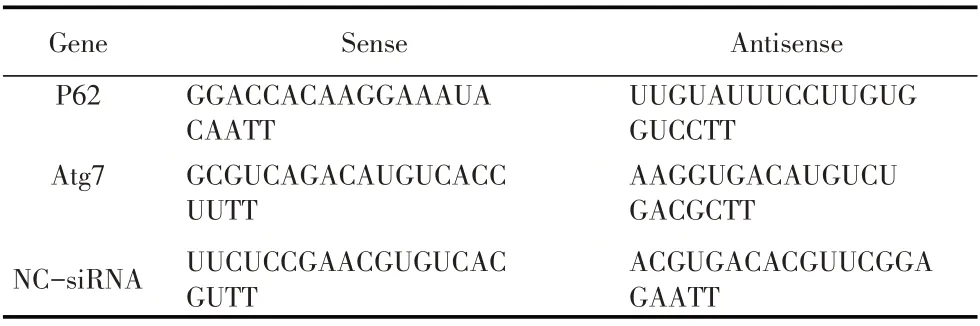
表2 siRNA 序列Table 2 The sequence of siRNA
1.7 MO 感染P62、Atg7 基因沉默后的TC-1 细胞中自噬相关蛋白LC3II 表达水平的检测按照1.6 的步骤分别转染siRNA-P62、siRNA-Atg7 36 h 后,将MO 以MOI 10 感染细胞12 h,提取细胞总蛋白经1.4的western blot 检测LC3II 的表达水平。设阴性对照siRNA+MO(NC+MO)和未感染的细胞对照(Control)。
1.8 P62 和Atg7 基因沉默后TC-1 细胞中MO 增殖能力的检测变色单元(Colour change unit,CCU)用于计算支原体的相对含量。以MOI 10 的MO 感染TC-1 细胞,收集感染后6 h、12 h、24 h、48 h 的细胞,PBS 洗3 次,重悬,静置30 min。取12 支无菌EP 管分别标号,在每支管中加入900 μL 支原体肉汤培养基。将100 μL 细胞裂解液加入到第1 号EP管中,依次做10 倍倍比稀释至11 号管,第12 号管为阴性对照。将12 支管置37 ℃培养7 d~8 d,以最后一支由红色变为黄色作为待测试MO 的CCU,统计分析MO 感染TC-1 细胞后的活菌数。按照1.6 的方法沉默P62 和Atg7 基因后,利用MOI 10 的MO 感染,12 h 后采用上述CCU 试验检测基因沉默后TC-1细胞中MO的活菌数。设NC+MO的细胞为阴性对照。
1.9 数据分析所有数据均采用SPSS17.0 软件中的One-Way ANOVA 进行统计学分析,*为差异显著(0.01<p<0.05),**为差异极显著(p<0.01)。
2 结 果
2.1 MO 感染TC-1 细胞后自噬相关基因的检测结果为确定MO 对TC-1 细胞自噬的影响,利用荧光定量PCR 检测MO 感染TC-1 细胞后不同时间自噬相关基因的转录水平。结果显示,与对照组相比,MO 感染TC-1 细胞后6 h、12 h、24 h 时的自噬相关基因LC3I、LC3II、P62 及Atg7 的转录水平均呈现升高趋势,在MO 感染6 h 时上述自噬相关基因的转录水平均达到最高,与感染前相比,转录水平分别上升1.8 倍(p<0.01)、1.5 倍(p<0.05)、1.6 倍(p<0.05)和2.3 倍(p<0.01)(图1)。表明MO 感染能引起TC-1 细胞中自噬相关基因的转录水平升高,从基因水平表明MO 感染可诱导TC-1 细胞自噬。
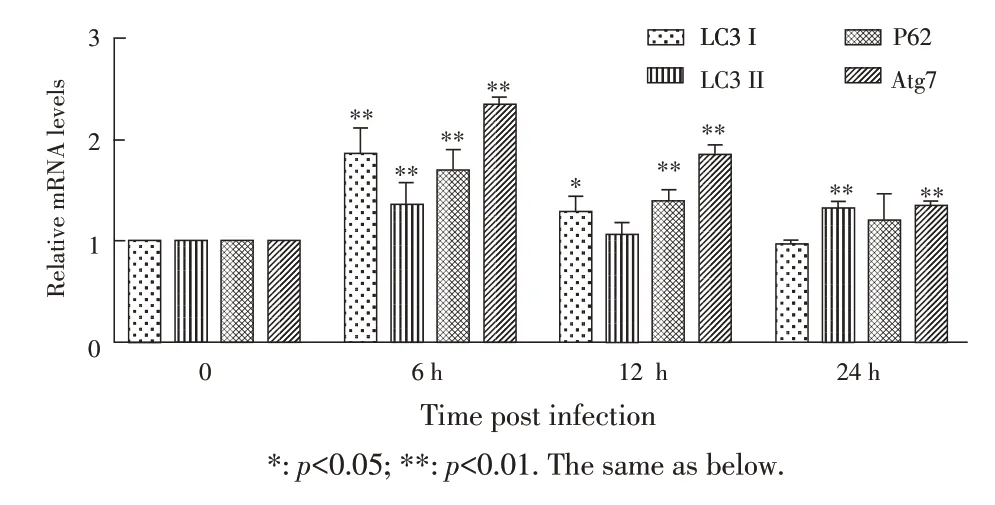
图1 MO 感染后不同时间TC-1 细胞自噬相关基因转录水平的检测结果Fig. 1 mRNA levels of autophagy-related genes in TC-1 after infected with MO
2.2 MO 感染TC-1 细胞后自噬相关蛋白的检测结果LC3I脂质化形式LC3II,它可以附着到自噬体的膜上,是自噬体的结构蛋白。MO 感染TC-1 细胞6 h、12 h、24 h 后经western blot 检测自噬相关蛋白的表达水平。结果显示,感染MO 的TC-1 细胞自噬相关蛋白LC3II、P62 及Atg7 的表达水平与感染前相比均明显升高(图2A);利用GraphPad Prism 7做的柱状图结果显示,与感染前相比,MO 感染6 h 时TC-1 细胞自噬相关蛋白Atg7、P62、LC3II 表达量分别上升1.4倍(p<0.01)、1.2 倍(p<0.05)、2.1 倍(p<0.05),感染12 h 时自噬相关蛋白的表达量最高,与感染前相比分别增加2.4 倍(p<0.01)、5.8 倍(p<0.05)、3.1 倍(p<0.05)。感染24 h自噬相关蛋白的表达量较12 h 呈下降趋势(图2B~2D)。以上结果从蛋白水平表明MO 感染可诱导TC-1 细胞自噬。
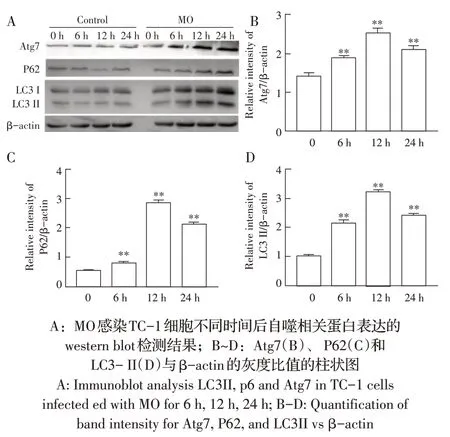
图2 MO 感染TC-1 细胞后不同时间自噬相关蛋白表达的检测结果Fig. 2 Expression of Atg7, P62 and LC3II in TC-1 cells at different points post-infection with MO
2.3 MO 感染对TC-1 细胞形成自噬流的检测结果将mRFP-GFP-LC3 感染TC-1 细胞,24 h 后感染MO,感染后不同时间通过荧光显微镜观察荧光,并利用Image J 软件统计分析细胞内绿色及红色斑点的数量并作图,并统计分析叠加后细胞内的黄色斑点和红色斑点的数量并作柱状图。红绿荧光叠加后出现的黄色荧光即是自噬体,红色的斑点指示自噬溶酶体。结果显示,与未感染MO 的细胞(Control)相比, MO 感染后的TC-1 细胞具有更多的黄色和红色斑点(p<0.05),并且随着感染时间的延长黄色和红色斑点增多(图3A、3B)。以上结果表明MO 感染可诱导TC-1 形成完整的自噬流,且随着感染时间的延长,形成的自噬流越强。

图3 MO 感染TC-1 细胞后不同时间点自噬流的检测结果Fig. 3 The formation of autophagic flux in TC-1 cells at different time points post-infection with MO
2.4 siRNA 沉默P62、Atg7 基因表达效果的检测结果分别将siRNA-P62、siRNA-Atg7 转染TC-1,设置空白对照组(Control)和阴性siRNA 转染组(NC),经western blot 检测P62 和Atg7 蛋白的表达水平,并经灰度值分析各siRNA 沉默P62、Atg7 基因表达的效果。结果显示,转染siRNA-P62、siRNA-Atg7 的TC-1 细胞中P62、Atg7 蛋白表达量均显著低于Control 组或NC 组,表达量均降低约50%(图4,p<0.01)。表明siRNA-P62、siRNA-Atg7的沉默效果良好。

图4 P62 和Atg7 基因沉默效果的western blot(A)及灰度分析(B)结果Fig. 4 Western blot (A) and relative gray analysis (B) of silence efficiency of P62 and Atg7
2.5 MO 感染P62、Atg7 基因沉默后的TC-1 细胞中自噬相关蛋白LC3II 表达水平的检测结果将MO分别感染经siRNA-P62 和siRNA-Atg7 转染的TC-1细胞,12 h 后经western blot 检测LC3II 蛋白的表达。结果显示,P62 和Atg7 基因沉默后,与NC+MO组相比, TC-1 细胞中LC3II 的表达水平显著降低(p<0.01),与未做任何处理的TC-1(Control)相比,P62 和Atg7 基因沉默后,TC-1 中LC3II 的表达水平无差异(图5)。表明分别沉默P62 基因和Atg7 基因后,LC3II 的表达量减少说明LC3I 向LC3II 的转变均受到抑制,从而抑制MO 感染所致的细胞自噬。
2.6 P62、Atg7 基因沉默后TC-1 细胞中MO 增殖能力的检测结果利用CCU 试验检测MO 感染TC-1细胞后不同时间的活菌数。结果显示,MO 可以在巨噬细胞中存活并增殖,与感染6 h 相比,感染24 h 和48 h 后,MO 在胞内的活菌数均明显增加(p<0.05)(图6A);同时检测MO 感染P62 和Atg7 基因沉默后的TC-1 细胞12 h 后的活菌数。结果显示,与NC+MO 组相比(104),分别沉默P62 和Atg7 基因后MO在胞内的活菌数均明显增加(105,p<0.05)(图6B)。上述结果表明TC-1 细胞自噬对MO 在胞内的存活和增殖起到一定的抑制作用。
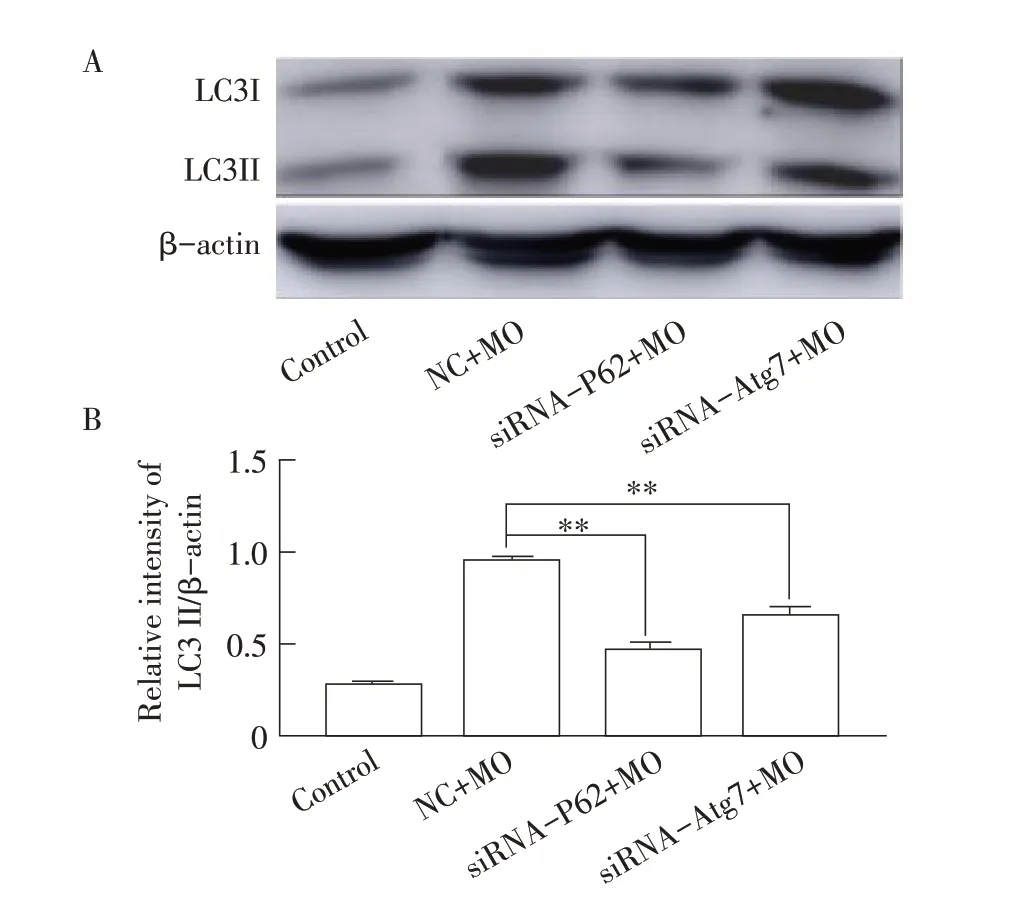
图5 MO 感染P62、Atg7 基因沉默细胞中LC3II 蛋白表达的western blot 检测(A)和灰度分析(B)结果Fig. 5 Western blot (A) and relative gray analysis (B) of LC3II expression in TC-1 cells with P62 and Atg7 suppressed by siRNA

图6 MO 分别感染TC-1 细胞(A)及P62、Atg7 基因沉默后TC-1 细胞(B)中MO 活菌数的检测结果Fig. 6 MO Intracellular proliferation inTC-1 cells (A) and MO intracellular proliferation in P62 and Atg7 suppressed TC-1 cells (B)
3 讨 论
MO 是绵羊支原体肺炎的主要致病菌,能引起绵羊慢性呼吸道疾病,给养羊业造成重大的经济损失。MO 可附着于绵羊肺泡巨噬细胞质膜[10],通过释放毒素造成细胞损伤[9]。目前关于MO 的研究多集中于对该病菌致病因子的研究,对其与宿主细胞互作的报道较少。细胞自噬在抵抗病原微生物中发挥重要的作用[7]。自噬可以通过自噬溶酶体清除病原微生物的感染,而有些病原微生物可以利用细胞自噬为其在细胞内的存活提供物质和场所[5-7]。但MO 感染对细胞自噬的作用尚未见报道。本研究以TC-1细胞为研究对象,探究MO 与该细胞自噬的关系及细胞自噬对MO 增殖的影响。
LC3、P62 和Atg7 基因是细胞自噬的关键基因[11-12]。其中LC3 是研究最为深入的自噬标志分子。LC3 是可溶性胞质蛋白,Atg4 能够切除LC3 羧基端22 个氨基酸露出甘氨酸而变成LC3I 以前体形式游离于胞质中[12]。然后通过Atg7 和Atg3 催化LC3I与磷脂酰乙醇胺PE 结合,形成LC3II[13-14]。P62 可以将LC3 蛋白连接到自噬前体而促进自噬体的成熟[15]。Atg7 在细胞自噬形成的早期和在自噬泡的形成中起重要作用[12]。本研究将MO 感染TC-1 细胞后,利用RT-PCR、western blot 检测显示,LC3II、P62 及Atg7 的转录和表达水平均显著升高,表明MO的感染能引起TC-1 细胞自噬;进一步通过转染串联荧光蛋白的腺病毒,经荧光显微镜观察并统计分析结果表明MO 可引起TC-1 形成完全的自噬流。
RNA 干扰(siRNA)技术具有高度特异性、高效、易操作等优点,被广泛应用于基因功能的研究。细胞自噬领域通过siRNA 沉默相关基因表达以抑制细胞自噬的发生。本研究分别通过siRNA-P62及siRNA-Atg7 沉默TC-1 细胞中的P62 和Atg7 基因后感染MO,利用western blot 检测细胞中LC3II 的表达水平。结果显示TC-1 细胞中LC3II 的表达水平下降,说明P62 和Atg7 基因沉默后能够抑制MO 感染导致的细胞自噬。进一步通过CCU 试验发现在P62和Atg7 基因沉默后的TC-1 细胞中MO 在细胞内的存活数升高,表明细胞自噬对MO 在细胞内的增殖具有一定的抑制作用。MO 如何诱导宿主细胞自噬将是本实验室后续开展的工作。本研究结果明确了MO 可诱导肺脏上皮细胞发生自噬并且该细胞的自噬对MO 的清除具有一定的作用,本研究为阐明MO的致病机制及为MO 感染疾病的防治提供参考依据。

