裸鼹鼠皮肤成纤维细胞外泌体的分离及鉴定
冯 延,武文卿,张静远,李 煜,李壘辰,袁 征,崔淑芳#
(1. 海军军医大学基础医学院实验动物学教研室,上海 200433;2. 军事科学院军事医学研究院实验动物中心,北京 100071)
外泌体(exosomes)具有脂质双分子层,密度在1.07~1.18 g/mL[1],直径在30~150 nm[2],是一种起源于内吞途径的细胞外囊泡。多囊泡体(multivesicular body,MVB)与质膜融合并排泄到细胞外微环境中,外泌体便由MVB产生[3]。外泌体可由体内各种活细胞分泌,普遍存在于不同的细胞类型中,包括B细胞、树突状细胞、T细胞和血小板等,也存在于多种体液中,包括血清、唾液、尿液、母乳、腹水和脑脊髓液等[1]。外泌体还被认为是生物医学研究中新兴的新型治疗靶标[4]。不同细胞来源的外泌体具有不同的功能,可以作为疾病诊断的生物标志物[5-6]。外泌体的纳米级大小也使其成为开发药物输送系统的理想候选者,该系统可以将有效载荷输送到目标组织、细胞和器官。已有多项研究支持外泌体可以在细胞之间转移核酸、蛋白质和脂质等特定成分,具有介导细胞间信号传递的重要功能[4-5],并参与细胞中许多物理和病理的整合过程[7-9]。
裸鼹鼠具有多种独特的生物学特性,如抗肿瘤、抗衰老、耐低氧及耐疼痛等。自发现这些特性以来,裸鼹鼠受到生物医学领域的广泛关注,越来越多地被应用于生物医学研究,尤其是在肿瘤、衰老、心血管等老年性疾病的研究中有着更好的优势。外泌体最早被发现于体外培养的绵羊红细胞上清液中[10],随后在小鼠、大鼠等动物以及人体中也证实了其广泛存在,但是目前国际上还没有关于裸鼹鼠皮肤成纤维细胞外泌体研究的相关报道。本研究分离培养了裸鼹鼠的皮肤成纤维细胞,对其是否分泌外泌体进行分离及鉴定,为进一步研究裸鼹鼠皮肤成纤维细胞外泌体在生物过程中的分子机制奠定基础。
1 材料与方法
1.1 实验动物
新生裸鼹鼠由海军军医大学实验动物学教研室繁殖,饲养于屏障设施[SYXK(沪)2017-0004]。
1.2 仪器与试剂
主要仪器有:三气培养箱(新加坡,Esco)、低温高速离心机(德国,Eppendorf)、垂直电泳仪(美国,Bio-Rad)、凝胶成像系统(中国,天能)、倒置荧光显微镜(德国,Leica)、透射电子显微镜(美国,Delong Instruments)、纳米流式分析仪(中国,NanoFCM)、超高速低温离心机(美国,Beckman)。
主要试剂有:DMEM(低糖)培养基、胎牛血清(FBS)、0.25%胰蛋白酶、青霉素/链霉素均购自美国Gibco公司;小鼠抗波形蛋白(Vimentin)多克隆抗体(10366-1-AP)购自美国Proteintech公司;兔抗Vimentin (D21H3) XP单克隆抗体(5741S)购自美国CellSignaling Technology公司;小鼠抗CD63单克隆抗体(ab217345)、小鼠抗肿瘤易感基因101(TSG101)单克隆抗体(ab125011)、小鼠抗热休克蛋白70(Hsp70)单克隆抗体(ab181606)购自英国Abcam公司;山羊抗小鼠抗体(A-11001)购自美国Invitrogen公司;山羊抗兔抗体购自美国Proteintech公司;去外泌体血清(EXO-FBS-50A-1)购自美国System Biosciences公司;抗荧光淬灭封片剂(P0131)、牛血清白蛋白(bovine serum albumin,BSA)购自碧云天生物科技有限公司。
1.3 裸鼹鼠皮肤成纤维细胞的分离培养与鉴定
1.3.1 裸鼹鼠皮肤成纤维细胞的分离培养 无菌取新生裸鼹鼠背部皮肤,置于含1%青霉素/链霉素的PBS中漂洗3次,将其剪碎至1~2 mm2大小,用3 mL 0.25%的胰蛋白酶消化40 min。使用无菌镊子或枪头将组织块尽量平贴于细胞培养皿中,每皿铺4~6块,置于37 ℃温箱中30 min使组织块贴紧于培养皿壁,沿边缘轻柔加入含20% FBS、1% 青霉素/链霉素的低糖DMEM培养液,置于33℃、5% CO2培养箱中培养。待组织块周围长出的细胞融合度至90%左右时,加入PBS洗去残余的培养液,使用0.25%胰蛋白酶消化。一半细胞变圆后以5~6倍体积的含20%FBS的培养液终止消化,轻轻吹打成单个细胞,转入细胞培养瓶进行培养,此时的细胞记为第一代(P1代)细胞。每2~3 d换一次培养液,待P1代细胞长满瓶底后,进行传代培养,细胞传至P3代起进行鉴定。
1.3.2 裸鼹鼠皮肤成纤维细胞的免疫荧光鉴定 将P3代细胞以1×106个/mL接种于48孔板,待融合度至80%左右时,用PBS冲洗细胞2次,加入4%多聚甲醛溶液固定15 min,随后用PBS洗3次;0.4%TritonX-100的PBS处理5 min,PBS洗3次,加入6%的BSA,置于37 ℃封闭0.5 h,吸弃上清液。加入1%BSA稀释的小鼠抗Vimentin多克隆一抗(1∶100),4 ℃湿盒中避光孵育过夜;Tris-HCl缓冲盐溶液(TBS)洗涤3次,加入1%BSA稀释的山羊抗小鼠二抗(1∶1 000),37 ℃孵育0.5 h,TBS洗涤3次后加入抗荧光淬灭封片剂(含DAPI),4℃保存以备镜下观察。
1.3.3 裸鼹鼠皮肤成纤维细胞的蛋白质印迹法鉴定 收集细胞培养瓶中的P3代细胞,使用RIPA裂解液充分进行裂解后,加入蛋白上样缓冲液加热变性,聚丙烯酰胺凝胶电泳后转膜,脱脂奶粉4℃封闭过夜,依次加入兔抗Vimentin单克隆一抗(1∶1 000)、山羊抗兔二抗(1∶10000)进行孵育,使用ECL化学发光试剂进行显色,凝胶成像系统曝光检测Vimentin表达情况。
1.4 裸鼹鼠皮肤成纤维细胞外泌体的分离与鉴定
1.4.1 裸鼹鼠皮肤成纤维细胞外泌体的分离 P4代细胞融合度为80%左右时,用PBS润洗细胞2次,加入含20%去外泌体血清的低糖DMEM培养液,48 h后收集细胞上清液80 mL,4℃,300×g离心10min,取上清液;2 000×g离心10 min,取上清液;10 000×g离心30 min,取上清液;100 000×g离心70 min,取沉淀,加入PBS洗涤,100 000×g离心70 min,取沉淀,用200 µL PBS重悬,—80 ℃保存备用。
1.4.2 透射电子显微镜观察外泌体形态 将外泌体与等量的4%多聚甲醛溶液混合,将5~10 µL悬液滴加到封口膜上,将铜网Formvar膜面朝下放在悬液上,准备2~3个铜网,将100 µL PBS加到封口膜上,用镊子将铜网(Formvar膜面朝下)放在PBS液滴上清洗;将铜网放在50 µL 1%戊二醛液滴上5 min,放在100 µL ddH2O中2min(洗8次),将外泌体固定在铜网上。对外泌体进行负染色处理,80kV下拍摄电镜照片。
1.4.3 纳米流式分析颗粒直径 使用纳米流式分析仪进行分析检测,在相同的仪器条件下测试待检样品,并用PBS作为实验空白对照,进行数据分析,获得样本粒径分布图。
1.4.4 蛋白质印迹法检测外泌体相关特异性蛋白表达 将分离得到的外泌体样品加入等体积的外泌体专用裂解液,冰上充分裂解10 min,加入蛋白上样缓冲液加热变性,聚丙烯酰胺凝胶电泳后转膜,脱脂奶粉4℃封闭过夜,加入兔抗CD63、TSG101、Hsp70一抗(1∶1000)和山羊抗兔二抗(1∶10000)进行孵育,使用ECL化学发光试剂进行显色,凝胶成像系统曝光检测CD63、TSG101和Hsp70表达情况。
2 结果
2.1 皮肤成纤维细胞形态学观察
取新生裸鼹鼠背部皮肤,剪碎后铺于细胞培养皿,第30小时可见组织块边缘有细胞游出(图1A),第5天从组织块游离出的细胞明显增加(图1B)。图1C和图1D分别为首次传代后成纤维细胞和第3代成纤维细胞,细胞呈长梭形或多角形,状态良好。
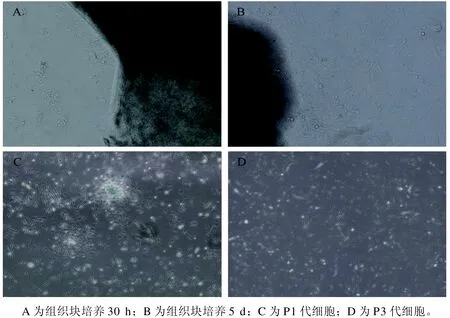
图 1 裸鼹鼠皮肤成纤维细胞显微图像(×100)Figure 1 Microscopic images of skin fibroblasts of naked mole rats (×100)
2.2 细胞免疫荧光
选取P3代皮肤成纤维细胞,铺于48孔板进行免疫荧光鉴定,白光对照图中成纤维细胞呈长梭形(图2A);免疫荧光图片中绿色荧光为皮肤成纤维细胞中的波形蛋白,蓝色为DAPI着色的细胞核(图2B)。细胞纯度在90%以上。
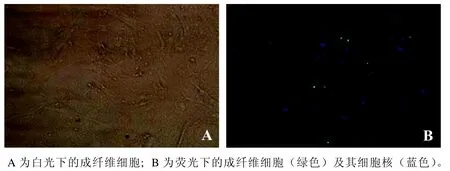
图 2 裸鼹鼠皮肤成纤维细胞免疫荧光鉴定(×200)Figure 2 Immunofluorescence identification of skin fibroblasts of naked mole rats (× 200)
2.3 裸鼹鼠皮肤成纤维细胞中波形蛋白表达
采用波形蛋白单克隆抗体以蛋白质印迹法检测分离培养的P3代裸鼹鼠成纤维细胞中波形蛋白的表达情况,发现裸鼹鼠成纤维细胞表达波形蛋白(图3),从而证实分离的细胞具有成纤维细胞的特性。
2.4 外泌体形态观察
透射电子显微镜下观察,可见膜状的杯托样结构(图4),符合外泌体结构特征。
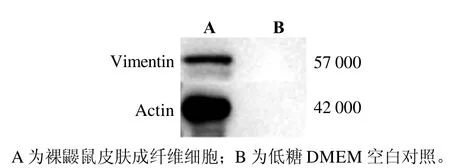
图 3 蛋白质印迹法检测裸鼹鼠皮肤成纤维细胞中波形蛋白表达Figure 3 Western blotting results of vimentin in skin fibroblasts of naked mole rats

图 4 透射电子显微镜观察裸鼹鼠皮肤成纤维细胞来源外泌体Figure 4 Transmission electron microscope observation on the exosomes derived from skin fibroblasts of naked mole rats
2.5 外泌体粒径大小
纳米流式分析结果显示,分离获得的外泌体粒径大小分布在46.75~206.75 nm,其中大部分分布在30~150nm(图5),符合外泌体标准粒径范围。
2.6 外泌体相关特异性蛋白表达
表面标志物的表达是验证外泌体的特征之一,通过蛋白质印迹法检测分离样品,结果证实表面富含外泌体标志物CD63、TSG101和Hsp70蛋白(图6)。
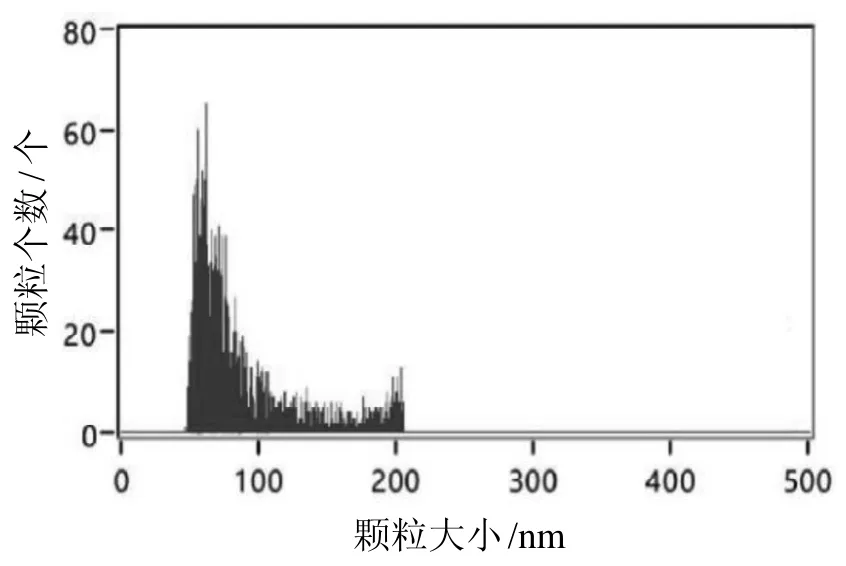
图 5 裸鼹鼠皮肤成纤维细胞外泌体粒径大小检测Figure 5 Particles size analysis of exosomes of skin fibroblasts of naked mole rats
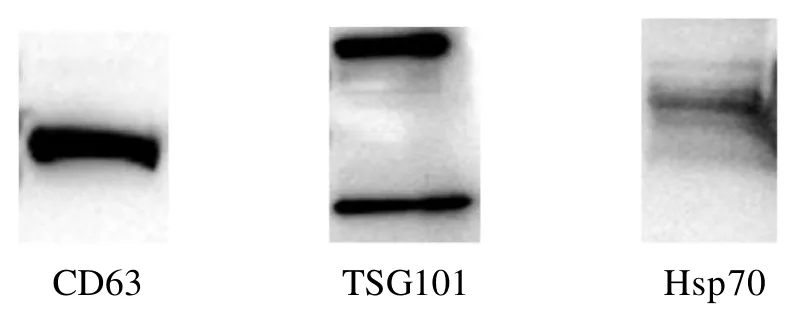
图 6 蛋白质印迹法检测裸鼹鼠皮肤成纤维细胞外泌体Figure 6 Western blotting results of exosomes isolated from skin fibroblasts in naked mole rats
3 讨论
与大小鼠等其他啮齿类实验动物相比,裸鼹鼠具有多种独特的生物学特性,裸鼹鼠的成纤维细胞也具有一定特性,如能分泌超高分子量的透明质酸。人类成纤维细胞分泌的透明质酸相对分子量可达2×106,而成年裸鼹鼠的成纤维细胞产生的透明质酸相对分子量可达6×106~12×106[11]。研究表明,这种超高分子量的透明质酸相较于高分子量的透明质酸,具有更好的细胞保护性能,不仅能保护裸鼹鼠细胞,还可以保护小鼠和人类细胞免受压力诱导的细胞周期停滞和细胞死亡的影响,显示了良好的抗衰老特性[12]。本研究为探索裸鼹鼠成纤维细胞是否产生外泌体,成功分离培养了裸鼹鼠皮肤成纤维细胞[13],并对其纯度进行了免疫荧光鉴定。
外泌体起源于晚期内体的膜囊泡,与其他类型的囊泡相比,每个外泌体都有独特的脂质双分子层。根据分离方法及粒径大小可将外泌体与微泡、囊泡或凋亡小体等区分开,此外,外泌体独有的表面蛋白如CD63、TSG101及其他相关受体等也可用于鉴定外泌体[14]。本研究使用超高速差速离心的方法分离并提取了成纤维细胞上清培养液,通过鉴定验证了裸鼹鼠皮肤成纤维细胞能够产生外泌体。蛋白质印迹法分析中部分蛋白表达并未显示唯一的条带,可能与外泌体中的蛋白存在修饰的情况有关,有些蛋白被磷酸化和糖基化后会变大,有些蛋白被剪切后会变小。这种情况与国际上已发表外泌体的蛋白质印迹法检测结果[15]也是一致的。值得注意的是,这种蛋白修饰情况是否与其他实验动物有所区别,是否参与了某种生理或者病理过程,都需要进一步探讨。
每个外泌体的生化组成都反映了它们的生物发生过程和起源。上皮细胞、树突状细胞、巨噬细胞、肥大细胞、神经元、少突胶质细胞、B细胞和T细胞等均能够释放外泌体[16]。外泌体活性对于介导细胞通讯、免疫反应、细胞信号再生和分化是必需的,甚至在病毒复制中也有报道,表明外泌体具有促进信号转导的作用[17]。外泌体的起源和发育机制决定了它们的含量和生物学功能。例如,B淋巴细胞产生的外泌体包含主要组织相容性复合体(major histocompatibility complex, MHC)Ⅰ型、Ⅱ型和T细胞刺激分子,以诱导T细胞增殖[18]。癌细胞的外泌体包含影响细胞黏附以促进肿瘤进展的分子[19]。外泌体的含量也具有明显的疾病特异性[1]。此外,有研究表明,外泌体以Hsp70依赖的方式预防心脏纤维化,并且随着年龄的增长,心脏纤维化的增加可能部分归因于外泌体中与衰老相关的Hsp70表达下降[20]。裸鼹鼠成纤维细胞分泌的超高分子量的透明质酸表现了良好的抗衰老特性,其成纤维细胞分泌的外泌体是否也参与了抗衰老过程,仍然需要进一步探索。
综上所述,本研究已经初步证实了裸鼹鼠皮肤成纤维细胞能够分泌外泌体,为今后研究外泌体在裸鼹鼠皮肤成纤维细胞中发挥作用的机制奠定了基础。

