双侧颈总动脉结扎致大鼠脑血流低灌注不同时程的神经功能障碍和病理学变化
孙成成,刘剑刚#,刘美霞#,李 浩,罗增刚
(1. 中国中医科学院西苑医院,中国中医科学院老年病研究所,北京 100091;2. 北京市中医管理局,北京 100053)
慢性脑血流灌注不足是导致血管性痴呆(vascular dementia,VaD)的主要因素之一。目前认为,VaD是由多种脑血管因素导致的脑组织累积性损伤引起的影响认知能力的进行性疾病[1],其特征是思维能力和行为障碍,通常发生在脑卒中之后[2]。VaD的发生机制与炎性因子有关[3],其中白细胞介素6(interleukin-6,IL-6)、白细胞介素1β(interleukin-1β,IL-1β)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)是在炎性反应中发挥重要作用的细胞因子,与认知能力下降、神经元毒性和脑细胞凋亡密切相关[4]。实验性慢性脑缺血研究较为经典的动物模型是双侧颈总动脉永久性结扎模型[5],因其能较好地模拟人慢性脑血流灌注不足造成脑组织处于低灌注和低氧状态,特别是与认知功能有关的结构如海马体、皮层等容易发生氧化应激损伤,最终导致学习记忆和行为能力损害,与人慢性脑缺血的发生机制较为一致。
双侧颈总动脉结扎建立脑慢性缺血模型后不同时程的动物行为学变化和病理改变的程度不尽相同。本实验比较双侧颈总动脉结扎不同时程大鼠模型的炎性因子水平、神经功能变化和脑组织病理特征,以期为后续药物研究时根据药理作用特点选择较为确切的药物干预时机提供一定依据。
1 材料与方法
1.1 动物
SPF级雄性Wistar大鼠50只,体质量为200~220 g,由北京维通利华实验动物技术有限公司提供[SCXK(京)2016-0002]。所有大鼠饲养于中国中医科学院西苑医院屏障环境实验动物室[SYXK(京)2015-0011],室温控制在25 ℃左右,相对湿度为(40~70)%。大鼠自由进食和饮水,每日光照和黑暗各12h,适应性喂养7 d后进行实验。本研究方案经过中国中医科学院西苑医院医学伦理委员会审查通过(2018XLC004-1),实验过程中严格遵循国家科技部《关于善待实验动物的指导性意见》和《北京市实验动物福利伦理审查指南》的要求。
1.2 主要试剂和仪器
ELISA检测所用IL-1β试剂盒(批号20181110)、IL-6试剂盒(批号20181210)和TNF-α试剂盒(批号20181112)均购自北京欣博盛生物科技有限公司。戊巴比妥钠(批号T860907)由国药集团化学试剂有限公司进口分装,甲醛溶液(批号C10561782)由上海麦克林生化科技有限公司提供,2,3,5-氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC)试剂(批号CT28181920)由北京酷来博科技有限公司提供。DR-200BS型半自动酶标分析仪为无锡华卫德朗仪器有限公司产品,Sorvall ST 8R型高速冷冻离心机为赛默飞世尔科技(中国)有限公司产品,DpxView Pro型显微彩色图像处理系统为丹麦DeltaPix公司产品,Olympus BH-2型显微镜为日本Olympus公司产品。
1.3 动物造模及分组
参照文献[6]的方法,进行大鼠双侧颈总动脉永久性结扎手术以造模。手术方法稍做改进:腹腔注射2%戊巴比妥钠水溶液(0.2 mL/100 g体质量)后,将麻醉大鼠固定于操作台,剃毛备皮,常规消毒大鼠颈部;沿着颈部正中切开皮肤,钝性分离,充分暴露大鼠双侧颈总动脉,随即分离双侧颈总动脉及迷走神经,然后穿线(4号手术丝线)结扎一侧,停顿15 min后再结扎另一侧;术后碘附涂抹术部皮肤,每日每只大鼠肌内注射青霉素(4×104U)抗感染,连续3d。将造模成功的大鼠按数字表法随机分为3组,每组10只,即结扎后2周组、4周组和6周组。同时设立假手术组,大鼠10只,手术方法同上,只是穿线后不结扎,后期处理同模型组。双侧结扎模型成功的标志:大鼠麻醉清醒后出现Horner综合征及一段时间内前肢为主的神经功能障碍。术后回笼饲养,在缺血2 h内注意观察,维持大鼠体温为36.5~37.5 ℃。
1.4 指标评价
1.4.1 大鼠神经功能缺损评分 参照文献[7]的方法,用5分制进行评分。评分标准:大鼠未出现神经功能缺损症状,记0分;大鼠出现轻度局灶性神经功能缺损症状,左前肢无法完全伸展,记1分;大鼠出现中度局灶性神经功能缺损症状,左前肢无法正常抓握,记2分;大鼠出现中重度局灶性神经功能缺损症状,提尾倒悬时向对侧转圈,记3分;大鼠局灶性神经功能缺损症状严重,存在自发性转圈现象,记4分。分数越高,表明大鼠的神经功能缺损越严重。
1.4.2 大鼠炎性因子指标检测 于神经功能评估后,麻醉各组大鼠,经腹主动脉取血,4℃条件下以3 000 r/min的速度离心15 min,收集上层血清,置于-80 ℃冻存备用。严格按照ELISA试剂盒使用说明,在450nm波长下测定各组血清中TNF-α、IL-1β及IL-6对应的吸光度,并根据标准曲线计算血清中TNF-α、IL-1β和IL-6含量。
1.4.3 大鼠脑组织缺血范围测量 腹主动脉取血后,每组随机编号并取其中5只大鼠,快速取脑组织,于-20 ℃冰箱中速冻10 min。将大鼠脑组织置入脑切片模具,进行冠状面切片,平均切成5个脑片。将大鼠脑组织切片置于2%的TTC磷酸缓冲液中,避光37℃温箱中孵育15 min,再用质量分数为4%的多聚甲醛溶液固定2 h。正常脑组织染成玫瑰红色,缺血或梗死组织则不染色(呈白色)。将染色的脑组织切片按切片前后顺序排列,分别标号和拍照。用DpxView Pro型显微彩色图像处理系统测量脑缺血(梗死)面积和全脑面积,然后计算缺血区域所占百分率(脑缺血或梗死面积/全脑面积的值×100%)。
1.4.4 大鼠脑海马体组织病理学观察 取每组另5只大鼠的脑组织,经体积分数为10%的中性甲醛溶液固定、常规包埋、乙醇梯度脱水和切片后,进行HE染色。光学显微镜下观察海马体神经元的病理形态学改变。
1.5 统计学方法
2 结果
2.1 不同时程模型大鼠神经功能缺损评分变化
与假手术组比较,造模后2周组、4周组和6周组大鼠的神经功能缺损评分均明显升高(P<0.05),提示双侧颈总动脉结扎后大鼠出现了神经功能损伤。与2周组的模型大鼠比较,4周组大鼠的神经功能变化仍持续存在,在6周时神经功能缺损评分有所降低(P<0.05)。结果见图1。
2.2 不同时程的模型大鼠血清炎性因子变化
大鼠双侧颈总动脉结扎后,与假手术组比较,2周组、4周组和6周组的IL-6水平明显升高(P<0.05),而IL-1β和TNF-α水平虽有升高,但差异无统计学意义(P>0.05)。结果见表1。
2.3 不同时程的模型大鼠脑缺血范围变化
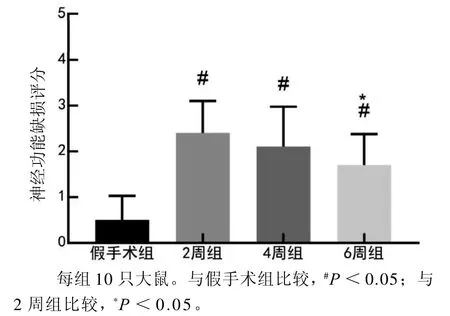
图 1 双侧颈总动脉结扎后不同时程的模型大鼠神经功能缺损评分Figure 1 Neurological deficit score of the model rats in different duration after bilateral common carotid artery ligation
表 1 双侧颈总动脉结扎后不同时程的模型大鼠血清炎性因子变化Table 1 Changes of serum inflammatory factors in model rats with different duration after bilateral common carotid artery ligation(pg/mL,,n =10)
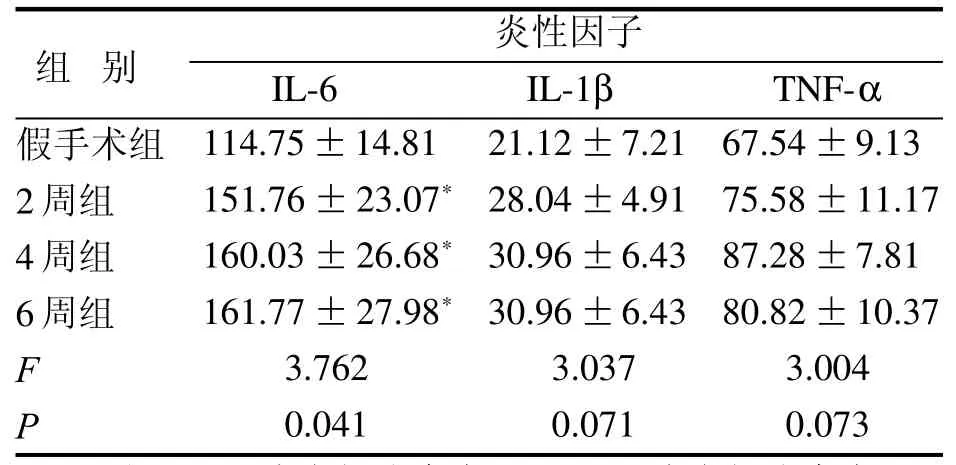
表 1 双侧颈总动脉结扎后不同时程的模型大鼠血清炎性因子变化Table 1 Changes of serum inflammatory factors in model rats with different duration after bilateral common carotid artery ligation(pg/mL,,n =10)
注:IL-6为白细胞介素6,IL-1β为白细胞介素1β,TNF-α为肿瘤坏死因子α。与假手术组比较,*P<0.05。
组 别 炎性因子IL-6 IL-1β TNF-α假手术组2周组4周组6周组F P 114.75±14.81 151.76±23.07*160.03±26.68*161.77±27.98*3.762 0.041 21.12±7.21 28.04±4.91 30.96±6.43 30.96±6.43 3.037 0.071 67.54±9.13 75.58±11.17 87.28±7.81 80.82±10.37 3.004 0.073
缺血模型建立后,与假手术组比较,不同时程的模型大鼠脑组织有不同程度的局部缺血,或形成明显的梗死灶。与造模2周组([8.24±2.40)%]比较,4周组([13.18±4.15)%]和6周组([17.48±5.13)%]的缺血区域所占百分率明显增加(P<0.01)。与4周组比较,6周组的缺血区域所占百分率明显增加(P<0.01),并有较小的梗死灶。结果见图2。
2.4 不同时程模型大鼠脑组织缺血区病理学变化
观察显微镜下相同部位的病理组织形态,假手术组大鼠所选脑区细胞结构完整,细胞数较多,核深染,未见不均一染色质(图3B);模型组大鼠2周、4周和6周后脑组织缺血区都有不同程度的损伤。其中,2周组脑组织细胞间隙增宽,炎性细胞浸润(箭头①所示),神经元细胞核坏死(箭头②所示)(图3C);4周组脑组织细胞排列紊乱,细胞数减少,疏密不均,白质密度降低,边缘模糊,炎性细胞和神经元细胞核坏死增加(图3D);6周组脑组织细胞出现核固缩,细胞质空泡变性,白质呈现慢性缺血性改变,细胞数明显减少,局部有梗塞灶出现(箭头③所示)(图3E)。
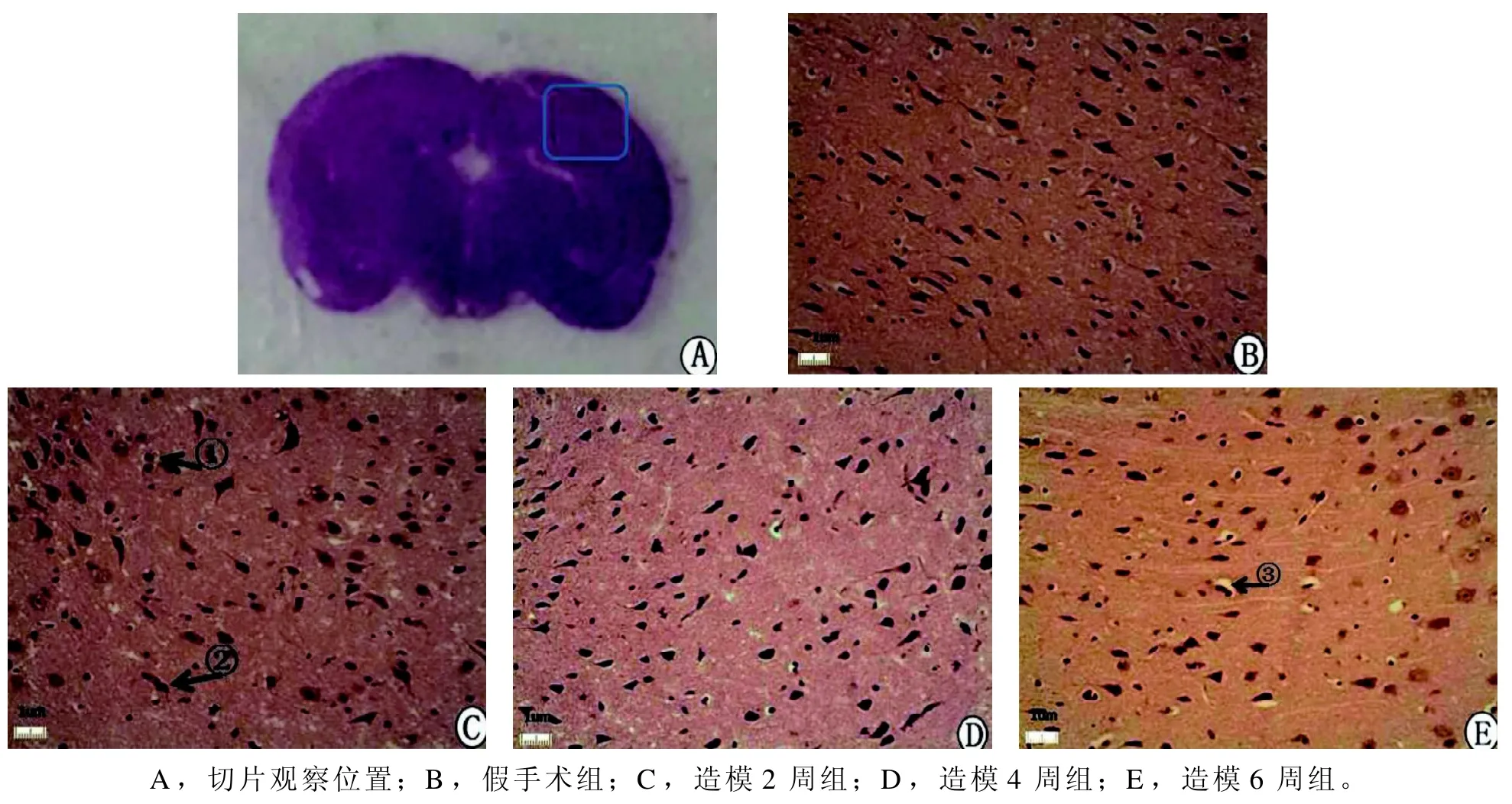
图 3 双侧颈总动脉结扎后不同时程的模型大鼠脑组织缺血区HE染色(×300)Figure 3 HE staining of brain tissues of model rats with different duration after bilateral common carotid artery ligation(×300)
3 讨论
双侧颈总动脉结扎致慢性脑血流低灌注的主要病理生理基础是脑组织葡萄糖代谢减少、能量代谢障碍、神经元缺陷、神经递质改变、胆碱能受体缺失、蛋白质合成异常,以及脑白质损害等[8]。而慢性脑血流低灌注是各种脑血管疾病和血液动力学异常的常见后果,并可导致退行性认知障碍的发生[9],引发VaD和阿尔茨海默病[10],表现为神经功能缺损和行为障碍[11]。慢性脑血流低灌注引起的认知功能损伤主要是由脑白质病变造成,整个环节包括神经炎性反应、脱髓鞘、髓鞘碱性蛋白缺失等,最终导致神经元的缺失和变性,因而在认知功能回路中神经元可能直接或间接地参与了作用。有研究显示,双侧颈总动脉结扎术后4周的大鼠海马体CA1区出现神经元缺失,术后5周发生显著的白质微观结构改变和灰质萎缩[12],术后7周大脑皮层中突触载脂蛋白E水平升高,突触蛋白增加[13]。
相关实验结果显示,大鼠在脑血流低灌注的情况下可出现神经元损伤,而且慢性脑血流低灌注会引起不同类型的细胞变性,在双侧颈总动脉闭塞(bilateral common carotid artery occlusion,BCCAO)术后2周~6周大脑皮层和纹状体的数量急剧减少,表明这两个区域的神经元易受慢性脑缺血的影响[14]。已知突触功能障碍是慢性脑血流低灌注诱导认知功能缺陷的基础。神经回路中存在沉默突触,结扎后沉默突触所占百分比增加,CA1区树突棘密度显著下降,树突棘密度降低与功能性突触数量减少有关[15]。现有文献表明,BCCAO术后脑血流急剧下降,随后在4周后恢复到闭塞前水平[1]。然而,脑血流的恢复不能逆转神经变性和记忆障碍[16],因此早期干预是治疗VaD的一种策略。
本实验采用双侧颈总动脉永久性结扎法制备大鼠脑低灌注模型,在2周、4周和6周脑缺血早期不同的时间节点观察大鼠的神经功能变化和组织病理学改变。结果显示,手术造成大鼠慢性脑缺血:造模后2周开始,大鼠脑组织有缺血性损伤,病理结果显示神经元细胞出现坏死,并有炎性细胞浸润;4周后,脑白质密度降低,边缘模糊;6周后,脑白质呈现慢性缺血性改变,局部有梗死灶出现。随着时程延长,脑缺血最终造成机体神经功能障碍。这种现象接近于临床患者脑血管阻塞后遗症的病理改变和临床症状。此外,造模2周后,大鼠神经功能显著减退,4周时减退仍持续存在。与2周时比较,大鼠造模6周时神经功能有好转,这可能与大鼠侧支循环建立有关。检测慢性缺血性炎性反应因子水平的结果显示,造模2周后血清IL-6水平明显升高,而4周和6周的炎性反应因子水平无明显变化,说明局部手术造模尚未引起全身血清炎性因子的变化,或只是应激反应,这也可能和侧支血流逐步恢复有关。
本实验只是一个脑血流低灌注不同时程神经功能变化的初步研究,今后将和动物行为学实验相结合,进一步明确慢性脑血流低灌注对神经功能和认知行为学的影响。本实验结果表明,防治慢性脑血流低灌注导致的神经功能障碍及脑组织病理生理学改变时,术后2周甚至更早时间干预可能是一个较为合适的选择,早期干预可进一步防治认知功能受损。

