基于网络药理学预测川芎嗪、芍药苷干预糖尿病血管并发症的作用机制
岳 珑,盛 松,王景尚,李丹丹,黄 烨
糖尿病已成为继心血管疾病、肿瘤后的第三大危害人类生命及健康的慢性代谢性疾病[1]。多项全国多中心流行病学研究证实,我国成人糖尿病患病率高达9%以上,已成为我国重大公共卫生问题之一[2]。糖尿病血管并发症是病人致死、致残的主要因素[3]。探讨糖尿病血管并发症的发病机制并进行针对性治疗是该领域亟待解决的关键问题之一。
中医学认为糖尿病属“消渴”范畴,糖尿病血管并发症发生的机制是“瘀血痹阻脉络”。大量临床和基础研究表明,中药复方、单味药及提取部位、单体成分可通过多途径、多靶点防治糖尿病微血管并发症和大血管并发症[4]。其中,川芎嗪是由中药伞形科植物川芎根茎提取的有效成分,对糖尿病并发症包括周围神经病变、视网膜病变、肾脏病变有预防和治疗作用,其主要机制与改善微循环有关[5]。芍药苷作为中药材白芍和赤芍的主要活性单体成分,具有免疫调节、抗氧化反应、抗肿瘤、抗炎、改善学习记忆等药理作用,广泛应用于调节免疫、保护心脑血管、抗肿瘤、保肝等治疗[6]。大量基础研究多集中于川芎嗪和芍药苷改善糖尿病肾病,川芎嗪可改善糖尿病大鼠的血液流变学、抑制醛糖还原酶活性、降低血糖、减少尿蛋白丢失、减轻肾脏病理变化[7]、抑制肾脏细胞凋亡、改善肾脏结构和功能[8],从而延缓糖尿病肾病的发生和发展。芍药苷可通过抑制糖尿病小鼠巨噬细胞活化、减轻炎症反应,发挥对肾脏的保护作用[9]。川芎嗪、芍药苷配伍具有复杂的药理作用,其干预糖尿病血管并发症的具体机制尚不明确,需进一步深入研究。
网络药理学从多靶点、多成分、多通路着手研究药物与疾病间相互作用的原理,符合中医的整体观,为中医药机制的研究提供更为完善的方法[10]。本研究基于网络药理学方法,对川芎嗪和芍药苷干预糖尿病血管并发症的作用通路及相关靶点进行探讨,以明确其防治糖尿病血管并发症的物质基础。
1 材料与方法
1.1 川芎嗪、芍药苷靶点预测 在ZINC数据库中得到芍药苷和川芎嗪的SMILES、mol2文件及InChI。在DrugBank 5.0、SwissTargetPrediction ver 2019、SEA、Batman-TCM、 PharmMapper ver 2017中分别通过SMILES、mol2、InChI找到川芎嗪及芍药苷的成分靶点。DrugBank 5.0筛选条件设为Similarity threshold 0.7,Minimum Weight e.g.100,Maximum Weight e.g.200,Maximum Results 100。SwissTargetPrediction ver 2019筛选条件设定为Organism Homo sapiens。PharmMapper ver 2017筛选条件设为Organism Homo sapiens(Human)。Batman-TCM筛选条件设为Score cutoff≥20,AdjustedP-value为 0.05(检索截至日期为2019年11月7日)。
1.2 糖尿病血管并发症的疾病靶点检索与筛选 采用GeneCards数据库、DrugBank数据库(https://www.drugbank.ca/)和DisGeNET数据库(http://www.disgenet.org/web/DisGeNET/menu/home)检索糖尿病血管并发症疾病相关靶点,整理后建立疾病相关靶点数据库(检索截至日期为2019年11月7日)。
1.3 川芎嗪和芍药苷治疗糖尿病血管并发症的靶点筛选 将获得的川芎嗪和芍药苷成分靶点汇总后去除重复项,再与糖尿病血管并发症的疾病靶点取交集,即为川芎嗪和芍药苷作用于糖尿病血管并发症的靶点。
1.4 蛋白质之间相互作用(PPI)的网络构建 PPI是生物分子网络中的基本组成元件,是疾病发生发展的关键环节[11],因此,应用String v11数据库获取靶标蛋白质相互作用关系,从PPI层次探讨川芎嗪、芍药苷的潜在作用机制。将得到的靶点交集蛋白质信息输入到String数据库,物种设为“Homo sapiens”,根据既往文献,最低相互作用阈值设为中等置信度“medium confidence(0.400)[12]”,同时设置“hide disconnected nodes in the network”以隐藏网络中无关联的节点,构建PPI关系。
1.5 成分靶点-疾病靶点网络构建以及核心靶点的筛选 将上述得到的PPI关系导入Cytoscape 3.2.1软件,利用“Network Analyzer”工具进行网络拓扑分析,以节点的自由度(degree)、中介中心性(betweenness centrality,BC)和接近中心性(closeness centrality,CC)网络拓扑参数来评估节点的重要程度,上述参数值越大,提示节点越接近网络中心,在网络拓扑学上的作用也越大。以Degree>2倍均值为初次靶点筛选,从初次筛选出的靶点中以Degree、BC、CC值均大于均值的靶点作为核心靶点[13]。
1.6 基因本体(GO)和京都基因与基因组百科全书(KEGG)富集分析 首先对所得靶点进行ID名称的切换,即使用R软件将川芎嗪、芍药苷与糖尿病血管并发症的共作靶点转化为EntrezID;其次调用R语言中的ClusterProfiler程序包进行数据处理;最后运行R语言得到GO富集分析中生物过程(BP)的条形图和KEGG富集分析的气泡图[14]。
2 结 果
2.1 川芎嗪、芍药苷靶点预测 在DrugBank 5.0、SEA中未找到川芎嗪和芍药苷的靶点,在SwissTargetPrediction ver 2019中得到29个川芎嗪靶点和100个芍药苷靶点,Batman-TCM中得到8个川芎嗪靶点,在PharmMapper ver 2017中得到66个川芎嗪靶点和68个芍药苷靶点,汇总后去除重复项共得到103个川芎嗪靶点和168个芍药苷靶点。
2.2 糖尿病血管并发症的疾病靶点检索 在GeneCards中找到4 662个靶点,在DrugBank 5.0中找到65个靶点,在DisGeNET中未找到靶点,汇总后去除重复项得到4 662个糖尿病血管并发症靶点。
2.3 川芎嗪和芍药苷作用于糖尿病血管并发症的靶点 将找到的成分靶点与疾病靶点取交集,即为川芎嗪和芍药苷作用于糖尿病血管并发症的靶点,共146个。经筛选后得到4个核心靶点:TP53、HSP90AA1、STAT3和ANXA1。详见表1。
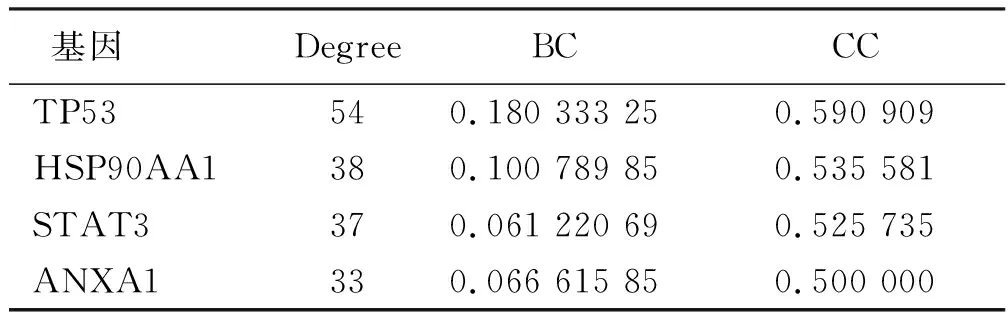
表1 川芎嗪和芍药苷作用于糖尿病血管并发症的4个核心靶点
2.4 成分靶点-疾病靶点网络构建 成分靶点-疾病靶点网络中有144个节点和853条边,代表着网络中144个靶点和853个靶点间的关系。详见图1。
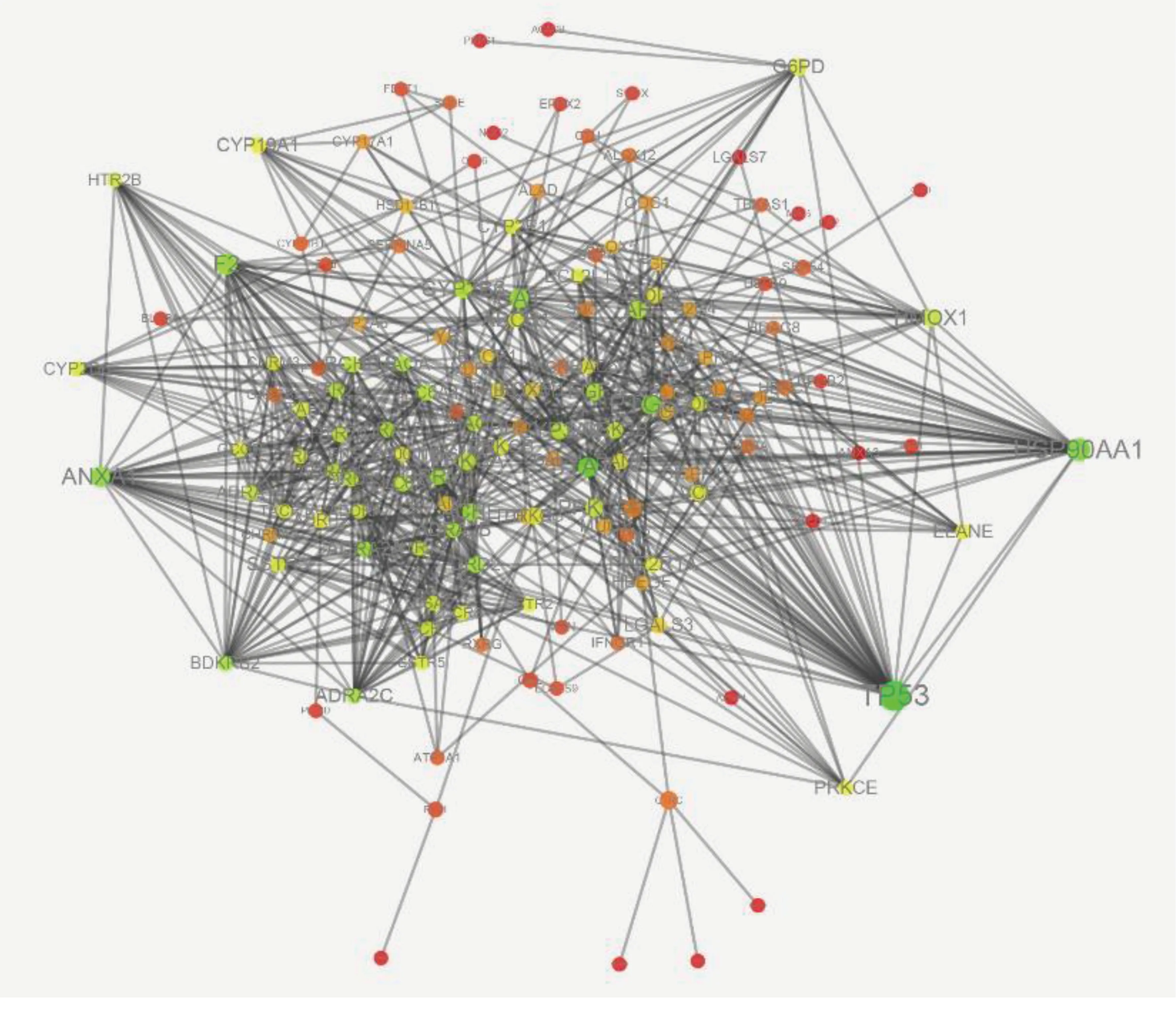
图1 成分靶点-疾病靶点网络
2.5 GO富集分析结果 共富集到1 280个Biological Process,按照AdjustedP值由小到大排列选出富集最显著的10个条目。其中,smooth muscle contraction,vascular process in circulatory system,regulation of blood vessel size,vasoconstriction[15]以及positive regulation of MAPK cascade[16]等生物过程可能与糖尿病血管并发症存在联系。详见图2。
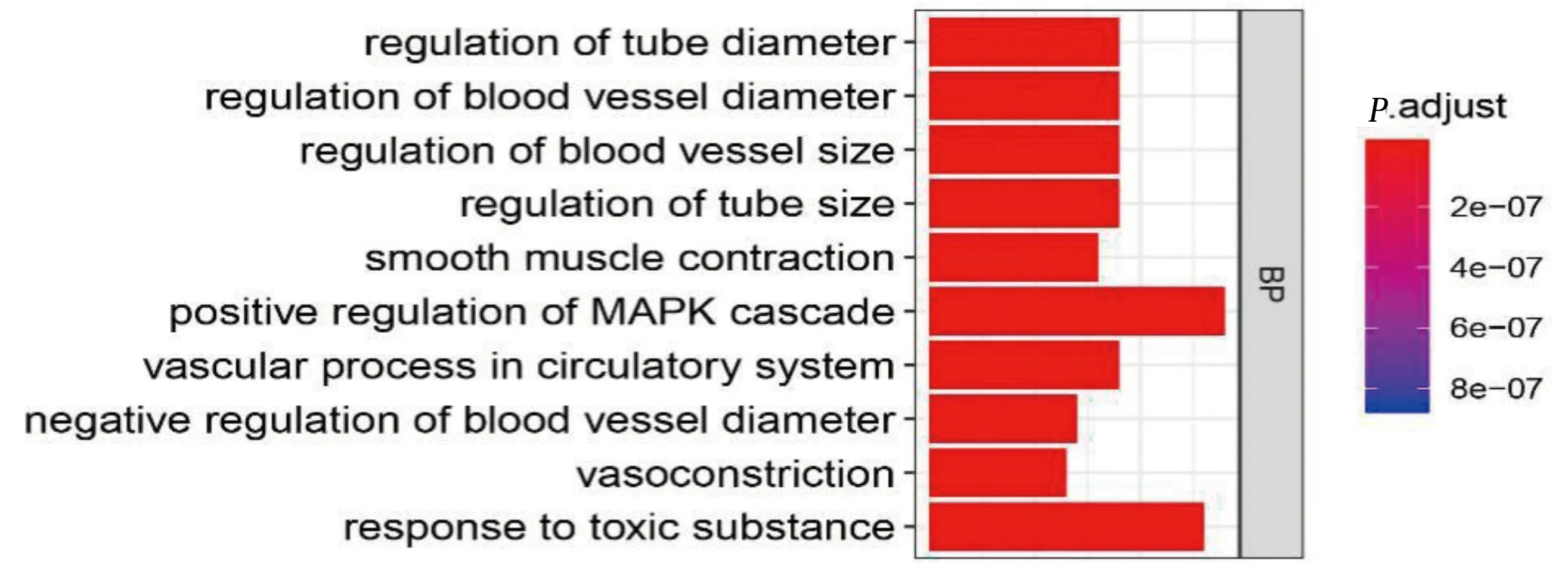
图2 GO富集分析结果
2.6 KEGG富集分析结果 KEGG富集通路符合adjustedP<0.05的有42条,包括Neuroactive ligand-receptorinteraction,Calcium signaling pathway,Serotonergic synapse,Inflammatory mediator regulation of TRP channels, cGMP-PKG,Dopaminergic synapse通路,将富集最显著的前30条通路作图(见图3)。这些通路可能与糖尿病血管并发症的发生有关。
3 讨 论
川芎嗪是一种自由基清除剂及钙离子拮抗剂,具有活血化瘀、抑制血小板聚集、降低血液黏度、改善血液流变学的作用,已广泛应用于心、脑、肺、肾及血管疾病的治疗。此外,研究表明,川芎嗪对防止糖尿病的各种慢性并发症均具有显著疗效[17]。芍药苷具有抗炎、抗氧化、抗过敏、抗血小板聚集、免疫调节和缓解疼痛等作用[18-19]。课题组前期研究表明,芍药苷通过拮抗氧化应激、抑制炎症反应、下调蛋白激酶Cβ1发挥保护波动性高血糖诱导的内皮细胞损伤[20]。
本研究应用网络药理学探讨川芎嗪和芍药苷配伍防治糖尿病血管病变的物质基础,发现从川芎嗪和芍药苷中分别筛选出成分靶点103个和168个,与4 662个糖尿病血管并发症靶点取交集得到146个靶点,网络拓扑分析得到4个核心靶点:TP53、HSP90AA1、STAT3和ANXA1,这些成分可能是两者治疗糖尿病血管并发症的重要靶点。对靶点相关的信号通路及生物学过程富集分析结果提示,刺激神经组织的配体-受体相互作用通路、钙离子信号通路、Serotonergic synapse、调控瞬时受体电位通道(transient receptor potential,TRP)的炎症介质、环鸟苷酸(cGMP)-蛋白激酶G(PKG)信号转导通路、多巴胺能神经突触可能参与了糖尿病血管病变的疾病过程。
抑癌基因TP53,也称p53,是人类癌症中最常见的突变基因之一,在癌症发生、衰老和DNA修复等过程中具有核心作用[21]。研究表明,血管内皮生长因子的升高与糖尿病病人发生大血管病变有关[22],而p53可抑制血管内皮生长因子转录[23]。有研究表明,p53激活在衰老过程中起到刺激炎症、减弱干细胞更新能力的作用,此外,脂肪组织p53过表达会引起胰岛素抵抗。因此,降低p53活性可能是减缓衰老、抑制炎症、促进胰岛素重新发挥作用的合理策略[24]。
祖细胞(HSPC)/热休克蛋白90(HSP90)和内皮型一氧化氮合成酶(eNOS)形成的复合物是Akt介导eNOS激活进而生成一氧化氮的先决条件[25]。糖尿病大鼠体内的高葡萄糖环境会降低HSP90表达,相反,二甲双胍通过诱导eNOS磷酸化增强HSPC-eNOS相互作用,在一定程度上阻止一氧化氮合成,降低一氧化氮对血管内皮舒张功能,从而加剧微血管并发症的发展[26]。HSPC在人类动脉粥样硬化病变中上调[27],而应用HSPC抑制剂17-DMAG治疗链脲佐菌素诱导的糖尿病ApoE-/-小鼠可明显减少动脉粥样硬化病变并诱导更稳定的斑块表型[28]。
信号转导与转录活化因子(STAT3)是一种转录因子,可被MAPK激活,直接或间接促进血管新生、诱导细胞增殖、分化以及凋亡[29],被认为是血管功能障碍中病理信号集成的中心介质。STAT3在KEGG富集中与糖尿病血管并发症相关的通路主要包括胰岛素抵抗通路和晚期糖基化终末产物(AGEs)及其受体(AGEs-RAGE)信号通路。研究表明,STAT3-细胞因子信号转导抑制因子3(SOCS3)信号参与胰岛素抵抗的形成过程,在2型糖尿病的发病机制中发挥重要作用[30]。正常情况下,内皮细胞仅少量表达RAGE,但在糖尿病状态下,伴随循环中及内皮下基质AGEs的增多,内皮细胞RAGE的表达也增强,AGEs与RAGE相互作用使内皮细胞一系列功能发生改变[31]。
ANXA1是一种天然存在的抗炎蛋白,属于Annexin超家族,是糖皮质激素的重要第二信使,在血管内皮细胞和血管平滑肌细胞中表达,参与许多抗炎过程[32]。研究表明,内源性ANXA1可能在胰岛素抵抗中发挥重要的血管保护作用。与传统抗炎策略相比,基于ANXA1的治疗可减少糖尿病血管损伤[33]。Purvis等[34]研究首次发现1型糖尿病病人血浆中存在高水平ANXA1。同时,在1型糖尿病动物模型中亦发现内源性ANXA1在保护心脏和肾脏免受功能衰退方面至关重要。推测人类重组ANXA1可能成为1型糖尿病微血管并发症的干预新措施。
糖尿病血管病变的发病机制目前尚未完全阐明,多数学者认为其根源是由糖尿病病人体内糖、脂肪和蛋白质代谢紊乱所诱发的一系列病理生理变化,这些异常改变又与组织蛋白非酶糖基化、自由基代谢和脂质过氧化及细胞凋亡等因素有关。近年来,大量证据表明炎症在与肥胖相关的胰岛素抵抗、糖尿病和心血管疾病发生发展中具有至关重要的作用,这些异常改变导致组织生理功能障碍和结构损伤,终致糖尿病血管并发症[35]。因此,积极防治糖尿病并发症对降低病残和病死率意义重大。本研究基于网络药理学,探究川芎嗪及芍药苷对糖尿病血管并发症的作用通路、作用靶点及作用机制,发现其主要通过调控血管平滑肌作用、控制血小板适度活化、抗炎、控制细胞代谢及凋亡等过程共同发挥减轻糖尿病血管并发症进展的作用,为后期明确防治糖尿病血管病物质基础提供依据。

