99mTc-HYNIC-TOC人体内照射剂量研究
卢麟俊,许晓平,徐俊彦,张建岗,章英剑,4,宋少莉,4,张建平,5
1.复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032;2.复旦大学生物医学影像研究中心,上海 200032;3.上海分子影像探针工程技术研究中心,上海 200032;4.上海市质子重离子医院核医学科,上海 201321;5.复旦大学核物理与离子束应用教育部重点实验室,上海 200433
神经内分泌肿瘤是一类相对罕见的恶性肿瘤,近年来多个国家和地区的流行病学调查均显示其发病率呈逐年上升的趋势[1]。传统影像学检查在评估神经内分泌肿瘤中特异度较差,病灶检出率较低[2-3]。而且由于相当一部分分化良好的神经内分泌肿瘤生长缓慢,导致葡萄糖代谢率偏低,故常规的18F-氟脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)-正电子发射计算机断层显像(positron emission tomography/computed tomography,PET/CT)对分化良好的神经内分泌癌诊断灵敏度和特异度都较差,无法准确检出分化良好的神经内分泌肿瘤的病灶[4-5]。生长抑素受体显像的发展改善了神经内分泌肿瘤的影像诊断效能。111In标记的生长抑素类似物DTPA-奥曲肽早在20世纪90年代已获美国食品药品管理局(Food And Drug Administration,FDA)批准用于神经内分泌肿瘤显像[6]。但111In所需加速器生产费用昂贵,显像时间为注射后24~48 h,且射线能量较高导致对受检者的辐射剂量较大,因此限制了其临床应用,99mTc标记的经肼基烟酰胺修饰的奥曲肽(99mTc-Hydrazinonicotinyl-Tyr3-Octreotide,99mTc-HYNIC-TOC)显像相比于111In-DTPA-奥曲肽,具有更高的靶本比、病灶探测率及诊断准确性,已得到临床广泛认可[7]。
近年来,利用核素进行检查和治疗越来越受到临床的重视,准确便捷地计算内照射剂量是放射性新药评价安全性的必要工作,正确计算显像剂的内照射剂量对放射性药物的评价有重要意义。本文参照ICRP103出版物提供的组织权重因子,使用医用内照射剂量学(Medical Internal Radiation Dose,MIRD)方法,基于99mTc-HYNICTOC在人体内的分布,利用内照射计算软件OLINDA/EXM及GE Dosimetry Toolkit计算其在5例没有明显异常浓聚灶的神经内分泌肿瘤患者体内各器官的吸收剂量、全身吸收剂量及全身有效剂量,为临床安全使用99mTc-HYNIC-TOC提供依据。
1 资料和方法
1.1 临床资料
选取2018年5—6月于复旦大学附属肿瘤医院核医学科进行99mTc-HYNIC-TOC显像的5例神经内分泌肿瘤患者。其中女性3例,男性2例;年龄21~60岁(中位年龄44岁±17岁)。
1.2 药物制备及数据采集
99mTc-HYNIC-TOC由复旦大学附属肿瘤医院核医学科根据先前研究[8]自行制备,现已开发为试剂盒,标记物放射化学纯度经纸层析法和放射薄层层析法检测大于95%。显像仪器为美国GE公司的Discovery NM/CT 670单光子发射计算机断层显像(single photon emission computed tomography,SPECT)/CT,配备低能高分辨平行孔准直器。影像数据前期处理使用美国GE公司Dosimetry Toolkit软件(Xeleris 3.0423),有多篇文献[9-11]使用该方法计算了放射性药物在人体内照射剂量。内照射剂量估算软件为OLINDA/EXM 1.1,购自美国范德堡大学。受试者静脉注射370 MBq(10mCi)99mTc-HYNIC-TOC,注射前嘱其排尽尿液,注射后分别于0.5、1.0、2.0、4.0和8.0 h行全身平面前后位显像;其中2.0 h时间点平面显像后即刻行SPECT采集,采集范围从患者颈部至耻骨联合,先常规低剂量CT采集,后SPECT采集。制作1 mL浓度为37 MBq/mL的99mTc-HYNIC-TOC点源1枚,采集图像时置于患者头顶正上方10 cm处作为参照源。上机检查前去除患者身上金属物件,检查时取仰卧位、上肢自然下垂、贴近躯干、全身放松及平稳呼吸。配置低能高分辨平行孔准直器采集数据;采集能峰140 keV,窗宽20%;全身平面显像采集矩阵256×1024,采集速率15 cm/min,全身断层采集矩阵128×128,探头旋转360°,30 s/帧,共60帧。
1.3 数据分析
在SPECT/CT的融合图像中,利用美国GE公司Dosimetry Toolkit软件,勾画心、肺、肝脏、脾脏、肾脏及全身感兴趣区(region of interest,ROI),作为源器官。将分别勾画好的源器官ROI投射到经先前配准后的各时相全身平面图像上(图1),生成各源器官的时间-活度图。随后将数据输入OLINDA/EXM 1.1软件中对其进行拟合并对拟合后的曲线积分,从而获得各器官的滞留时间。将各器官的滞留时间、使用的核素及使用的人体体模,输入至OLINDA/EXM1.1软件中,最终计算出全身各器官的吸收剂量和全身有效剂量。活度与计数的换算通过参照源进行。
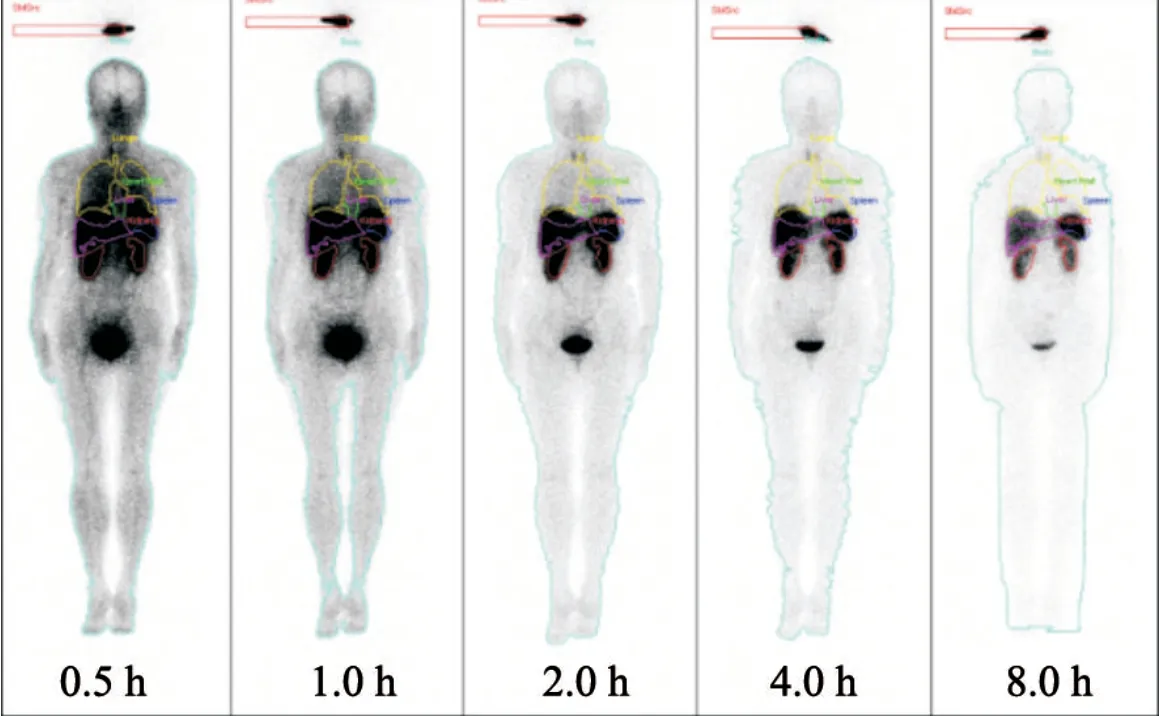
图1 1例注射99mTc-HYNIC-TOC后0.5~8.0 h女性患者全身影像及器官分割图Fig.1 Whole-body images and segmented source organs of a female subject from 0.5 h to 8.0 h after 99mTc-HYNIC-TOC administration(370 MBq)
2 结果
2.1 99mTc-HYNIC-TOC在体内的生物分布
99mTc-HYNIC-TOC在受试者各源器官及全身不同时间点分布见图2。99mTc-HYNIC-TOC在全身各器官放射性分布对于女性从高到低分别为肝脏、肺、脾脏、肾脏和心脏,对于男性从高到低分别为肺、肝脏、脾脏、肾脏和心脏。
2.2 99mTc-HYNIC-TOC在人体各源器官内的放射性滞留时间
99mTc-HY NIC-TOC在人体各源器官内的放射性滞留时间见表1。99mTc-HYNIC-TOC在肝脏和肺的滞留时间较长,对于男性分别为(5.28E-01±3.51E-01)和(5.85E-01±7.71E-02)h,对于女性分别为(6.00 E-01±1.73E-01)和(3.55 E-01±1.06 E-01)h。在脾脏、肾脏和心脏的滞留时间较短,对于男性分别为(4.98E-01±1.68E-01)、(2.79E-01±3.61E-02)和(1.07E-01±1.28E-02)h,对于女性分别为(2.48E-01±1.13E-02)、(2.86E-01±9.26E-02)和(1.04E-01±5.79E-02)h。

图2 人体各源器官及全身时间-ID%曲线Fig.2 Mean percentage of injected dose (ID%) as a percentage of injected dose for source organs and the total body
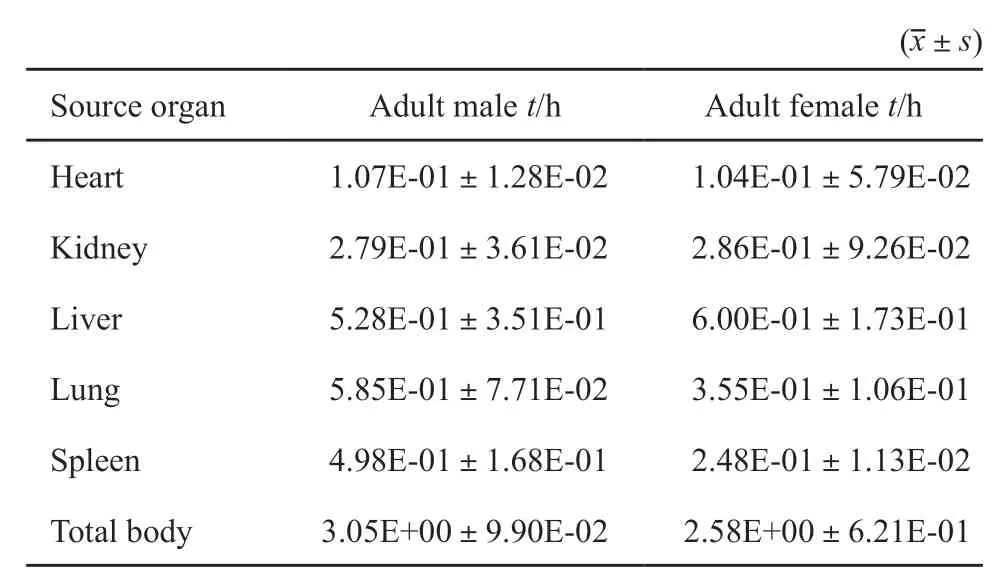
表1 99mTc-HYNIC-TOC在人体各源器官内的滞留时间Tab.1 Residence time of 99mTc-HYNIC-TOC for source organs and remainder of the body
2.3 99mTc-HYNIC-TOC在人体各器官的单位活度吸收剂量和全身单位活度有效剂量
根据各源器官放射性滞留时间,利用OLINDA/EXM 1.1软件计算成年人体体模各器官单位活度吸收剂量及全身单位活度有效剂量,结果见表2。脾脏、膀胱和肾脏的单位活度吸收剂量较高,男性分别为0.042、0.019和0.016 mGy/MBq,女性分别为0.026、0.027和0.017 mGy/MBq。大脑、皮肤和甲状腺的单位活度吸收剂量较低,男性分别为0.0003、0.0005和0.0005 mGy/MBq,女性分别为0.0003、0.0005和0.0006 mGy/MBq。对放射性敏感的器官如骨原细胞、胸腺和红骨髓的单位活度吸收剂量均较低,范围为0.0012~0.0022 mGy/MBq。全身平均单位活度吸收剂量男性为0.0017 mGy/MBq,女性为0.0016 mGy/MBq。全身单位活度有效剂量男性为0.00458 mSv/MBq,女性为0.00455 mSv/MBq。
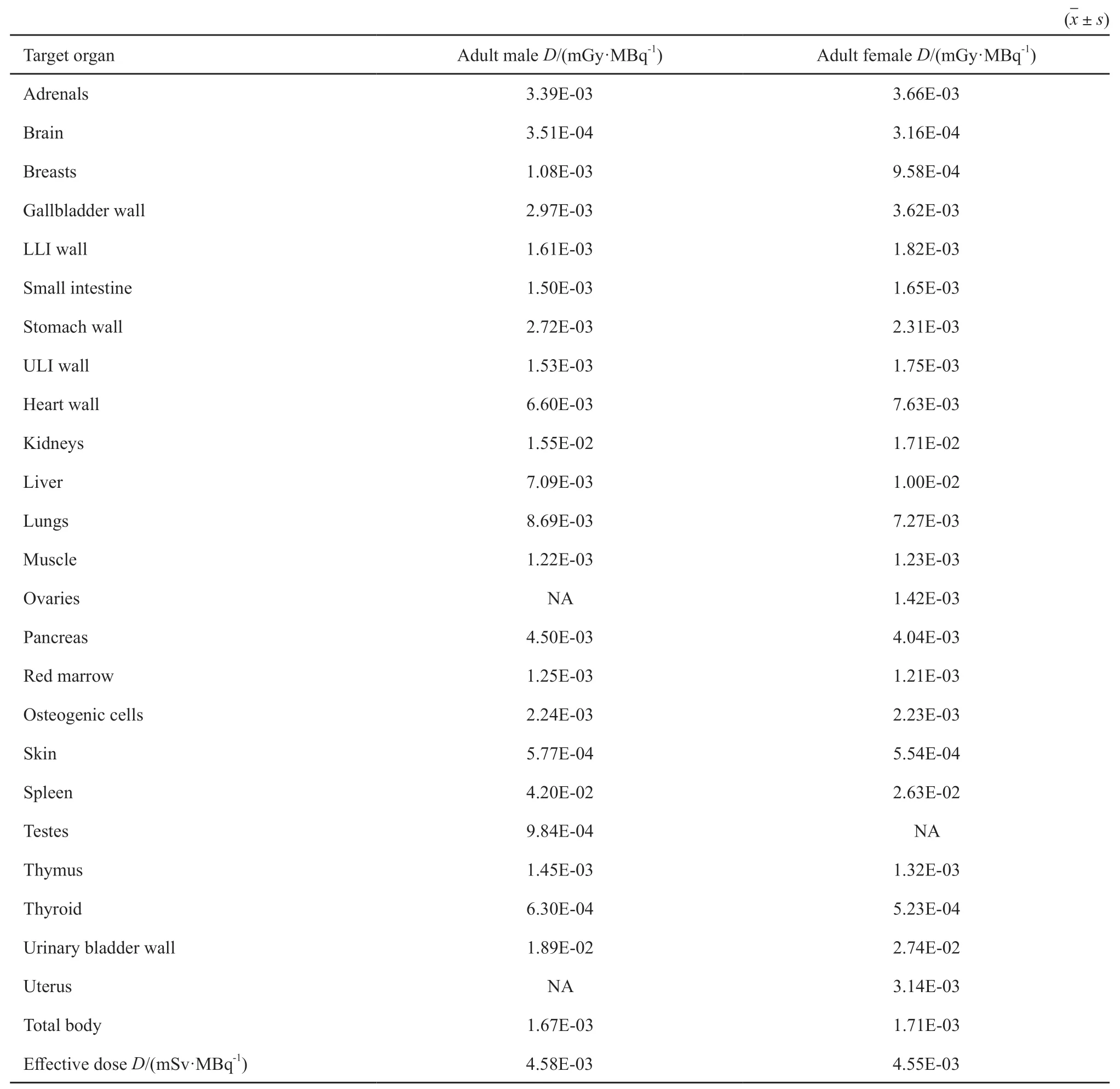
表2 99mTc-HYNIC-TOC在人体单位活度吸收剂量和单位活度有效剂量Tab.2 Subjects absorbed dose coefficients and effective dose coefficient of 99mTc-HYNIC-TOC
3 讨 论
近年来,因生长抑素受体与神经内分泌肿瘤的高度亲和,已被多个国际指南列为神经内分泌肿瘤显像的“金标准”。复旦大学附属肿瘤医院核医学科拥有多年的99mTc-HYNIC-TOC临床应用经验,表明其在神经内分泌肿瘤分期及随访中有重要价值[12-13]。本文通过99mTc-HYNIC-TOC在人体内的生物分布获得了其在体内各器官的滞留时间,并通过OLINDA/EXM 1.1软件计算出其在人体各器官的吸收剂量,从而获得了全身有效剂量,此方法相对简单且被广泛使用。
99mTc-HYNIC-TOC在人体内分布数据显示其清除迅速,主要通过肝胆消化系统排泄,辅助以泌尿系统排泄。肺组织的放射性摄取偏高可能与该器官本身生长抑素受体偏高有关[12],其他文献也有类似结果[6,14-15]。本研究利用美国GE公司Dosimetry Toolkit软件分析了99mTc-HYNIC-TOC在人体内的生物分布并得到体内各器官的滞留时间,并利用OLINDA/EXM 1.1软件得到了其在人体各器官的吸收剂量和有效剂量。此方法相对简单,与通过放射性药物在动物体内的分布间接计算其在人体内的剂量分布相比更加直接准确。但在计算过程中仍然提出了一些假设,本研究使用的MIRD方法是基于放射性分布可瞬间均匀分布于各器官,且没有被直接测量器官的放射性活度均归于剩余组织。此外,因该药物生物半衰期较短且在8.0 h时间点其全身分布已经较少,故只采集到注射药物后的8.0 h时间点。
当前,计算单光子药物内照射剂量常用的方法有两种,一种是通过在不同时间点采集受试者的全身SPECT影像,每个时间点全身SPECT影像需采集3~4个床位,众所周知,每个床位SPECT成像时间非常长,这样在注射药物后即刻采集的全身SPECT图像会因床位之间采集时间差而造成床位之间药物体内代谢不同时的问题。另一个方法是,各时间点只采集平面图像,这种方法将三维人体人为压缩成二维,所带来的计算误差较大。本研究利用美国GE公司开发的全新计算模式解决了上述问题,其采用平面成像结合SPECT成像的方法,在采集时间和代谢同时性方面都有很大的提升。Dosimetry Toolkit软件支持3种不同的场景,包括多个全身SPECT/CT场景、多个全身平面场景及混合有平面和SPECT/CT的混合场景。为了避免多次全身SPECT成像时间过长的问题,本研究选择了混合成像方案。传统上,对于器官分割,很难利用2D平面图像手动分割器官,特别是对于示踪剂吸收较低的区域,无法确定器官的边界。与传统技术不同,Dosimetry Toolkit软件提供了一种计算机辅助半自动方法,即首先在3D SPECT/CT图像上勾画ROI,后通过软件配置定位,自动将3D-ROI投影到平面影像上,为获取2D平面影像ROI勾画提供了一种更加一致和便捷的方法。
本研究估算的99mTc-HYNIC-TOC所致全身单位活度有效剂量,对男性为0.00458 mSv/MBq,对女性为0.00455 mSv/MBq,如按1次显像所需的剂量370 MBq来计算,所得的全身有效剂量男女性分别为1.695和1.684 mSv,低于标准阈值(5 mSv)。本研究获得的99mTc-HYNIC-TOC致全身单位活度有效剂量与我们先前通过动物体内分布推算出的人体单位活度有效剂量[8](0.00459 mSv/MBq)高度相近。与另一直接研究该药物致人体内照射剂量的报道[16]相比,单位活度有效剂量的值也高度相似(该报道结果为:0.006 mSv/MBq),但明显低于111In-DTPATOC[17](0.08 mSv/MBq)。同时,其体内的单位活度有效剂量也远低于68Ga标记的TOC靶向示踪剂,包括68Ga-DOTATATE[18]的0.0257 mSv/MBq、68Ga-DOTATOC[19]的0.023 mSv/MBq和68Ga-DOTANOC[20]的0.0167 mSv/MBq。这可能是因为68Ga发射双光子,其能量高于99mTc单光子能量。以上结果均证实本文使用的估算人体内照射剂量方法是可行的,可为放射性药物的安全性评估和加快临床转化提供新的可行方案。从本研究计算得知,99mTc-HYNIC-TOC在全身各器官的吸收剂量及有效剂量因男女性别不同略有差异,这种差别可能是因为该药物在男女性各器官滞留时间不同所导致。
本研究的主要局限性在于样本量小,但是有效剂量的标准偏差较小表明本研究分析的重复性尚可。另一个限制是在较长的时间内对每个患者采集了多个时间点,因此很难保证一致的扫描位置,这很可能会由于微小的器官移位导致计算不准确。另外,基于剂量估算过程提出的假设也有局限性。首先,根据MIRD建立的方法,放射活性应在给药后立即均匀地分布在全身。其次,任何无法测量的放射性都被分配给体内的其他器官。
综上所述,99mTc-HYNIC-TOC 主要通过肝胆系统进行排泄,辅助以泌尿系统排泄。我们的剂量学研究还表明,在常规临床剂量(370 MBq)下,99mTc-HYNIC-TOC的有效剂量对男性为1.695 mSv,对女性为1.684 mSv,数值与其他TOC抑制剂的有效剂量类似,表明其可能是安全的SPECT神经内分泌肿瘤的示踪剂。

