超声引导下微创消融治疗子宫腺肌症疗效评估
芦 霄,秦海英,张 悦,顾东岳,胡靖熙,何光彬
(空军军医大学西京医院超声医学科,陕西 西安 710032)
子宫腺肌症指子宫内膜的腺体和间质出现在子宫肌层,导致局限或弥漫性病变[1],是育龄期妇女常见疾病。其主要临床表现为经期疼痛、经血过多、月经失调以及不同程度的贫血症状等[2-3]。该病临床治疗方法包括手术、药物及各类微创治疗[2]。因各自面临的治疗局限性,效果难以达到临床预期,如子宫切除术不适用于部分希望保留子宫及年轻女性患者[4-5],药物治疗易复发或常发生不良反应[6],子宫动脉栓塞术对卵巢功能的影响尚待确定等[4],所以近年来不断有学者报道超声引导下微波、射频、高强度聚焦超声对子宫腺肌症的治疗研究[7-11]。本回顾性研究旨在探讨及完善微创治疗子宫腺肌症的安全性及有效性,为临床上治疗方法的选择提供更多依据。
1 资料与方法
1.1 一般资料 回顾性分析2004年8月至2018年8月在我院行超声引导下微创消融治疗的178例子宫腺肌症患者临床资料,所有患者均行穿刺诊断,病理结果为子宫腺肌症。年龄24~51岁,平均(39.3±5.6)岁;子宫平均体积为(205.13±75.89)cm3;病灶平均体积为(109.89±55.63)cm3;病灶位于子宫前壁41例(23.0%),后壁137例(65.7%),并发巧克力囊肿30例(16.9%)。131例患者伴有月经增多(73.6%),痛经149例(83.7%),贫血121例(68.0%),月经伴血块138例(77.5%)。
1.2 仪器与方法
1.2.1 仪器设备:二维超声及超声造影采用Philips EPIQ7、凸阵探头 C5-1微波治疗仪(南京康友医疗科技有限公司);射频治疗仪(Covidien)及Cool-tip冷循环系统;造影剂六氟化硫微泡(Sono Vue,Bracco公司)。
1.2.2 术前准备:超声科及妇产科综合患者年龄、病灶大小、症状及治疗意愿评估治疗方式。选择无强烈生育愿望患者,充分知情同意后选择微创消融术,并签署术前知情同意书。同时进行术前实验室检查(血常规、肝肾功能、离子五项、CA125、术前感染四项、血凝全套、白带常规、尿常规、大便常规)、影像学检查(增强MRI、超声造影)、填写相关症状及生活质量调查表。排除严重贫血、出血倾向、重要脏器功能衰竭患者。微创消融术于月经结束后3~7 d内进行。术前1 d 22∶00后禁食禁饮,术中行不插管全麻。
1.2.3 治疗操作:患者取仰卧位,超声造影评价病灶大小、位置、边界、血供情况。治疗区备皮、留置导尿管、开放静脉通路;如子宫位置欠佳,可用经阴道探头挑起,进行适当调整,并起到一定固定作用。常规消毒铺巾,在超声引导下避开肠管、膀胱(探头适当加压可将肠管挤开),将微波针穿刺入靶病灶预定位置后开始消融,如治疗区域形成气化,将针退至病灶表面,摆动针柄再次进入病灶,多角度穿刺治疗,直至治疗区域完全覆盖病灶后拔针。如病灶最大径≥5 cm,可采用双针消融。对于治疗区域靠近肠管时,可建立人工腹水,以隔离周围肠管及膀胱,避免周围组织热损伤。术中行心电监护,监测患者生命体征。
1.2.4 术后评估:记录患者术中、术后即刻疼痛情况。术后1 d行超声造影检查评估坏死范围,以坏死体积占病灶体积百分比为消融率[12],术后1、3、6、12个月行超声检查,评估病灶内彩色血流情况,超声造影评估增强情况、病灶大小;行实验室检查(血常规、CA125);并记录相关症状及生活质量评分。病灶体积计算方法[13]:V(cm3)=长×宽×高×0.5233。病灶体积缩小率[14]=(V1治疗前-V2随访期)/V1治疗前×100%。临床效果评价标准[11]:①疗效非常显著:术后3个月病灶体积缩小率≥50%,相关症状及生活质量评分下降≥50%,贫血患者血红蛋白较术前升高;②疗效显著:术后3个月病灶体积缩小率≥30%,相关症状及生活质量评分下降≥30%,贫血患者血红蛋白较术前升高;③有效:术后3个月病灶体积缩小率≥10%,相关症状及生活质量评分下降≥10%,贫血患者血红蛋白较术前略升高;④无效:术后3个月病灶体积缩小率<10%,相关症状及生活质量评分无变化或升高,贫血患者血红蛋白较术前无变化或下降。

2 结 果
2.1 影像学检查变化
2.1.1 术后子宫病灶体积变化:术后1 d超声造影示平均非灌注体积为(95.63±53.91)cm3,平均消融率为(91.34±5.42)%。术后1、3、6、12个月病灶体积与治疗前对比差异均有统计学意义(P<0.05),见表1。

表1 术后子宫病灶体积变化
2.1.2 超声造影(CEUS)及彩色多普勒血流(CDFI)变化情况:治疗前,CDFI示所有病灶内可见点条状血流信号;CEUS示病灶首先出现内部条状穿支血管增强影,后呈不均匀渐进性强化,内可见不规则无灌注区。治疗后,CDFI示消融区内无彩色血流信号,CEUS示消融区呈无增强(图1)。
2.2 术后实验室检查变化 术后1、3、6、12个月患者血红蛋白(Hb)、CA125与术前对比差异均有统计学意义(P<0.05),见表2。
2.3 术后临床症状变化 至本次随访结束,月经过多改善率80.2%(105/131),痛经减轻率73.8 %(110/149),贫血改善率为78.5%(95/121)。术后1、3、6、12个月患者VAS疼痛评分、相关症状及生活质量评分与治疗前对比差异均有统计学意义(P<0.05),见表3。
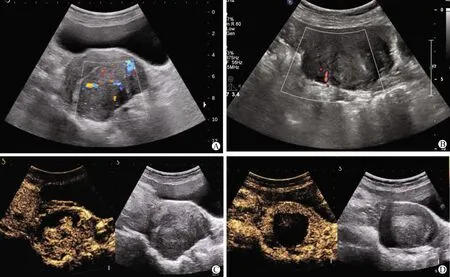
A:术前病灶内见丰富彩色血流信号;B:术后3个月病灶内无明显彩色血流信号;C:术前超声造影示病灶呈不均匀强化;D:术后3个月超声造影示病灶无强化(白色箭头示病灶区)

表2 治疗前后实验室检查变化
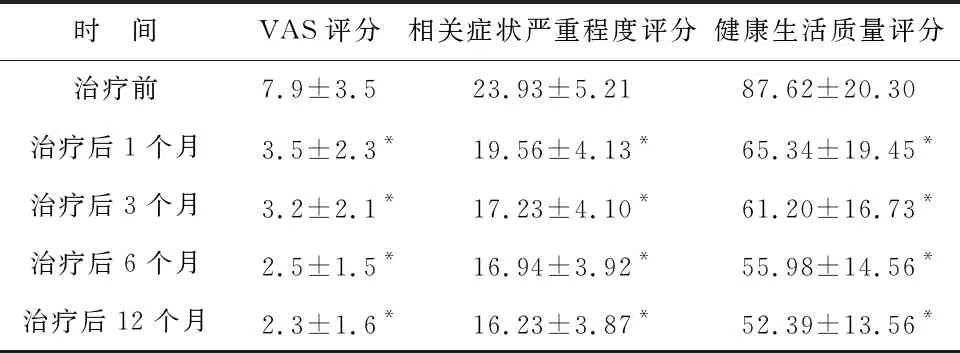
表3 治疗前后临床症状变化(分)
2.4 并发症情况 治疗过程中,所有患者均未出现肠道损伤、膀胱穿孔、腹腔感染等严重并发症。所有患者术后均出现不同程度疼痛,141例为轻微疼痛,术后1 d明显减弱;37例为较明显疼痛,予止疼药,术后1~2 d疼痛减轻。157例患者出现不同程度阴道流液,多为淡红色液体,约在3~5 d左右消失。12例患者出现术后闭经,建议患者妇科就诊。共有45例患者术后1~2年左右出现复发,其中弥漫性病变患者为18例,复发率约为38%(15/39例),局限性病变患者为37例,复发率约为18%(25/139例)。复发患者中,14例患者观察至绝经,8例行子宫切除术,5例放置宫内节育系统,13例行二次微创消融手术。
2.5 疗效评价 结合患者术后病灶体积缩小率、超声造影指标、相关症状及生活质量评分及血红蛋白变化评价,疗效非常显著155例、疗效显著21例、有效1例、无效1例。
3 讨 论
子宫腺肌症按侵袭范围分为弥漫性或局限性[15];弥漫性超声表现为子宫形态饱满,呈球形增大,回声强弱不均呈蜂窝状;局限性表现为肌层局部增厚呈瘤样,肌壁厚薄不一、无明显包膜;腺肌症病变区供血方式以粗大杂乱直入性血管多见[16-17],与经期出血量大及血块多密切相关;该病传统治疗方法中因局限性突出而临床效果不佳,症状较重的患者多以外科子宫切除为主[18],对于相对年轻并且有生育意愿的女性,这不是最优选择[19];随着医疗技术的进步,现代医学朝着微创、精准治疗方向快速发展,超声引导下的肿瘤消融技术以其简便、微创、经济、重复性好、恢复快而备受临床青睐,子宫腺肌症就是其中治疗适应症之一[2,4,7],且对卵巢功能无明显影响[20]。
在本研究的178例子宫腺肌症病例中,患者均存在不同程度痛经、贫血、经期时间延长等临床症状,术后1 d病灶平均消融率为(91.34±5.42)%,在安全消融的前提下保证了极大的消融面积。术后1、3、6、12个月随访中,病灶坏死区逐渐吸收并体积缩小,观察至术后12个月,病灶体积由(109.89±55.63)cm3缩小至(25.36±17.30)cm3;患者临床症状及实验室化验指标随之得以改善,表现为痛经、月经失调、贫血症状较前明显好转,痛经评分降低,相关生活质量评分较前明显好转;血红蛋白升高,CA125降低。上述指标均提示超声引导下微创消融治疗的有效性。另外,我们在随访中也发现,病灶消融范围是临床症状改善的关键因素,消融范围大症状改善明显且持续时间长,消融范围小症状改善情况稍差,因此,安全前提下提倡病灶区消融面积最大化。
本组病例中最常见并发症表现为术后疼痛,多数患者轻度疼痛约在术后2~4 h左右缓解,少数中-重度疼痛予口服止痛药对症治疗,均在术后4 h至3 d缓解,原因与周围组织热损伤及部分患者对疼痛的耐受度有关,也考虑与内膜受刺激产生的宫缩痛有关;88%患者出现不同程度的阴道淡红色流液情况,持续时间在2~18 d,与内膜损伤和治疗灶的炎性渗出密切相关;12例患者出现术后闭经情况,年龄在44~48岁,与内分泌影响程度及病程有关;55例患者1~2年左右出现术后复发,弥漫性子宫腺肌症患者复发率约38%,局限性患者复发率约18%;弥漫性子宫腺肌症患者中远期疗效差于局限性患者,但仍可得到有效的临床症状缓解,后续治疗措施由患者临床症状严重程度及治疗意愿决定;所有患者均未出现膀胱、肠道穿孔,腹腔感染,卵巢、神经损伤等严重并发症,表明超声引导下微创消融治疗的安全性较高。
超声引导下微创消融术对子宫腺肌症有显著疗效,且安全、微创、精准,保留子宫,术后康复快;在保留子宫无需干预生理期基础上完成治疗,可有效减轻或消除临床症状,提高患者生活质量。

