原代人眼Tenon’s囊成纤维细胞的生物学特性及体外培养方案优化
王丽君 李宏松 张文怡 廖丁莹 杨熹婷 王建明
青光眼是常见的不可逆致盲性眼病,滤过手术是抗青光眼的主流治疗方法,但术2年的失败率高达15%~30%[1],研究显示Tenon’s囊成纤维细胞(human Tenon fibroblasts,HTFs)的增殖、迁移以及纤维化在滤过泡瘢痕化过程中发挥着重要作用[2,3]。研究HTFs的功能和生长特性有助于了解滤过泡瘢痕形成的机制,也可以为抗滤过泡瘢痕化药物的研究提供平台。成纤维细胞的分离及原代培养方法多种多样,应用较多的有组织块法和酶消化法[4,5]。组织块法是将组织剪碎后直接铺于培养皿底部,加培养基,经过数日培养后细胞从组织块周围贴壁爬出生长。酶消化法是将组织块经多种蛋白酶消化后种植于培养皿中,培养分离成出纤维细胞。由于酶消化法步骤繁琐、所需试剂种类多、操作技术要求高、易污染等原因,现多采用组织块法培养原代HTFs。但传统的组织块培养方法存在组织块贴壁率低、细胞不易爬出、培养效率低的问题,为了解决此类问题,本研究对人Tenon’s囊成纤维细胞的组织块培养方法进行了优化,意在探讨一种简单、经济、有效的原代人Tenon’s囊成纤维细胞培养方法并对体外培养的HTFs的生物学特性进行研究。
资料与方法
一、材料
主要实验材料有胎牛血清(fetal bovine serum,FBS)(Gibco公司)、DMEM培养基(HyClone公司)、0.25%胰蛋白酶-EDTA(Gibco公司)、青链霉素混合液(索莱宝公司)、PBS(Heart公司)、小鼠抗人波形蛋白(Vimentin)单克隆抗体(Santa Cruze公司)、小鼠抗人角蛋白(Cytokeratin)单克隆抗体(Abcam公司)、山羊抗小鼠DyLight649二抗(Abbkine公司)、山羊抗兔DyLight649二抗(Abbkine公司)、DAPI(碧云天公司)、山羊血清工作液(中杉金桥公司)、噻唑蓝3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyltetrazolium Bromide(sigma公司)、二甲基亚砜(dimethyl sulfoxide,DMSO)(Sigma公司)、Tween20(索莱宝公司)、细胞周期与细胞凋亡检测试剂盒(碧云天公司)。
二、实验仪器
主要实验仪器设备有CO2培养箱(Thermo公司)、超净工作台(苏净安泰公司)、倒置显微镜(Motic公司)、离心机(长沙湘仪公司)、酶联免疫检测仪(BMG LABTECH公司)、荧光显微镜(Leica 公司)、流式细胞仪(ACEA Biosciences公司)。
三、方法
1.取材:采集西安交通大学第二附属医院眼科斜视手术患者的Tenon’s囊组织,患者无全身及其他眼部疾病史,无眼部手术史且年龄小于18岁。取材过程中注意避免沾染结膜上皮组织,置于加有青霉素100 U/ml,链霉素0.1mg/ml的无菌DMEM液中,冰盒储存,快速转运至实验室进行操作。本研究通过西安交通大学第二附属医院伦理委员会审批(审批号:(2019)伦审-研第(014)号)。
2.组织细胞的优化培养:无菌DMEM液冲洗组织块3次,高压灭菌的眼科剪剪除血凝块,将Tenon’s囊组织剪成1~2 mm3组织块,20%FBS的DMEM培养液重悬组织块,倾斜培养皿小心吸弃培养液,使组织块自然、均匀的平铺于6.0 cm培养皿,组织块表面滴加FBS利于组织贴壁,倾斜培养皿置于37 ℃、5%CO2培养箱中培养,期间注意观察组织块,避免组织块干燥,3 h后加1 ml含20%FBS的DMEM培养液覆盖组织块继续培养箱中培养,24 h后补加培养基2 ml,待细胞爬出后每2~3 d轻柔半换液法更换培养液至传代,期间避免用力晃动培养皿以防止组织块脱落。
3.细胞传代:当细胞融合到80%~90%时,用0.25%胰蛋白酶消化细胞,待细胞变圆,细胞间隙变大时加入足量含10% FBS的DMEM培养基终止消化。移入离心管,800 r/min离心5min;吸弃上清,加入含10%FBS的DMEM培养基,按照1:3进行传代。
4.细胞冻存:收集处对数生长期的3~4代细胞,冻存前24 h换液1次,0.25%胰蛋白酶消化后离心收集细胞,以含10%DMSO的FBS为冻存液,调整细胞浓度为4~5×106个/ml,装入冻存管中。依次在4 ℃放置10 min,-20 ℃放置30 min,-80 ℃过夜,最后放置于液氮中长期冻存。
5.细胞复苏:液氮中取出冻存管,快速置于37 ℃水浴中,不断摇晃至冻存液完全溶解,将冻存液转入含有10倍体积完全培养基的离心管中,混匀后800 r/min离心5 min,弃上清液,用完全培养基垂悬细胞后接种于培养瓶中,放置于恒温箱内培养,24 h后待细胞贴壁后换液1次,以后常规培养。
6.HTFs的形态学观察及免疫荧光细胞染色鉴定细胞:在倒置荧光显微镜下观察HTFs的生长状态、数量、形态变化等;24孔板的孔内放置无菌玻片1片/孔,以2×104个细胞/孔的密度将细胞接种于玻片上。待细胞密度为80%时吸弃原培养液,用4 ℃预冷的PBS轻柔润洗3次,每次3 min。4%多聚甲醛室温固定15~20 min,吸弃固定液,用4 ℃预冷的PBS轻柔润洗3次,每次5 min。0.5%Triton~X100室温放置15 min,通透细胞膜,PBS轻柔润洗3次,每次5 min。山羊血清工作液封闭,室温孵育30 min。吸弃封闭液,加入山羊血清工作液稀释的一抗(Vimentin 1:50,Cytokeratin 1:250),阴性对照用PBS代替抗体,4 ℃过夜。第2天吸弃一抗,PBST轻柔润洗3次,每次5 min。加入DyLight标记的二抗(1:50),室温放置1 h,注意避光。吸弃二抗,PBST轻柔润洗3次,每次5 min。加入DAPI室温避光放置5 min进行核染。PBST轻柔润洗3次,每次5 min。使用抗荧光猝灭封片剂封片,并于1 h内在荧光显微镜下观察并拍照计算免疫荧光染色阳性细胞的比例。
7.MTT 法检测细胞增殖及生长曲线:取第3代HTFs,以3000个/孔接种至96孔板中,每组6个平行孔,同时设置调零孔,每隔24 h,取6个孔,加入MTT溶液20 μml(5 mg/ml),继续培养4 h;吸尽培养基,每孔加入DMSO 150 μl,震荡10 min,酶标仪读取490 nm处的吸光度(OD值)。以时间(d)为X轴,以OD值为Y 轴绘制生长曲线。
8.流式细胞术检测细胞周期:取处于生长对数期的第3~4代HTFs,胰蛋白酶消化制备单细胞悬液,离心收集细胞。用预冷的PBS洗涤后,加入1 ml预冷的70%乙醇中固定,4 ℃固定24 h。离心收集细胞,加入约1 ml预冷的PBS,重悬细胞,再次离心沉淀细胞,小心吸除上清。加入染色缓冲液0.5 ml,PI 25 μl、RNase A 10 ml,缓慢并充分重悬细胞沉淀,37 ℃避光温浴30 min,随后可以4 ℃避光存放。当日用流式细胞仪在激发波长488 nm波长处检测红色荧光。计算增殖指数(proliferation index,PI)。增殖指数PI=(G2/M+S)/(G2/M+G0/G1+S)×100%。[6]
四、统计学方法

结 果
一、原代培养细胞形态
组织块贴壁于培养皿底面,第4~7天可以见长梭形细胞从组织块周围爬出,贴壁生长,细胞多为长梭形(图1A),然后细胞数量逐渐增多,2~3周左右大量细胞贴壁生长,呈紧密排列的单层长梭形或多边形,放射状或漩涡状排列(图1B)。传代后细胞呈长梭形、多角形(图1C),细胞汇合程度高时细胞可呈多边形改变,呈蜗旋状或者放射状聚集(图1D),均为典型的成纤维细胞形态表现。细胞1:3传代后4~5 d长满,冻存复苏后细胞生长良好。
二、HTFs生长曲线
细胞传代后0~2 d细胞数无明显增长,处于生长潜伏期;2 d后细胞数明显增加,生长曲线斜率增大,呈对数生长;6 d细胞数达到最大值;随后细胞数有所减少,进入退化期,细胞生长曲线近似S形(图2)。此生长规律符合一般细胞的生长规律,生长曲线结果提示在第3~5 d细胞增殖能力显著。

图1 Tenon’s囊成纤维细胞形态
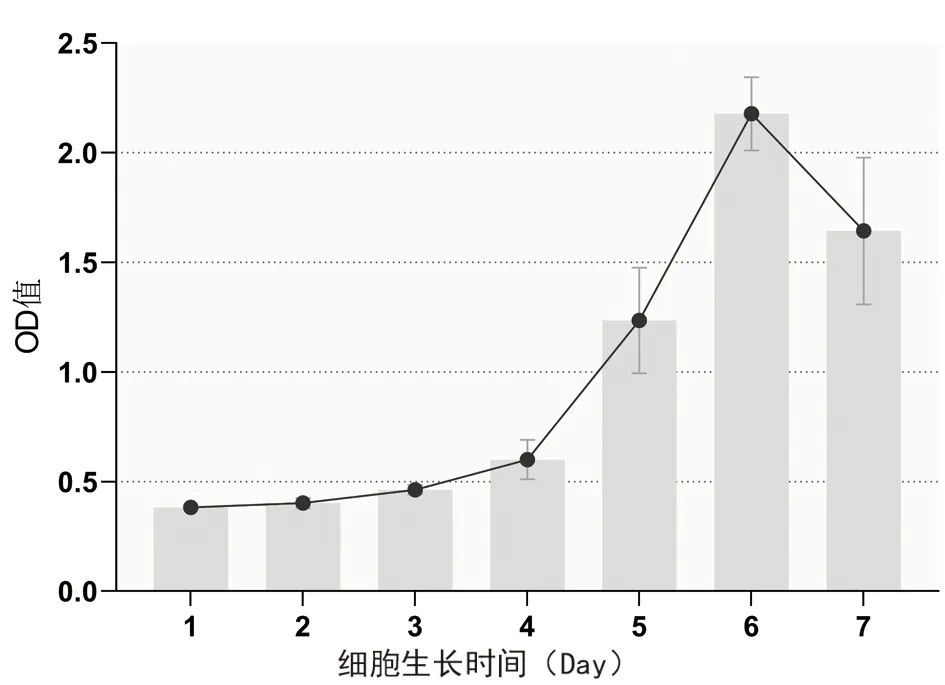
图2 Tenon’s囊成纤维细胞生长曲线
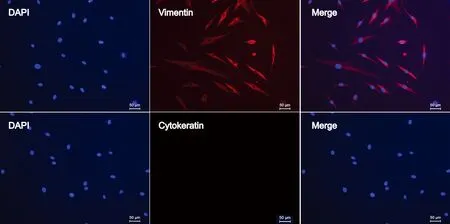
图3 Tenon’s囊成纤维细胞Vimentin及Cytokeratin免疫荧光染色

图4 Tenon’s囊成纤维细胞细胞周期
三、HTFs鉴定
Vimentin免疫荧光染色阳性细胞的胞浆内可见与细胞长轴方向一致的红色束状或网状结构,细胞核未染色,Vimentin免疫荧光染色阳性细胞比例达98%,Cytokeratin免疫荧光染色为阴性,此结果符合HTFs特性且无上皮细胞污染。
四、HTFs的细胞周期
细胞周期检测结果显示,第3~4代HTFs中(63.48±10.22)%处于G0/G1期,(10.80±5.07)%处于G2/M期,(24.34±8.07)%处于S期(图4)。PI为35.6%,细胞增殖活性好。
讨 论
HTFs在青光眼滤过术后滤过道瘢痕化的过程中扮演着重要的角色,HTFs的活化、迁移、增殖,及其合成分泌细胞外基质等都是滤过泡瘢痕化的重要机制[2,3]。因此HTFs的成功培养是研究滤过泡瘢痕化的重要基础。
HTFs为间质来源细胞,间质来源的细胞含有波形蛋白(Vimentin)[7,8],但在Tenon’s囊组织取材、培养的过程中很有可能混入结膜上皮细胞,结膜上皮细胞的沾染会影响细胞纯度及后续实验研究。因此我们采用免疫荧光的方法检测所培养细胞的性质和来源,通过检测HTFs的阳性指标Vimentin蛋白以及结膜上皮细胞的阳性指标Cytokeratin蛋白,同时采用DAPI进行细胞核染色标记,以此来计算阳性细胞比例(阳性细胞/总细胞×100%)。经验证,本研究中所培养的原代细胞的Vimentin阳性细胞比例达98%,Cytokeratin为阴性。本研究中所培养的细胞胞体呈长梭形,可有2~3个突起,与HTFs的典型形态学特征一致。因此,本研究中培养的细胞是HTFs。
活细胞可通过线粒体能量代谢过程中琥珀酸脱氢酶的作用使淡黄色的MTT分解产生蓝色结晶状甲瓒沉积于细胞内或细胞周围,且形成甲瓒的量与细胞活性成正比,测定细胞活性水平可以间接反映细胞增殖的情况,MTT法是一种重要的测定细胞增殖活性的技术方法[9]。本研究采用MTT法对HTFs的生长情况进行了检测,并绘制了细胞生长曲线,得出HTFs在传代接种后3~5 d生长旺盛,适合后续研究。同时,流式细胞仪检测细胞周期结果提示对数生长期的HTFs增殖指数为35.6%,细胞增殖活性好。
组织块贴壁培养法是一种应用已久的原代细胞培养方法,但传统培养方法下Tenon’s囊植块不易贴壁,加入培养基后极易浮起,从而导致细胞培养失败。因此,我们在传统组织块贴壁培养法的基础上进行了优化改进以提高培养效率。优化组织块贴壁培养的方案主要包括以下几点:(1)术中显微镜下取材,避免收集的组织中混有结膜上皮组织,此方法可大大提高原代培养细胞的纯度;(2)20%FBS的DMEM培养液重悬组织块后倾斜培养皿小心吸弃培养液,使组织块自然、均匀的平铺于培养皿底部,这样组织块可以保持在液体环境下的舒展状态贴合培养皿底,贴合更加紧密;(3)组织块表面滴加FBS有利于组织块粘附培养皿底;(4)少量分次添加培养液可防止组织块浮起;(5)原代细胞长出后采用半换液法进行培养,可以避免植块及新生细胞生长微环境较大的变化。本研究的原代HTFs培养方法较好的解决了Tenon’s囊组织贴壁困难的问题,具有方法简单、无需额外添加促生长细胞因子、操作步骤少、污染机会少等优点。
总之,该方法能获得纯度高、活力好的原代人Tenon’s囊成纤维细胞,是一种简单、经济、有效的人原代Tenon’s囊成纤维细胞培养方法,为研究青光眼滤过泡瘢痕化提供了可靠的靶细胞模型。

