肿瘤驱动基因拷贝数变异检测的应用研究进展
王冰,王军,杨忠,王会如(通信作者)
1 北京市医疗器械检验所 (北京 101111);2 北京理工大学生命学院 (北京 100081)
肿瘤个体化治疗需要阐明个体患者的遗传倾向、肿瘤组织组成、肿瘤组织学图谱、组织微环境、并发症、生活方式和生命质量等各个方面[1]。肿瘤的形成是一个多步骤的过程,究其根本是由遗传变异的积累所导致的。这些遗传变异包括肿瘤驱动基因或抑癌基因的拷贝数变异(copy number variation,CNV)、单核苷酸变异(single nucleotide variants,SNV)、插入缺失突变(insertion-deletion mutation,In/Del)、融合变异(fusion mutation)及染色体倍性的变化[2]。肿瘤驱动基因CNV是肿瘤细胞基因组变异检测的重要生物标志物,临床上针对发生CNV的靶标选择合适的靶向药物,合理改进治疗方案,使治疗更有针对性,避免患者产生不良反应及过度医疗的发生。
分子诊断试剂、生化诊断试剂与免疫诊断试剂共同组成了体外诊断(in vitro diagnostics,IVD)试剂的版图,其中,肿瘤驱动基因CNV 的检测也覆盖了IVD 试剂的各个层面。荧光原位杂交(fluorescence in situ hybridization,FISH)和免疫组化(immunohistochemistry,IHC)是临床上检测肿瘤组织驱动基因CNV 的常规方法,但只能定性地对CNV 进行分析。基因检测技术的创新和迭代使得CNV 的定量检测成为可能,在肿瘤驱动基因CNV 检测领域展现出巨大优势。但是,基因检测技术对检测环境要求高,操作流程复杂,样本制备和检测流程标准化、自动化程度低,且人员操作的熟练度和规范程度各不相同,导致检测结果存在较大差异,缺乏可比性。因此,研制用于CNV 检测的分子IVD 试剂溯源的标准物质,对助力肿瘤驱动基因CNV 分子诊断试剂的研发、注册和监管以及分子实验室检测能力的规范和提升具有重要意义。
1 肿瘤驱动基因CNV 致癌机制
CNV 是遗传变异的重要来源,是一种大于1 kb 的DNA片段的变异,变异片段发生重复且与个体间基因组片段重复数量存在差异[3],包括了缺失、重复、倒位及易位等多种变异形式,极大地丰富了基因组遗传变异的多样性[4]。CNV 在人类基因组中广泛分布,一般表现为两种模式:一种是有丝分裂过程中染色体分离异常而发生的广泛性CNV(broader CNV,bCNV),重复区域可以发生在染色体臂的大部分区域[5];另一种是由于DNA 的修复错误导致的发生在染色体臂小范围内的局灶性CNV(focal CNV,fCNV)[6]。fCNV 更频繁地发生在肿瘤驱动基因上[3,7]。CNV 如果发生在肿瘤相关基因序列内部或周围可能引起癌基因激活、抑癌基因失活.最终导致肿瘤的发生。CNV 通过改变基因剂量、调节基因活性影响基因表达、表型差异和表型适应,从而引起肿瘤以及其他遗传疾病[8]。
Diskin 等[9]分析了成神经细胞瘤易感基因的CNV,发现1q21.1区域的CNV 与成神经细胞瘤的发生高度相关,该区域拷贝数的变化使得成神经细胞瘤断裂点家族23(neuroblastoma breakpoint family 23,NBPF23)的基因表达量显著上调。纪念斯隆凯特琳癌症中心(Memorial Sloan Kettering Cancer Center,MSK)Chris Sander 团队利用癌症基因组图谱TCGA 中涉及12个肿瘤类型的3 299个肿瘤组织样本基因组学数据,提取了数千个发生变异的遗传和表观遗传特征,将所有肿瘤分为体细胞基因突变类(mutations,M Class)和拷贝数变化类(copy number changes,C class),多种类型的肺癌、乳腺癌、卵巢癌和子宫内膜癌等都属于C 类。这些肿瘤CNV 研究对于今后C 类肿瘤患者的治疗是至关重要的[10]。有研究显示,在非小细胞肺癌中,CNV 和免疫相关基因表达谱(gene expression profiling,GEP)在预测免疫治疗临床获益方面有重要价值[11]。胃肠道肿瘤免疫检查点抑制剂(immune-checkpoint-blockade,ICB)治疗中,CNV 的预测和预后价值存在显著相关性。Lu 等采用全外显子测序等方法,比较分析了CNV 负荷、肿瘤突变负荷(tumor mutation burden,TMB)和程序性死亡配体1(programmed death ligand 1,PD-L1)等分子特征在胃肠道肿瘤患者的预测及预后意义。结果表明,肿瘤CNV 负荷与胃肠道肿瘤患者免疫治疗临床获益相关,且较低的CNV 负荷的患者接受ICB 治疗疗效及预后较好。CNV 负荷有成为新的胃肠道肿瘤免疫治疗生物标志物的巨大潜力[12]。
在如肺癌、乳腺癌和胃癌等许多人类恶性肿瘤的发病机制中,表皮细胞生长因子受体基因(epidermal growth factor receptor,EGFR)、人表皮生长因子受体-2基因(human epidermal growth factor receptor 2,HER2 )以及间质 - 上皮细胞转化因子基因(mesenchymal-epithelial transition factor,MET)的扩增和由此导致的对应蛋白质表达量的增加发挥了重要作用。
EGFR也称受体酪氨酸激酶1基因(receptor tyrosineprotein kinase erbB-1, ERBB1),位于人7号染色体短臂上,长度约192 kbp,含有28个外显子,属于人类表皮因子受体基因家族4个成员之一。EGFR属于表皮生长因子(epidermal growth factor,EGF)细胞增殖、信号转导的受体,主要由胞外功能区、跨膜区和胞内区3部分组成。其中胞外功能区是联结EGF的主要配体,胞内区存在突出的酪氨酸激酶活性物质,当EGFR联结于配体后,于细胞外组成同源二聚体、异源二聚体等物质,并随着二聚体内陷变化,而出现构象变化,导致分子自身逐渐磷酸化激活,形成有丝分裂样表现,酪氨酸经磷酸化后,可激活分子位点、引发信号传导机制及激活下游等多个通路。其中EGFR的18-21号外显子编码酪氨酸激酶结构域,该区域发生突变后一般会导致该结构域活性增强。小分子抑制剂与该区域结合,阻止受体出现磷酸化,阻断下游信号通路[13]。研究认为EGFR基因的扩增与胃-食管交界处和远端食管的肠道腺癌[14]以及非小细胞肺癌(non-small cell lung cancer,NSCLC)[15]的发生相关联,可以作为判断响应抗EGFR靶向治疗的疗效和预后的生物标记物。Knebel等通过对NSCLC患者连续抽血进行液体活检来检测EGFR的突变,提出了“EGFR的扩增是NSCLC患者对奥希替尼(osimertinib)产生耐药性的一种机制”的假说[16]。
HER2基因也称为受体酪氨酸激酶2基因(receptor tyrosine-protein kinase erb-2,ERBB2),位于人17号染色体长臂上,长度约为42.5 kbp,含有31个外显子,属于人类表皮因子受体基因家族4个成员之一,该家族表达酪氨酸激酶(receptor tyrosine kinases,RTKs)跨膜蛋白受体[17]。HER-2蛋白介导的信号转导途径主要有Ras/Raf/分裂素活化 蛋 白 激 酶(mitogen-activated protein kinase,MAPK)途径、磷脂酰肌醇-3-羟基激酶(phosphoinositide3-kinase,PI3K)/Akt 途径和信号转导及转录激活(signal transducer and activator of transcription,STAT) 途 径 等[18-20]。 这 些 通路与细胞增殖密切相关,HER2发生扩增时,其蛋白质表达量增加,进而开启上述信号通路的转导,促进细胞快速增殖,抑制细胞凋亡,促使肿瘤的形成[21]。研究认为,HER2的扩增与乳腺癌患者的预后密切相关[22]。在HER2发生扩增的乳腺癌治疗过程中,针对HER2的单克隆抗体能够极大改善HER2阳性乳腺癌患者的预后,例如曲妥珠单抗(trastuzumab)就有非常好的疗效[23]。
MET 基因表达的蛋白质一般称为c-MET,位于人7号染色体长臂上,长度约为125 kb,含有21个外显子,是一种具有高度结合性的受体酪氨酸激酶,属于RON 亚族。MET 在多种人类肿瘤中呈现异常表达,表现为细胞活性异常或者遗传信息的改变[24]。c-MET 是肝细胞生长因子(hepatocyte growth factor,HGF)唯一已知受体。HGF 与c-Met 胞外域结合后,诱导c-Met 激酶结构域发生磷酸化,激活下游信号通路,引起蛋白酪氨酸激酶(protein tyrosine kinase,PTK),进而激活酪氨酸残基自身磷酸化,激活PI3K/Akt/mTOR 信号通路,信号传导入细胞核,促进细胞增殖、分化或引起细胞形态改变及侵袭运动。NSCLC 中,c-MET磷酸化激活下游PI3K/Akt 通路,导致肿瘤对吉非替尼耐药。c-MET 小分子酪氨酸酶抑制剂也是目前临床试验广泛研究的重点[25]。c-MET 蛋白的表达情况也与乳腺癌[26]、结直肠癌[27]以及胃癌[28]等癌症的发生发展密切相关。
2 肿瘤驱动基因CNV 检测方法比较
FISH是检测细胞核基因组CNV的传统方法,IHC进一步验证该基因扩增后蛋白质表达量的水平,但这两种方法实验过程烦琐、周期长、检测成本偏高,而且需要经验丰富的病理科医师对结果进行解读,对结果的解释主观性较强[29]。随着遗传学、分子生物学和基因组学等学科的发展,出现了多种检测CNV的方法,包括比较基因组杂交(comparative genome hybridization,CGH)、多重链接探针扩增(multiplex ligation-dependent probe amplification,MLPA)、SNP芯片(SNP-chip microarray)、定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)、数字聚合酶链反应(digital polymerase chain reaction,dPCR)以及高通量测序(next-generation sequencing,NGS)等。随着NGS和dPCR技术的迅速发展,使得此两种技术用于CNV检测优势得到凸显,能够克服传统方法的只能定性不能定量的缺点,实现对CNV的绝对定量[30]。
但是NGS 与第三代PCR 新技术dPCR 相比,其在对CNV 进行定值时会呈现高度的复杂性。美国国家标准与技 术 研 究 院(National Institute of Standards and Technology,NIST)开发了两套适用于肿瘤驱动基因CNV 检测的标准物质,一套是基于qPCR 和dPCR 技术定值的HER2基因拷贝数变化的有证标准物质2373(standard reference material®2373,SRM 2373),对5个细胞系的HER2拷贝数比率进行了赋值,并评定了其不确定度[31];另一套是仅使用dPCR方法定值的EGFR 和MET 基因拷贝数变化的标准物质8366(reference material 8366,RM 8366),对6个细胞系的EGFR 和MET 基因的拷贝数比率进行了赋值,并评定了其不确定度[32]。Lih 等使用该HER2的标准物质比较了不同测序方法检测HER2拷贝数的能力,包括了靶向区域测序、全外显子测序以及全基因组测序。尽管不同NGS 测序方法对HER2 CNV 的检测呈现较好的重复性,但是仍表现出基于平台特异性的拷贝数检测值之间的偏倚。这与不同实验室间所用建库方法和生物信息分析流程的差异高度相关。而dPCR 由于其简便的实验流程和分析方法,使得不同dPCR平台间的分析结果更具可比性,准确度和精确度更高[33]。He 等同样利用包括全基因组测序、全外显子组测序和靶向区域测序(2个不同的泛癌种多基因panel)的NGS 方法对RM 8366的EGFR 和MET 基因的拷贝数比率进行测定,并与dPCR 方法赋予的量值进行比较。结果显示其中5个细胞系中,NGS 与dPCR 的检测结果具有比较好的一致性(20%以内的偏差),只在另外1个细胞系中,NGS 的检测结果显著偏低。这与Lih 等的研究结论类似,不同的NGS 方法之间的检测结果间会呈现可见的差异[32]。研究证实,dPCR 对CNV 的检测分辨力可以低至0.1个拷贝[34]。随着dPCR 技术的进步,其在CNV 检测方面的研究也越来越多,dPCR 必然随着大量临床数据的积累和检测成本的降低在临床上得到进一步推广。由于其检测流程的简便性和对检测结果的精确定值,未来可与NGS、FISH 和IHC 等方法互为补充。
然而dPCR 技术仍面临诸多不足和挑战,例如肿瘤组织或者体液类样本的高度异质性、肿瘤细胞比例偏低、所用引物的扩增效率,以及检测限或者灰区的确定都有可能造成CNV 临床检测结果的假阴性或者假阳性。因此dPCR仪器的性能、dPCR 诊断试剂盒适用的检测范围和分析结果的可靠性等问题是CNV 检测能否顺利实现的关键影响因素。因此,标准物质对于CNV 检测是必不可少的,是衡量检测结果是否准确的一把标尺。
对各种技术分析的汇总见表1。
3 肿瘤驱动基因CNV IVD 试剂的现状
应用于临床的肿瘤驱动基因CNV 检测试剂必须依据相关的法律法规由国家相关部门进行监督管理,试剂又分为取得医疗器械注册证的商品化IVD 试剂和实验室自建方法(laboratory-developed tests,LDTs)两类。IVD 试剂注册和上市后的监管属于国家药品监督管理局(National Medical Products Administration,NMPA)所属相关部门的工作职责,LDTs 属于临床实验室监管的部分[35]。
3.1 取得医疗器械注册证的商品化IVD 试剂
在检测CNV 的方法中,由于FISH、qPCR 和dPCR 等技术相对于NGS,具有检测流程简单、周期短和检测靶标较少的特点,适合开发成商品化试剂盒并以取得医疗器械注册证的形式应用于临床。若基于NGS 技术开发的试剂盒检测靶点明确且较少,亦可以通过此种方式进入临床。根据《体外诊断试剂注册管理办法》,与肿瘤驱动基因CNV检测相关的试剂均属于第三类产品,需经药品监督管理部门审批注册,方可进入临床[36]。目前已经取得医疗器械注册证的检测CNV 的IVD 试剂包括了FISH、qPCR 和dPCR等方法。
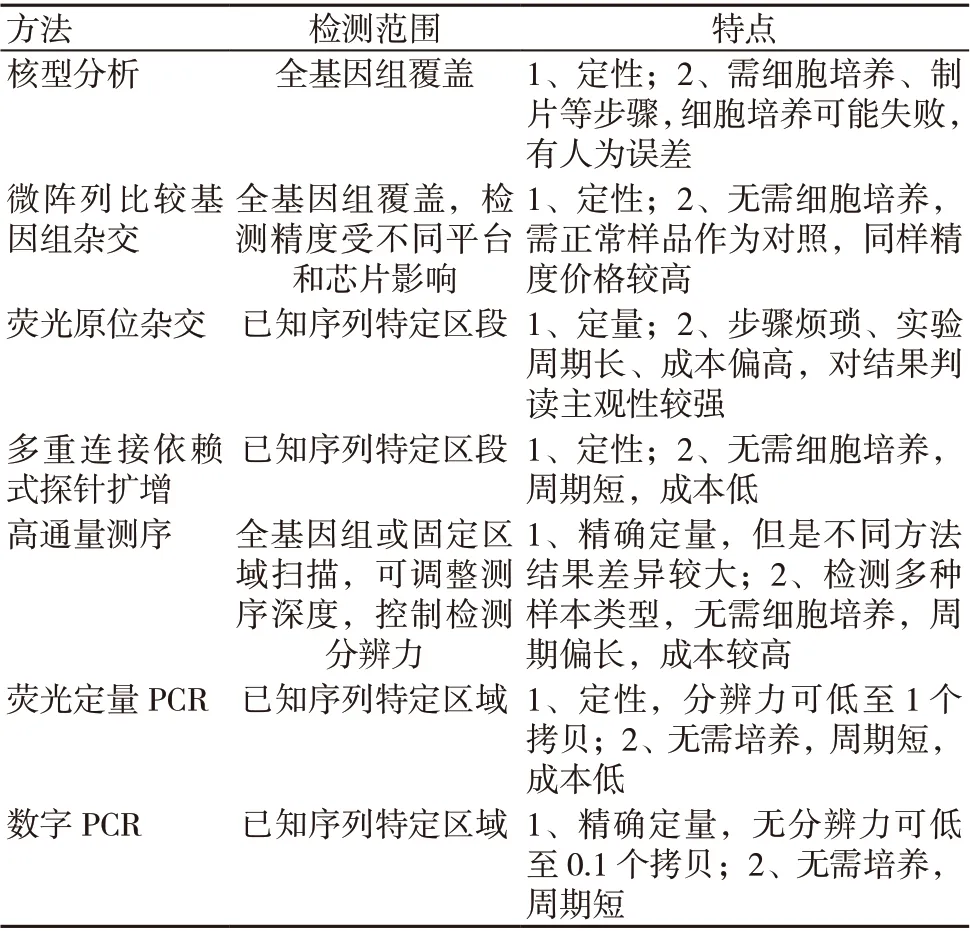
表1 肿瘤驱动基因组CNV 检测方法比较
3.2 LDTs
在国家精准医疗战略大背景下,基于NGS 的肿瘤基因测序正在被临床接受和认可。NGS 可以同时检测更多的靶标和变异类型,不但可以检测已知变异,还可以发现更多与疾病相关的未知变异。正是由于NGS 可以检测成百上千甚至数十万个位点,甚至是全基因组测序30亿个碱基的检测,很难按照IVD 注册的要求对每个检测位点的分析有效性和临床有效性进行评价。将CNV 与SNP、Fusion 和TMB 等肿瘤生物标志物放在一起进行检测,尤其是最新研究证实CNV 负荷也可以作为免疫治疗的生物标志物[37],选用数百个基因大panel 的靶向测序或者全外显子组测序是最优选择。由于方法的高度复杂性,基因变异研究、药物研发进展与日俱进,建库方法、数据库和分析软件频发地更新迭代,以LDTs 的形式进入临床是最合适的选择,并以风险管理的方式由相关部门进行监管。例如美国食品药品监督管理局(Food and Drug Administration,FDA)批准的 MSK 的可检测468个基因的 IMPACT NGS 检测试剂和Foundation Medicine 的 可 检 测324个 基 因 的 FoundationOne CDx(F1CDx)检测试剂,均为LDTs,并非是可用于销售的IVD 产品,只能在申报批准的CLIA 认证实验室内检测,这也是与美国的医疗保险制度有关[35]。随着我国《医疗器械监督管理条例》的不断完善和成熟,国家对LDTs 的监管也将更合理规范。
无论肿瘤驱动基因CNV 检测试剂是以检测较少靶点的IVD 商品化试剂,还是以将多种生物标志物糅合在数百个基因大panel 的LDTs 的形式服务于临床,从监管的角度对试剂本身的质量要求是一致的。而如何使检测结果准确度高、重复性好,需要肿瘤驱动基因CNV 核酸标准物质的应用。从CNV 检测试剂的研发、生产和使用的各个阶段,从产品质量控制和校准的角度,都需要有参照标准,即标准物质。
4 肿瘤驱动基因CNV 核酸标准物质研制进展
标准物质(reference materials,RM)是指具有足够均匀和稳定的特定特性的物质,其特性适用于测量或标称特性检查中的预期用途[38]。经过赋值的标准物质可以用于校准、测量准确度控制以及测量精密度控制。标准物质在校准测量仪器、评价测量分析方法、测量物质特性值和考核操作分析人员的操作技术水平,以及生产过程中产品的质量控制等领域具有不可或缺的作用。使用标准物质通过对仪器和试剂进行校准、对检测方法进行评价,可以有效减少实验误差,提高检测结果的准确性。标准物质是临床分子诊断标准化的核心,临床检测的某一标本中特定标志物的量值,不管用何种方法测定,均可以通过统一的标准化物质,而得到相近的结果,其量值均可溯源至同一标准,从而具有可比性[39]。
按照对IVD 试剂监管的要求,诊断试剂在注册检验阶段需要使用国家参考品或者标准物质对试剂盒的性能进行评价,实现溯源的要求[36,40]。目前国内还没有推出肿瘤驱动基因CNV 检测的有证标准物质或者国家参考品。因此,研发肿瘤驱动基因CNV 检测用的标准物质,满足IVD 领域的市场需求,规范行业标准具有重要意义。在CNV 分子诊断试剂研发、注册、上市后的监督抽验以及实际的临床检验中,采用可靠的标准物质是定性和定量测量方法的性能确认和验证、测量方法产品校准品的量值传递、实验室运行测量程序的质量控制以及能力比对和验证的基础和保障。NIST 发布了SRM 2373和RM 8336两种用于肿瘤驱动基因CNV 检测的标准物质,其中前者用于HER2 CNV 的检测,后者用于对EGFR 和MET 两个基因CNV 的检测,适用于dPCR 以及NGS 等检测方法。两套标准物质均以目的基因发生CNV 的永生化肿瘤细胞系为原材料进行培养,提取核基因组DNA 制备得到CNV 水平不同的标准物质核酸溶液。SRM 2373由标物研制实验室使用qPCR 和dPCR 方法对标准物质的特性值进行赋值和不确定度评定。RM 8366仅使用dPCR 方法在标物研制实验室完成了定值和不确定度评定,这是因为dPCR 在拷贝数绝对定量的准确度方面是显著高于qPCR 的。特性值是以拷贝数比率来表示,即靶基因的拷贝数浓度与内参基因的拷贝数浓度的比值。随后,RM 8366的特性值又在另外2家实验室的数字PCR 平台进行测定,结果显示,2家实验室的结果与NIST 的特性值都呈现非常好的相关性[31-33]。这些标准物质将有助于提高使用dPCR 和NGS 方法研究和临床检测重要肿瘤治疗靶点的CNV 的准确度和可信度。
5 小结
肿瘤驱动基因CNV 作为肿瘤细胞基因组中的一种重要变异类型,是肿瘤患者靶向治疗、疗效监测和预后评价的重要生物标志物,CNV 负荷在免疫治疗中发挥的重要价值正在被越来越多的研究证实。依据检测靶标的类型、数目以及所用的方法,灵活选择是包装成商品化试剂盒通过NMPA 的注册审批,还是以LDTs 的形式进入临床应用。技术的进步和法律法规的不断完善也推动监管机构研制出权威的、有证的、不同应用场景的肿瘤驱动基因CNV 核酸标准物质,为CNV 检测系统的量值溯源和质量管理提供支撑,实现CNV 从定性检测向精确定量检测的真正转变。

