物理伤害诱导白木香应激反应的生理特征
张鹏 徐谙为 杨光大 肖嘉杰 李小飞 徐大平 崔之益



摘 要:为了分析物理伤害诱导白木香应激反应特征,本研究以3年生普通白木香与易结香白木香品系为对象,采用机械打孔处理,分析其受伤害前后的激素含量、抗氧化性酶活性、酚类与萜类防御物质以及萜类前体物质乙酰辅酶A含量的变化特征,比较两类白木香受物理伤害后的应激反应特征。结果表明:机械损伤后,普通白木香与易结香白木香茉莉酸、水杨酸、乙烯含量都显著增加。除抗坏血酸氧化酶外,其他5种抗氧化性酶活性显著增强。防御物质总酚、总萜含量在普通白木香中分别增加了15.31%和9.04%,在易结香白木香中分别增加了24.63%和15.08%。乙酰辅酶A在两类白木香中也显著增加。其中,易结香白木香中茉莉酸、乙烯前体含量变化显著高于普通白木香。且易结香白木香的超氧化物歧化酶、过氧化氢酶、过氧化物酶活性变化分别是普通白木香的1.63、1.60、1.55倍。易结香白木香的总酚和总萜增量显著大于普通白木香。易结香白木香中乙酰辅酶A的增量是普通白木香的1.74倍。综上所述,白木香在受到机械损伤后应激反应物质都得到了增加,并且多数指标在易结香白木香品系中显著高于普通白木香,表明在物理伤害诱导下易结香白木香应激反应强于普通白木香。茉莉酸、乙烯、超氧化物歧化酶、过氧化氢酶、过氧化物酶、总酚、总萜以及乙酰辅酶A等应激反应的特征物质在两类白木香中表现出显著差异,可作为快速判断易结香白木香品系的有效生理指标。
关键词:白木香;机械损伤;防御类激素;抗氧化性酶;次生代谢产物;乙酰辅酶A
中图分类号:S718.43 文獻标识码:A
Abstract: Mechanical drilling treatment was implemented for three-year-old common Aquilaria sinensis and easily induced agarwood A. Sinensis to analyze the characteristics of stress response of A. sinensis induced by physical injury. The changes of hormone content, antioxidant enzyme activity, phenolic and terpenoid defense substances, and terpenoid precursor acetyl-CoA content were analyzed before and after mechanical injury. The stress response characteristics of two kinds of A. sinensis after physical injury were compared. The contents of jasmonic acid, salicylic acid and ethylene of common Aquilaria sinensis and easily induced agarwood A. sinensis increased significantly after mechanical damage. Except for ascorbate oxidase, the activities of the other five antioxidant enzymes enhanced significantly. The contents of total phenols and total terpenes were increased by 15.31% and 9.04% in common A. sinensis, and 24.63% and 15.08% in easily induced agarwood A. sinensis respectively. Acetyl-CoA also increased significantly in both kinds of A. sinensis. Among them, the increments of jasmonic acid and ethylene precursor contents were significantly higher in easily induced agarwood A. sinensis than those in common A. sinensis. The activity changes of superoxide dismutase, catalase and peroxidase of easily induced agarwood A. sinensis were 1.63, 1.60 and 1.55 times of common A. sinensis respectively. The increments of total phenols and terpenes of easily induced agarwood A. sinensis were significantly higher than that of common A. sinensis. The increment of acetyl-CoA in easily induced agarwood A. sinensis was 1.74 times higher than that in common A. sinensis. In conclusion, stress response substances of A. sinensis increased after mechanical injury, and most indexs of them were significantly higher in easily induced agarwood A. sinensis than those in common A. sinensis. It was suggested that the stress response of easily induced agarwood Aquilaria sinensis was stronger than common Aquilaria sinensis. Jasmonic acid, ethylene, superoxide dismutase, catalase, peroxidase, total phenols, total terpenes and acetyl-CoA were significantly different between the two kinds of Aquilaria sinensis, which could be used as effective physiological indexes for rapid identification of easily induced agarwood Aquilaria sinensis.
Keywords: Aquilaria sinensis; mechanical injury; defense hormones; antioxidant enzymes; secondary metabolites; acetyl-CoA
DOI: 10.3969/j.issn.1000-2561.2021.12.019
沉香是瑞香科(Thymelaeaceae)沉香属(Aquilaria Lam.)植物在生长过程中受到刺激或伤害后,抗逆境胁迫产生次生代谢产物与木质部组织混合形成的含有油脂成分的木材[1]。沉香是名贵的传统中药材[2],也是一种天然的高级香料[3-4],同时在世界五大宗教中备受推崇[5]。白木香[Aquilaria sinensis (Lour.) Spreng.]又称土沉香、香树、女儿香、牙香树,为我国特有珍贵药用植物、国家二级重点保护野生植物[1]。白木香受到外界胁迫后能产生沉香,是我国生产沉香的重要植物资源。由于沉香在药用、香料、宗教、收藏等方面的广泛用途,使其在国内外的需求供不应求[6-7]。培育沉香树人工林与人工诱导结香是目前解决沉香紧缺的有效方法。
植物通过进化出复杂的防御机制来精确地感知和响应生物胁迫和非生物胁迫[8]。物理、化学或生物因素被認为都是沉香形成的诱因,它们作为激发子诱导沉香树体防御反应的发生[9]。外部刺激因子通过植物激素等信号分子激活早期防御反应信号途径,诱导应激反应,使得抗氧化性酶活性增强,产生酚类与萜类等次生代谢防御物质,触发沉香物质合成途径,使沉香树种的防御反应形成,从而抵御外界伤害[10]。国内外人工诱导结香的研究方法可以概括为物理、化学、生物三类诱导法。其中,物理伤害(砍伤法、断干法、半断干法、打钉法、钻孔法、火烙法、剥皮法等)是诱导沉香形成的主要传统方法,且物理伤害诱导白木香的应激反应对其无性繁殖过程产生重要影响,然而目前对沉香的研究主要集中在沉香组成成分分析[11-12]、沉香形成机理假说验证[9, 13-14]、人工诱导结香方法[15-16]、沉香物质合成代谢途径以及信号调控机制等方面[17-18]。张兴丽[19]研究了沉香形成过程的信号分子与酶的变化,王东光等[20]对于多种结香处理过程的抗氧化性酶以及总酚的差异进行研究,然而关于物理伤害诱导白木香应激反应的生理特征研究尚未见系统报道。近年来,人们从普通白木香中选择出更易结香的白木香优树,并通过嫁接等无性繁殖方式保持其优良结香性状,从而获得优良的易结香品系,是白木香良种化的重要基础。易结香品系是指具有结香早、结香快、产香量大、产香质量高等优良特性的白木香优良品系。王军等[1]申请了白木香新品种,并证实其所产沉香的质量更优,是一种易产香、产量高、质量优的种质。如何快速选育更易结香,结香品质更高的沉香品系已成为提高沉香生产的关键,同时也是下一代林木育种的必然要求。
本研究以普通白木香与白木香易结香品系作为研究材料,分析其机械损伤后的激素含量、抗氧化性酶活性、酚类与萜类防御物质含量以及萜类合成前体物质乙酰辅酶A含量的变化特征,研究物理伤害诱导白木香的应激反应特征,旨在为机械损伤诱导沉香形成的机理研究与无性繁殖生产应用提供理论依据。同时,以期筛选出可早期鉴定易结香品系的生理指标,为挖掘白木香优良种质资源提供参考。
1 材料与方法
1.1 材料
实验于2020年11月在广东省茂名市电白区森海沉香种植专业合作社进行,地理坐标21°46′15′′ N,111°13′6′′ E。选取相同立地条件,无病虫害,生长健壮,长势一致的3年生普通白木香与白木香易结香品系‘糖结’各6棵。PB、YB分别表示普通白木香、易结香白木香;PCK、PW分别表示普通白木香处理前、处理后;YCK、YW分别表示易结香白木香处理前、处理后;PBV、YBV分别表示普通白木香处理前后变化、易结香白木香处理前后变化。两类白木香的形态差异如图1所示,可知‘糖结’叶缘波状,且多数不对称。白木香取样情况见表1,每类白木香各6个生物学重复。普通白木香与白木香易结香品系的平均树高分别为(4.67±0.43)m和(4.98±0.34)m;平均地径分别为(6.18±0.64)cm和(6.45±0.45)cm。
在每棵普通白木香与易结香白木香的侧枝健康完整部位,用直径0.5 cm电钻钻头各钻20个圆孔,钻穿枝条,相连2个钻孔距离5 cm。前人文献表明,在机械损伤后24 h,植株信号分子与损伤前有显著差异[19],因此,本研究在伤害处理后0、24 h将伤口附近1 cm处3 cm长的枝条取下,取样后用锡箔纸包好,迅速放入液氮中直至冷冻彻底,运送回实验室后,将液氮速冻样品放置于–80 ℃的超低温冰箱中保存备用。
1.2 方法
每株样品取鲜重茎干1 g作为单独重复。加入5 mL 80%甲醇和1 mmol/L 2, 6-二叔丁基-4-甲基苯酚冷却缓冲液研磨萃取,匀浆于4 ℃放置4 h,4000 r/min离心5 min。将上清液转移至另一试管中,再与提取缓冲液混合,4000 r/min离心5 min,上清液用ELISA试剂盒(上海酶联生物科技有限公司)测定内源激素茉莉酸(JA)、水杨酸(SA)、乙烯前体1-氨基环丙烷-1-羧酸含量(ACC),抗氧化性酶过氧化氢酶(CAT)、过氧化物酶(POD)、超氧歧化酶(SOD)、多酚氧化酶(PPO)、抗坏血酸氧化酶(APX)和谷胱甘肽还原酶(GR)活性;次生代谢防御物质总酚类(phenol)、总萜类(terpene)含量;萜类前体物质乙酰辅酶A(acetyl-CoA)含量,且均以鲜重计。
1.3 数据处理
运用Microsoft Excel 2017软件进行数据统计分析和绘图,采用SPSS 23.0软件对处理前后普通白木香与易结香白木香之间进行单因素方差分析。
2 结果与分析
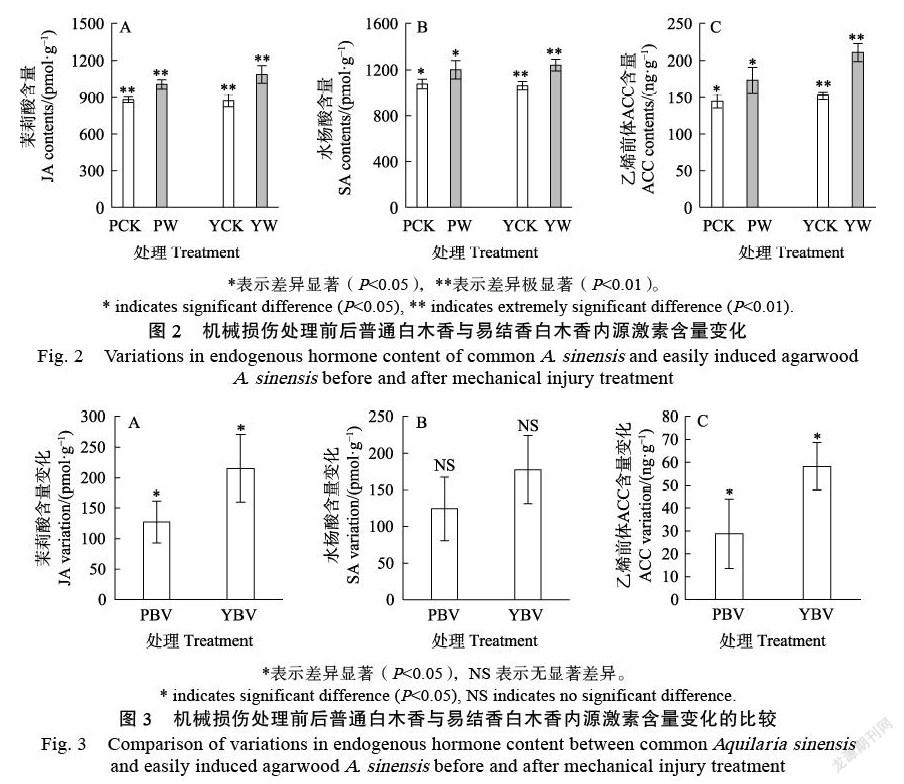
2.1 激素变化特征
机械损伤后调控防御反应的3种激素含量变化分析结果如图2所示。在受到伤害胁迫后,普通白木香与易结香白木香3种激素含量均显著增加。其中茉莉酸含量在普通白木香中增加了14.42%,易结香白木香中增加了24.62%,在2种白木香中均达到极显著差异。水杨酸含量在普通白木香中增加了11.52%,在易结香白木香中增加了16.69%。乙烯前体物质ACC含量在普通白木香中增加了19.87%,在易结香白木香中增加了38.23%。
比较普通白木香与易结香白木香二者之间在机械损伤后3种激素含量的前后变化发现(图3),易结香白木香中茉莉酸、乙烯前体含量变化显著高于普通白木香,分别达到普通白木香的1.69、2.03倍,而水杨酸的含量变化在二者之间没有显著差异。
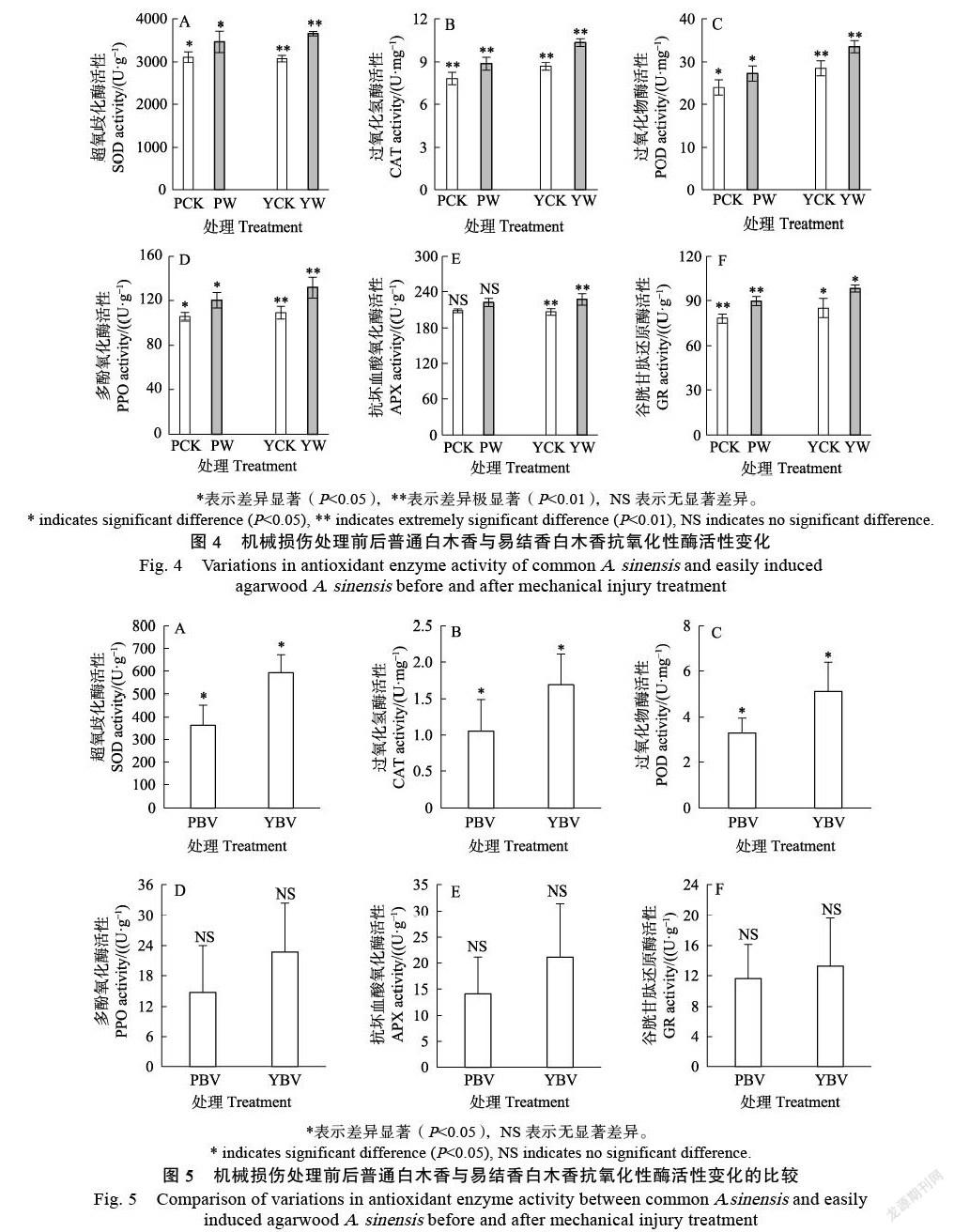
2.2 抗氧化酶活性变化特征
在机械损伤前后防御反应的6种抗氧化酶活性变化分析结果如图4所示。除抗坏血酸氧化酶活性在普通白木香中损伤前后差异不显著外,其他5种抗氧化性酶活性在普通白木香与易结香白木香中均显著增加。其中机械损伤后,超氧化物歧化酶活性在普通白木香与易结香白木香中分别增加了11.63%、19.21%。过氧化氢酶活性分别增加了13.42%、19.36%。过氧化物酶活性分别增加了13.68%、17.86%。多酚氧化酶活性分别增加了14.03%、20.84%。抗坏血酸氧化酶活性分别增加了6.82%、10.25%。谷胱甘肽还原酶活性分别增加了14.85%、15.59%。
由图5可知,普通白木香与易结香白木香之间在机械损伤后6种抗氧化性酶活性的增量差异不同。超氧化物歧化酶、过氧化氢酶、过氧化物酶活性增量在普通白木香与易结香白木香之间变化差异显著,其中,易结香白木香的超氧化物歧化酶、过氧化氢酶、过氧化物酶活性增量分别是普通白木香的1.63、1.60、1.55倍。而多酚氧化酶、抗坏血酸氧化酶、谷胱甘肽还原酶在普通白木香与易结香白木香之间的增量无显著差异。
2.3 次生代谢防御物质变化特征
机械损伤后起防御作用的次生代谢产物总酚和总萜含量变化分析结果由图6所示。在受到伤害胁迫后,普通白木香與易结香白木香总酚和总萜含量均极显著增加。其中总酚含量在普通白木香与易结香白木香中分别增加了66.66和106.00 ng/g。总萜含量在普通白木香与易结香白木香中分别增加了69.92和106.72 ng/g。
由普通白木香与易结香白木香总酚和总萜含量变化比较(图7)可知,防御物质总酚和总萜在机械损伤处理后,易结香白木香的增量较普通白木香更多,2种白木香之间差异显著。其中,总酚的含量易结香白木香较普通白木香多增加了59.03%,总萜含量增加了52.64%。
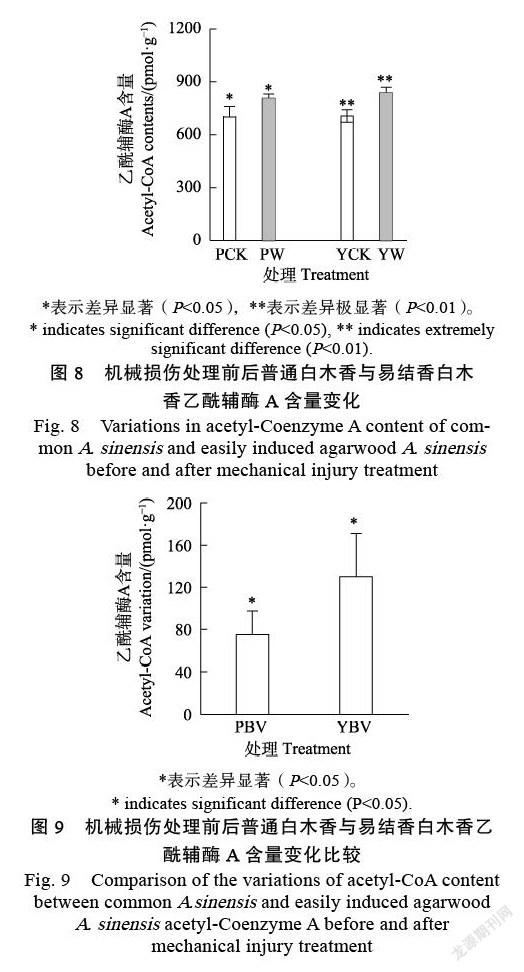
2.4 沉香萜类前体物质含量变化特征
由图8可知,沉香萜类前体物质于机械损伤后在普通白木香与易结香白木香中都有所增加。其中在普通白木香中增加了74.79 pmol/g,处理前后之间差异显著。在易结香白木香中增加了129.95 pmol/g,处理前后之间达到了极显著差异。
由普通白木香与易结香白木香沉香萜类前体物质含量变化比较(图9)可知,在机械损伤处理后,易结香白木香的增量较普通白木香更多,2种白木香之间差异显著。其中,易结香白木香中乙酰辅酶A的增量是普通白木香的1.74倍。
3 讨论
植物受到伤害时,植物细胞可以激活依赖于特殊基因转录诱导的防御反应[21]。早期防御反应信号途径的激活,是信号转导途径的末端产物激素等作为信号分子,激活植物体内防御基因的表达,从而使植物表现出对生物胁迫的抗性反应,包括抗氧化酶活性与代谢反应的改变[22]。
植物的防御反应依赖于各种信号通路的复杂相互作用,这些通路在错综复杂的网络中相互联系。防御反应中的植物激素(如茉莉酸、水杨酸、乙烯)被认为是防御反应的重要信号[23]。在本研究中,受到伤害胁迫后,普通白木香与易结香白木香3种激素含量均显著增加。此结果与龙血树[Dracaena cochinchinensis (Lour.) S. C. Chen]在受到机械损伤后的几类激素的含量变化相似[24]。笔者前期也研究发现,乙烯等激素是介导降香黄檀(Dalbergia odorifera T. C. Chen)响应机械损伤的重要信号物质[25-26],说明无论是普通白木香还是易结香的白木香品系在受到外界逆境刺激后,起信号传递的激素分子都开始行使诱导防御作用的功能。且在本研究中发现,易结香白木香中茉莉酸、乙烯前体含量变化显著高于普通白木香,而水杨酸的含量变化在二者之间无显著差异。表明易结香白木香品系诱导防御的速度强于普通白木香,其应激反应的程度也强于普通白木香。
在正常的生理条件下,植物的抗氧化防御系统可以平衡植物的生长[27]。植物在逆境条件下能够产生活性氧[28]。植物酶抗氧化系统是抗氧化防御系统的组成部分。抗氧化酶系以及各非酶促组分之间在活性氧的清除中存在共同调节作用,植物体在受到逆境胁迫时,这些抗氧化酶的活性会发生相应的变化,共同参与调控活性氧自由基代谢、细胞膜脂过氧化程度,保护植物免受环境胁迫的危害[29]。研究表明,机械损伤可以诱导白木香产生大量过氧化氢等活性氧自由基[30],在本研究中,机械损伤使得6种抗氧化性酶活性中有5种酶活性在普通白木香与易结香白木香中均显著增强。同时易结香白木香超氧化物歧化酶、过氧化氢酶、过氧化物酶活性变化显著高于普通白木香。研究表明,机械伤害后的杨树[Populus si-monii var. przewalskii (Maxim.) H. L. Yang]与菜豆(Phaseolus vulgaris Linn.)叶片中抗氧化酶活性明显增强,从而引起系统防御反应[31-32]。
植物次生代谢过程是植物对环境的一种适应,是植物在长期进化中对生态环境适应的结果,以往的研究表明,植物在受到动物啃食、病原菌侵染和其他物理伤害时能激活自身防御反應,激活植物次生代谢反应,从而合成积累一些特异性防御次生代谢产物,以增强自身的免疫力和抵抗力[33]。在受到伤害胁迫后,普通白木香与易结香白木香次生代谢产物总酚和总萜含量均极显著增加,且2种白木香之间有显著差异。张争等[34]在白木香的研究中表明,萜类含量增多是植物启动相应的防御反应和抵御伤害胁迫的重要机制。
乙酰辅酶A是生物体能源物质代谢过程中产生的一种重要的中间代谢产物,是萜类合成途径的前体物质[35]。沉香萜类前体物质乙酰辅酶A于机械损伤后在普通白木香与易结香白木香中都显著增加,且易结香白木香的增量较普通白木香更多。表明在损伤的白木香中,能量代谢增强,其防御物质萜类的前体物质也增多,为白木香的防御反应启动提供了有效的物质储备。同时,易结香中的乙酰辅酶A含量增加量更大,可能意味着其防御反应会强于普通白木香。
综上,白木香在受到机械损伤后其防御类激素,抗氧化性酶活性,防御物质总酚和总萜含量以及萜类物质的前体物质乙酰辅酶A含量都显著增加。该结果为机械损伤诱导沉香形成的机理研究与无性繁殖生产应用的深入研究奠定基础。并且多数应激反应物质变化在易结香白木香品系中都显著高于普通白木香,表明在物理伤害诱导下易结香白木香应激反应强于普通白木香,且茉莉酸、乙烯、超氧化物歧化酶、过氧化氢酶、过氧化物酶、总酚、总萜以及乙酰辅酶A等应激反应的特征物质可作为快速判断易结香白木香品系的生理指标。这些研究结果具有重要的科学价值和应用前景。后期研究可以增加易结香白木香品系种类及其样本数量,进一步筛选可以早期鉴定白木香易结香品系的特征指标。
参考文献
[1] 王 军, 王宇光, 杨锦玲, 等. 2种白木香所产沉香的木材组织构造和化学成分比较[J]. 林业科学, 2019, 55(7): 146-154.
[2] 梁 食, 梅全喜, 吴惠妃, 等. 沉香资源质量的研究现状与等级划分的方法[J]. 时珍国医国药, 2013, 24(7): 1735-1737.
[3] 高志晖, 赵文婷, 孙佩文, 等. 世界各国(地区)沉香资源与保护[J]. 中国现代中药, 2017, 19(8): 1057-1063.
[4] Naziz P S, Das R, Sen S. The scent of stress: Evidence from the unique fragrance of agarwood[J]. Frontiers in Plant Science, 2019(10): 840.
[5] Akter S, Islam M T, Zulkefeli M, et al. Agarwood produc-tion-a multidisciplinary field to be explored in Bangla-desh[J]. International Journal of Pharmaceutical and Life Sciences, 2013, 1(2): 22-32.
[6] Jung D. The cultural biography of agarwood-perfumery in Eastern Asia and the Asian neighbourhood[J]. Journal of the Royal Asiatic Society, 2013, 23(1): 103-125.
[7] Turjaman M, Hidayat A, Santoso E. Development of agar-wood induction technology using endophytic fungi[M]. Berlin: Springer Singapore, 2016: 57-71.
[8] 代宇佳, 罗晓峰, 周文冠, 等. 生物和非生物逆境胁迫下的植物系统信号[J]. 植物学报, 2019, 54(2): 255-264.
[9] 张 争, 杨 云, 魏建和, 等. 白木香结香机制研究进展及其防御反应诱导结香假说[J]. 中草药, 2010, 41(1): 156-159.
[10] Tan C S, Isa N M, Zainal Z. Agarwood induction: Current developments and future perspectives[J]. Frontiers in Plant Science, 2019(10): 122.
[11] Li W, Chen H Q, Wang H, et al. Natural products in agar-wood and Aquilaria plants: chemistry, biological activities and biosynthesis[J]. Natural Product Reports, 2020, 38(3). DOI:10.1039/d0np00042f.
[12] 廖 格, 赵美丽, 宋希强, 等. 整树结香法所产沉香的GC-MS分析[J]. 热带作物学报, 2016, 37(2): 411-417.
[13] 王东光, 张宁南, 杨曾奖, 等. 20种真菌对白木香挥发油成分的影响[J]. 华南农业大学学报, 2016, 37(5): 77-83.
[14] Zhang Z, Wei J, Han X, et al. The sesquiterpene bio-synthesis and vessel-occlusion formation in stems of Aquilaria sinensis (Lour.) Gilg trees induced by wounding treatments without variation of microbial communities[J]. International Journal of Molecular Sciences, 2014, 15(12): 23589-23603.
[15] 邓加艾, 戴好富, 王宇光, 等. 沉香样品中曲霉属真菌菌株HNWSW-20的分离鉴定及其次生代谢产物的研究[J]. 热带作物学报, 2018, 39(8): 1618-1624.
[16] Liu Y, Chen H, Yang Y, et al. Whole-tree agarwood- induc-ing technique: an efficient novel technique for producing high-quality agarwood in cultivated Aquilaria sinensis trees[J]. Molecules, 2013, 18(3): 3086-3106.
[17] Xu Y H, Liao Y C, Zhang Z, et al. Jasmonic acid is a crucial signal transducer in heat shock induced sesquiterpene formation in Aquilaria sinensis[J]. Scientific Reports, 2016(6): 21843.
[18] Liu J, Xu Y, Zhang Z, et al. Hydrogen peroxide promotes programmed cell death and salicylic acid accumulation dur-ing the induced production of sesquiterpenes in cultured cell suspensions of Aquilaria sinensis[J]. Functional Plant Biology, 2015, 42(4): 337-346.
[19] 張兴丽. 伤害诱导的白木香防御反应与沉香形成的关系研究[D]. 北京: 北京林业大学, 2013.
[20] 王东光, 张宁南, 杨曾奖, 等. 人工诱导白木香树体抗逆能力的研究[J]. 华南农业大学学报, 2016, 37(6): 70-76.
[21] Savatin D V, Gramegna G, Modesti V, et al. Wounding in the plant tissue: the defense of a dangerous passage[J]. Frontiers in Plant Science, 2014(5): 470.
[22] 彭金英, 黄勇平. 植物防御反应的两种信号转导途径及其相互作用[J]. 植物生理与分子生物学学报, 2005, 58(4): 347-353.
[23] Buscaill P, Rivas S. Transcriptional control of plant defence responses[J]. Current Opinion in Plant Biology, 2014, 20: 35-46.
[24] 薛 宇, 宋美芳, 张 越, 等. 基于伤害诱导的龙血竭形成过程中信号分子变化规律研究[J]. 中国现代中药, 2019, 21(5): 642-648, 672.
[25] Cui Z, Yang Z, Xu D. Synergistic roles of biphasic ethylene and hydrogen peroxide in wound-induced vessel occlusions and essential oil accumulation in Dalbergia odorifera[J]. Frontiers in Plant Science, 2019, 10: 250.
[26] Cui Z, Li X, Xu D, et al. Physiological changes during heartwood formation induced by plant growth regulators in Dalbergia odorifera (Leguminosae)[J]. IAWA Journal, 2021, 29(1): 1-18.
[27] Ragab G, Saad-allah K. Seed priming with greenly synthe-sized sulfur nanoparticles enhances antioxidative defense machinery and restricts oxidative injury under manganese stress in Helianthus annuus (L.) seedlings[J]. Journal of Plant Growth Regulation, 2020: 1-9.
[28] García-sánchez M, Palma J M, Ocampo J A, et al. Arbuscu-lar mycorrhizal fungi alleviate oxidative stress induced by ADOR and enhance antioxidant responses of tomato plants[J]. Journal of Plant Physiology, 2014, 171(6): 421- 428.
[29] 高 媛, 薛艳红, 刘士平. 植物抗氧化动态平衡研究进展[J]. 生物资源, 2019, 41(1): 14-21.
[30] Zhang Z, Zhang X, Yang Y, et al. Hydrogen peroxide in-duces vessel occlusions and stimulates sesquiterpenes accumulation in stems of Aquilaria sinensis[J]. Plant Growth Regulation, 2014, 72(1): 81-87.
[31] An Y, Shen Y, Zhang Z. Effects of mechanical damage and herbivore wounding on H2O2 metabolism and antioxidant enzyme activities in hybrid poplar leaves[J]. Journal of Forestry Research, 2009, 20(2): 156-160.
[32] 岳文波, 郅军锐, 刘 利, 等. 害虫取食和机械损伤对菜豆不同部位叶片防御酶活性的影响[J]. 昆虫学报, 2018, 61(7): 860-870.
[33] Ahuja I, Kissen R, Bones A M. Phytoalexins in defense against pathogens[J]. Trends in Plant Science, 2012, 17(2): 73-90.
[34] 张 争, 杨 云, 魏建和, 等. 白木香茎中内源茉莉酸类和倍半萜类物质对机械伤害的响应[J]. 园艺学报, 2013, 40(1): 163-168.
[35] Ke J, Behal R H, Nikolau B J, et al. The role of pyruvate dehydrogenase and acetyl-coenzyme a synthetase in fatty acid synthesis in developing Arabidopsis seeds[J]. Plant Physiology, 2000, 123(2): 497-508.
责任编辑:白 净

