提高雨生红球藻细胞密度发酵工艺的优化研究
赫春青,陈开阳,师三媛,肖冬光,范志华,刘智永,陈方见
(1.天津科技大学生物工程学院,天津 300457;2.天津农学院食品科学与生物工程学院,天津 300380;3.中国科学院天津工业生物技术研究所天津市工业生物系统与过程工程重点实验室,天津 300308)
雨生红球藻(Haematococcus plivialis)是自然界中天然虾青素含量最高的物种,含量可达细胞干重的7%[1]。虾青素是一种类胡萝卜素,具有极强的抗氧化能力,其抗氧化能力约为其它类胡萝卜素的10倍[2],远远强于其它普通抗氧化物质,因而被广泛应用于饲料、保健品、化妆品等多个领域[3]。但与其它微生物相比,雨生红球藻光自养培养存在生长较慢、环境适应能力较差的缺点[4]。在雨生红球藻生活史中存在多种细胞形态,国际上存在多种分类,刘建国等[5]则将雨生红球藻归纳为游动与不游动状态,研究发现在游动期间细胞活力强、繁殖快,受到外界胁迫会由游动形态转变为不游动形态,期间多伴随虾青素的积累[3]。目前雨生红球藻诱导生产虾青素的方法主要包括营养胁迫和光胁迫两种[6-8],方法已经比较成熟,但雨生红球藻光自养生长缓慢难以达到很高的培养密度,导致其在大规模生产虾青素过程中成本较高。
雨生红球藻培养过程中会吸收培养基中的营养盐使得pH值增长过快,当pH值达到一定高度时会抑制藻细胞的生长[9],因此控制培养基中的pH值对于提高细胞密度具有重要作用。雨生红球藻和植物的生长类似,它的生长受激素的调节,在培养基中添加一定量的植物激素[10]可促进藻细胞的增殖。雨生红球藻既可以自养生长也可以异养生长,有关报道指出,雨生红球藻可以利用乙酸钠作为碳源进行培养,但乙酸钠添加量因藻种而异[11-12]。本试验旨在利用发酵培养代替光自养培养雨生红球藻,通过改变培养基成分以及环境条件提高该藻的培养密度,进而降低雨生红球藻培养的成本。
1 材料与方法
1.1 材料与试剂
雨生红球藻(H.plivialis)NIES-144藻株:日本国立环境研究所。硝酸钙、硝酸钾、硫酸镁、氯化铁、生物素(均为分析纯):天津市江天化工技术股份有限公司。
1.2 仪器与设备
DL-CJ-1NDII超净工作台:北京东联哈尔仪器制造有限公司;LI-250A光照强度测量仪:广州市宏诚集业电子科技有限公司;GI54DWS高压蒸汽灭菌锅:北京艾德莱生物科技有限公司;420P-01A pH计:梅特勒-托利多国际有限公司;ZWYR-2112B恒温摇床:上海智城分析仪器制造有限公司;101-0A鼓风干燥箱:奥豪斯仪器(上海)有限公司。
1.3 试验方法
1.3.1 培养基的配制
微量元素储备液:FeCl3·6H2O 0.196 g/L、MnCl2·4H2O 0.036 g/L、ZnSO4·7H2O 0.022 g/L、CoCl2·6H2O 4 mg/L、Na2MoO4·2H2O 2.5 mg/L、Na2EDTA·2H2O 1 g/L、初始pH值为7.5,121℃灭菌20 min。
C 培养基:Ca(NO3)2·4H2O 0.15 g/L、KNO30.1 g/L、β-甘油磷酸二钠 0.05 g/L、MgSO4·7H2O 0.04 g/L、微量元素储备液 3 mL、维生素 B110 μg/L、生物素 0.1 μg/L、维生素B120.1 μg/L、三羟甲基氨基甲烷 [tris(hydroxymethyl)aminomethane,Tris]0.5 g/L。
1.3.2 微藻的培养
使用三角瓶在恒温摇床中间歇振荡培养,摇床120 r/min振荡1 min,转速降为30 r/min振荡20 min,两种转速间歇运行。光照强度为10 μmol/(m2·s),温度为25℃。定期取样,分别检测细胞密度、生物量、pH值等数据。
1.3.3 初始乙酸钠浓度的影响
将乙酸钠按照 0、5、10、15、20、25 mmol/L 的浓度分别加到培养基中进行培养。培养6 d后分别取样检测细胞密度。
1.3.4 初始pH值优化
将培养基的初始pH值调节为7.0、7.5、8.0、8.5进行培养。每天分别取样检测细胞密度和pH值。
1.3.5 接种量的影响
将雨生红球藻分别按照15%、20%、25%、30%的接种量进行培养。每天分别取样检测生物量干重。
1.3.6 发酵条件的正交试验
选择培养时间、乙酸钠浓度、初始pH值和接种量4个因素,各取3个水平,以L9(34)正交表进行正交试验,以得到最优的条件组合,设计见表1。

表1 发酵条件的L9(34)正交试验设计Table 1L9(34)Orthogonal designation of fermentation conditions
1.3.7 不同植物激素的应用及组合使用的影响
将植物 3-吲哚丁酸(3-indolebutyric acid,3-IBA)、2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)、萘乙酸(1-naphthylacetic acid,NAA)、6-苄氨基嘌呤(6-benzyl aminopurine,6-BA)以L9(34)正交法进行试验,得出最优的激素配比,设计见表2。
1.4 计算分析
1.4.1 细胞密度的测定
取1 mL藻液10 000 r/min离心1 min,浓缩至合适浓度,使用血球计数板计数。
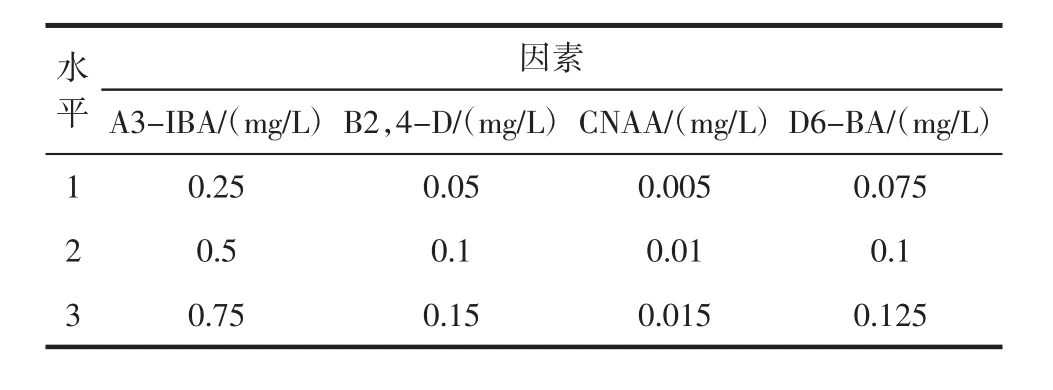
表2 激素组合的L9(34)正交试验设计Table 2L9(34)Orthogonal designation of hormone combination
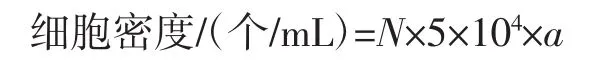
式中:N为5个中方格的细胞总数,个;a为稀释倍数。
1.4.2 生物量干重的测定
采用0.22 μm纤维滤膜,105℃烘干称重,记录初始质量m1。吸取V体积藻液抽滤,105℃烘干再次称重,记录质量m2。

式中:m1为烘干后滤膜质量,g;m2为经抽滤并烘干后滤膜质量,g;V为抽滤体积,L。
1.4.3 数据分析
采用origin进行图的绘制。使用正交试验设计助手专业版软件进行极差及方差分析。
2 结果与分析
2.1 单因素试验的影响
2.1.1 雨生红球藻的生长曲线
雨生红球藻生长曲线试验结果如图1所示。

图1 雨生红球藻的生长曲线Fig.1 Growth curve of H.plivialis
由图1可知,接种后随培养时间的增加细胞密度逐渐增大。0 ~1 d细胞密度增长缓慢,1 d ~2 d生长较快,2 d ~4 d生长速率最大。第6天生长速度趋于平缓,第8天细胞密度达到最大值,经血球计数板的测定细胞密度达到4.17×104个/mL。超过第8天,细胞密度开始逐渐减小。
2.1.2 乙酸钠浓度对细胞密度的影响
培养基中不同浓度乙酸钠对细胞密度的影响如图2所示。

图2 乙酸钠浓度对雨生红球藻细胞密度的影响Fig.2 Effect of sodium acetate on cell density of H.plivialis
由图2可知,添加乙酸钠对雨生红球藻的生长具有促进作用。在0 ~15 mmol/L范围内,乙酸钠的浓度为5 mmol/L时细胞密度相对较大,达到1.675×105个/mL,比不添加乙酸钠的细胞密度提高了一倍。在显微镜下观察,乙酸钠的浓度达到20 mmol/L以后虽然雨生红球藻生物量干重更高,但此条件下细胞开始出现变黄甚至变红。
雨生红球藻在快速增殖过程中需要消耗大量的碳源,但在自养培养过程中泵入无菌空气含有的CO2不能满足其快速生长的需要,所以培养过程需要不断补充无机碳源或添加有机碳源乙酸钠[13]。大量研究表明在适宜异养或兼养条件下,雨生红球藻繁殖速度和稳定期细胞密度相较于光自养都有所提高,但不同藻种的最适乙酸钠浓度有所不同[14-16]。本研究表明,乙酸钠浓度在0 ~15 mmol/L范围内,藻细胞一直保持绿色游动状态,在5 mmol/L浓度下出现峰值;在添加较高浓度乙酸钠(大于20 mmol/L)下,雨生红球藻的细胞密度有较大提高,但是游动细胞的数量大幅降低,细胞颜色逐渐变红,开始合成类胡萝卜素物质,不利于细胞密度的进一步提升。所以在发酵初始阶段添加浓度低于15 mmol/L的乙酸钠可以快速提高细胞密度。
2.1.3 藻液初始pH值的影响
初始pH值对细胞密度变化的影响如图3所示。可知,初始pH值在7.5时藻液细胞稳定期浓度最大,接种后前2 d雨生红球藻增长情况不明显,2 d之后不同培养基初始pH值下雨生红球藻的生长速度差别较大,从高到低 pH 值依次为 7.5、8.0、8.5、7.0。

图3 初始pH值对雨生红球藻生长的影响Fig.3 Effect of initial pH on growth of H.plivialis

图4 不同初始pH值培养基中pH值的变化情况Fig.4 pH curve of the culture with different initial pH
在培养基的初始pH值不同的情况下,对其pH值的变化进行测定,结果如图4所示。图4可观察到培养基初始pH值为7.0 ~8.5,接种后pH值均快速上升,第2天藻液的pH值稳定在9左右,并逐渐趋近于9.3。研究发现,pH值低于9时雨生红球藻生长速率慢,pH值在9附近时生长速率加快,pH值高于9生长速率开始快速下降甚至停止。
有研究发现雨生红球藻的生长pH值范围较为宽广,但在高pH值下生长缓慢[17]。由图4试验结果可知,藻液的最终pH值稳定在9.3,说明该藻株可生长pH值上限可能为9.3,pH值高于9.3不利于细胞生长。从细胞密度变化可以看出,接种量一定时,培养基的初始pH值对藻种的生长有一定的影响。初始pH值过低,在接种的过程中会使一部分藻种死亡,初始pH值过高,在接种时有利于藻种的生长,但随着培养pH值快速增加,不利于藻种的繁殖。
2.1.4 接种量对藻株生长趋势的影响
在微生物发酵过程中,接种量是一个重要的研究条件。雨生红球藻的发酵也是如此,适宜的接种量不仅关系到藻细胞对培养基中营养物质的吸收,更关系到细胞的生长速度与稳定期细胞密度[14]。接种量对生物量的影响如图5所示。

图5 接种量对雨生红球藻生长的影响Fig.5 Effect of inoculation quantity on growth of H.plivialis
从图5比较不同接种量的雨生红球藻增长趋势可知,接种量大时,雨生红球藻进入生长期时间缩短,同时进入稳定期的时间也缩短,稳定期生物量干重也略有提高,接种量不小于20%雨生红球藻稳定期生物量干重相差不大,但接种量低于20%生物量干重较低,仅达到0.11 g/L。在接种量较低时,雨生红球藻进入生长期和稳定期时间都会出现延迟,但都会在培养到第5天进入稳定期。从研究结果可以看到雨生红球藻接种后第1天生物量干重并没有增长,从第2天细胞都开始增殖,不同的接种量差别较大,接种量越大增长越快,最终稳定在0.2 g/L左右。接种量为15%时增长缓慢,稳定期生物量干重低,只有0.1 g/L。
2.2 发酵条件的正交试验结果
通过单因素试验探究了雨生红球藻的适宜生长条件,考虑多种因素之间的相互影响,进行了四因素三水平L9(34)正交试验对发酵工艺进一步优化,试验结果如表3、表4所示。
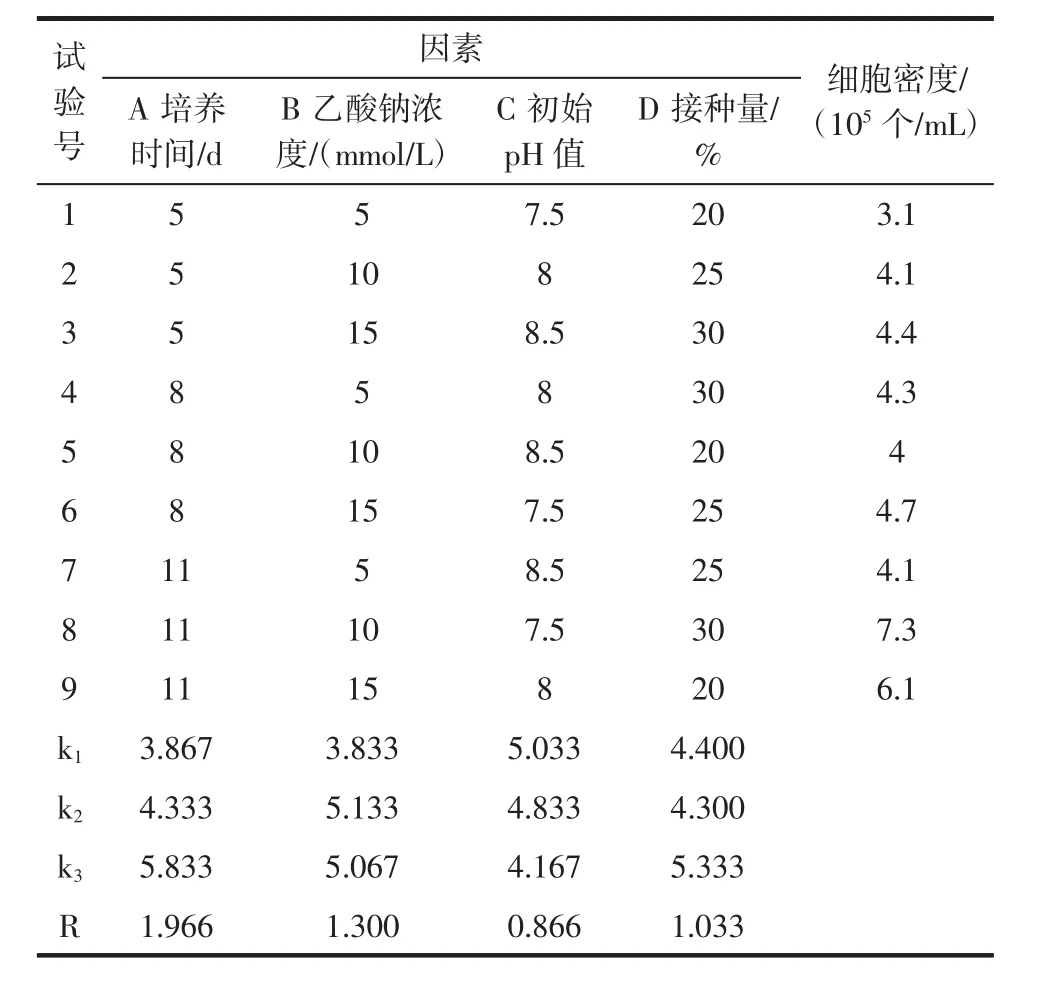
表3 发酵条件的正交试验结果和极差分析Table 3 Results and range analysis of orthogonal experiment on fermentation conditions

表4 发酵条件正交试验的方差分析Table 4 Variance analysis of orthogonal experiment on fermentation conditions
表3中的极差分析结果表明,各因素对细胞密度的影响依次是培养时间、乙酸钠、接种量、初始pH值。雨生红球藻的最佳工艺条件为A3B2C1D3,最优组合恰好为表3中第8组试验,即培养时间11 d,乙酸钠浓度10 mmol/L,初始pH值为7.5,接种量30%,得到的最佳优化条件下雨生红球藻的细胞密度可达到7.3×105个/mL。
2.3 植物激素的正交试验结果
不同植物激素组合条件对藻液细胞密度的影响,试验结果如表5、表6所示。

表5 激素组合的正交试验结果和极差分析Table 5 Results and range analysis of orthogonal experiment on hormone combination
表6 激素组合正交试验的方差分析Table 6 Variance analysis of orthogonal experiment on hormone combination
由表5可得,植物激素对雨生红球藻的高密度培养具有一定的促进作用,添加激素的细胞密度均高于未添加激素藻液的最高细胞密度。各因素对藻液细胞密度的影响依次是 2,4-D、NAA、6-BA、3-IBA,得到激素的组合最佳工艺条件为A2B2C2D2,即3-IBA、2,4-D、NAA、6-BA 添加量分别为 0.5、0.1、0.01、0.1 mg/L;经试验验证,在该条件下细胞密度为1.17×106个/mL。
报道指出激素对藻类的生长具有促进作用,黄伟卿、岳陈陈等[18-20]研究了不同激素单独和组合应用对雨生红球藻生长的影响,并且取得了有效的成果,由此可见添加植物激素对微藻生长具有一定的影响作用。在本研究中,选用了4种植物激素进行研究,通过正交试验结果得出这些激素在适宜浓度下对雨生红球藻的生长都具有促进作用,其中2,4-D和NAA对试验结果影响较大。添加激素优化后,最终雨生红球藻的细胞密度可达1.17×106个/mL,比优化之前提高28倍。
3 结论
本研究得到适合雨生红球藻NIES-144发酵培养的最佳工艺:发酵培养周期为11 d,碳源乙酸钠添加量为10 mmol/L,初始pH值为7.5,接种量控制在30%,添加植物激素可以提高细胞密度,激素3-IBA、2,4-D、NAA 和 6-BA 的添加量分别为 0.5、0.1、0.01、0.1 mg/L,优化后发酵雨生红球藻的细胞密度可达1.17×106个/mL,比优化之前提高28倍。本研究为雨生红球藻发酵培养提供必要的依据,如何规模化应用还需进一步优化。

