8种食用菌粗黄酮的萃取及其抗氧化活性研究
范俐,姜咸彪,许祯毅
(武夷学院茶与食品学院,福建 南平 354300)
食用菌营养丰富、味道鲜美,被称为“山珍”与“优质食品的顶峰”,含有多种生理活性物质,具有重要食疗保健功能。黄酮类物质具有抗氧化、预防心血管疾病、抗癌、抗衰老、抗疲劳、抗菌、抗病毒、抗过敏、增强免疫机能、调节脂质代谢与内分泌等诸多功效[1-2]。越来越多的研究表明,天然黄酮不仅存在于植物体内,也存在食用菌子实体中[3-6]。食用菌黄酮的提取方法主要有超声波醇提法、超临界CO2萃取法、微波提取法、复合酶法和溶剂浸提法等。超声波乙醇浸提法(下文简称超声波醇提法)具有操作简便、时间短、效率高、节能等特点,是目前使用最多的方法之一。
模拟消化法是在体外模拟人体胃肠消化分解食物的过程,常用于研究食物消化率、食物营养价值和消化酶的复合筛选的方法。近年来,采用模拟消化法萃取分析食物中活性物质及其抗氧化性的文献报道日益增多。Tarko T等研究发现在低pH值胃酸条件下,黄酮类低聚物降解成更小的单元;在小肠中,黄酮可能会发生去糖基化、葡萄糖醛酸化、甲基化、磺化和类黄酮羟基化等生化变化[7];儿茶素没食子酸酯在经肠道消化后对清除自由基、螯合铁离子更为有效;消化酶和胃酸均可以促进抗氧化活性物质的释放,黑脉羊肚菌模拟消化后的抗氧化作用和抗癌细胞增殖活性均有提高[8]。
本研究以8种食用菌为材料,采用模拟消化法与超声波醇提法提取粗黄酮,比较两种方法对粗黄酮含量、还原力、清除羟自由基能力的不同影响,为食用菌保健价值及资源的深度开发提供参考。
1 材料与方法
1.1 材料与试剂
香菇(Lentinus edodes)、姬松茸(Agaricus blazei)、黑木耳 (Auricularia auricula)、银耳 (Tremella fuciformis)、红菇(Russula Vinosa)、梨红菇(Russula cyanoxantha)、黄牛肝(Boletinus auripes)和竹荪(Dictyophora indusiata)等8种食用菌:南平市建阳菇乃乃有限公司,60℃烘干12 h后,用高速粉碎机粉碎,过100目筛,装入密封袋备用。
芦丁标准品:上海阿拉丁生化科技股份有限公司;抗坏血酸、硫酸亚铁、水杨酸、过氧化氢、铁氰化钾、硫氰酸钾、三氯乙酸、氢氧化钠、氯化钠、亚硝酸钠:上海展云化工有限公司;牛胆粉、淀粉酶(10 U/mg)、胃蛋白酶(30 000 U/g)、胰酶(胰脂肪酶 2 500 U/g、胰蛋白酶500 U/g、胰淀粉酶6 700 U/g):上海蓝季科技发展有限公司;硝酸铝、磷酸二氢钾、柠檬酸:国药集团化学试剂有限公司。
1.2 仪器与设备
全温培养摇床(QYC-200):上海新苗医疗器械制造有限公司;台式高速冷冻离心机(Neofug e23R):上海力申科学仪器有限公司;紫外可见分光光度计(UV-6100):上海元析仪器有限公司;小型高速粉碎机(6202):欣镇精密企业有限公司;微量有机纯水机(WP-UP-UV-20):四川沃特尔科技发展有限公司;旋转蒸发仪(RE-2000A):上海亚荣生化仪器厂;超声波清洗机(SB-25-12DT):宁波新芝生物科技股份有限公司;循环水式多用真空泵(SHZ-D-III):河南省予华仪器有限责任公司;电子天平(FA224):舜宇恒平仪器厂;数显恒温水浴锅(HH-4):金坛市鸿科仪器厂;电热恒温鼓风干燥箱(DHG-9076A):上海精宏实验设备有限公司;移液器(Pipet-Life XLS+):梅特勒-托利多国际贸易(上海)有限公司。
1.3 方法
1.3.1 超声波醇提法
参考陈新华[9]的方法制备食用菌粗黄酮提取液,具体操作:称取粉碎的食用菌样品2.00g置于50mL容量瓶中,加入40 mL 80%乙醇溶液,浸泡24 h,超声波辅助提取1 h,上清液用80%乙醇溶液定容至250 mL,测定粗黄酮提取率后,经旋转蒸发浓缩后,用80%酒精配制系列梯度浓度粗黄酮溶液,用于抗氧化试验。
1.3.2 模拟消化法
参考中国药典[10]、刘国艳等[11]、HOU F L 等[12]方法,略作修改。
人工唾液配制:氯化钠0.126 g、氯化钾0.964 g、硫氰酸钾0.189 g、磷酸二氢钾0.655 g、淀粉酶0.2 g,蒸馏水定容至1 000 mL,调至pH6.8。
人工胃液配制:取稀盐酸1.64 mL(相当于盐酸0.381 mL),加蒸馏水80 mL与1 g胃蛋白酶,摇匀后,加蒸馏水定容至100 mL,调至pH1.2。
人工肠液配制:取磷酸二氢钾3.4 g,加水250 mL溶解,用0.1 mol/L氢氧化钠溶液调至pH6.8;另取胰酶5 g,胆粉15 g,加水适量使之溶解;将两液混合后,加水稀释到500 mL,调至pH 6.8。
模拟消化过程:称取2.00g食用菌样品,加入20mL人工唾液,为试验组;不加样品为对照组。于37℃,100 r/min的恒温摇床中消化30 min。将试验组与对照组,用1 mol/L HCl溶液调至pH 2.0,分别加入4 mL人工胃液,于37℃,100 r/min的恒温摇床中消化60 min。再用0.1 mol/L氢氧化钠溶液,将试验组与对照组调至pH6.8,分别加入16 mL人工肠液,于37℃,100 r/min的恒温摇床中消化120 min。最后,取样品置于碎冰冷却,经20 000 r/min离心20 min后,取上清液,残渣过滤液汇总一起,测定容积,放于冰箱备用,测定粗黄酮释放量。再经旋转蒸发浓缩后,用80%酒精配制系列梯度浓度粗黄酮溶液用于抗氧化活性测定。
1.3.3 标准曲线与粗黄酮含量测定
按照王广慧等[13]方法,分别量取0.10 mg/mL芦丁标准溶液 0.00、1.00、2.00、3.00、4.00、5.00 mL 于 10.00 mL容量瓶中,加入0.30 mL的5%亚硝酸钠溶液,摇匀后静置6 min;加入0.30 mL的10%硝酸铝溶液,摇匀后静置6 min;然后加入4.00 mL的4%氢氧化钠溶液,用70%的乙醇定容到刻度,摇匀,静置15 min,在510 nm波长处测吸光度。以吸光度为纵坐标(y),芦丁标准品浓度(mg/mL)为横坐标(x),得线性回归方程y=1.211 1x-0.002,R2=0.999 7。按照同样方法测定8种食用菌样品粗黄酮提取液,做3组平行试验,所得的吸光度带入回归方程,计算出样品粗黄酮浓度(mg/mL)和粗黄酮含量,计算公式如下。
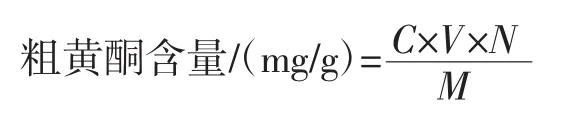
式中:C为由标准曲线计算出的样品粗黄酮浓度,mg/mL;V为待测样品溶液体积,mL;N为样品的稀释倍数;M为样品的质量,g。
1.3.4 还原能力的测定
参照孙维蔓等[14]方法,采用旋转蒸发仪,旋转蒸发浓缩各样品粗黄酮提取液,再配制成0.2、0.4、0.6、0.8、1.0mg/mL系列浓度待测。待测液用蒸馏水定容到1 mL,然后加入pH6.6磷酸盐缓冲液2.5 mL、1%铁氰化钾2.5 mL,50℃水浴20min,再加入10%三氯乙酸1mL,随后5 000 r/min离心10 min,吸取上清液2.5 mL,加入蒸馏水2.5mL,0.1%的三氯化铁0.5mL混匀,于700 nm处测定吸光度,每个样品平行测定3次,以VC作为对照。
1.3.5 羟自由基清除率的测定
参照 HUANG X[15]水杨酸法,配制 0.2、0.4、0.6、0.8、1.0 mg/mL系列样品待测,待测液加入9 mmol/L硫酸亚铁1mL,9mmol/L水杨酸-乙醇溶液1mL和9mmol/L过氧化氢1 mL,在37℃水浴反应30 min,在512 nm下测吸光度,每个样品平行测定3次,计算羟自由基清除率,以VC作为对照。
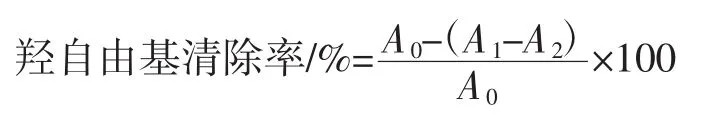
式中:A0为用蒸馏水代替样品的吸光值;A1为样品吸光值;A2为用蒸馏水代替H2O2的吸光值。
1.3.6 统计分析
采用SPSS 19.0软件处理数据和进行配对样本T检验、单因素方差分析、相关性分析,试验结果均表示为均值±标准误差(Mean±SD);采用 SPSS 19.0软件中分析→回归→Probit获得EC90、EC50的模型,部分模型采用曲线回归分析。采用Origin 9.1软件作图。
2 结果与分析
2.1 两种方法萃取食用菌粗黄酮含量的比较
模拟消化法与超声波醇提法提取8种食用菌粗黄酮含量比较见表1。
由表1可知,采用体外模拟消化法提取食用菌粗黄酮的含量显著高于超声波醇提法,体外模拟消化法提取8种食用菌粗黄酮含量为1.25 mg/g ~7.85 mg/g,而超声波醇提法为0.45 mg/g ~5.26 mg/g,体外模拟消化法粗黄酮提取率比超声波醇提法高出20.33% ~509.62%。梨菇、银耳、红菇分别高出509.62%、479.69%和307.92%;而姬松茸与竹荪分别仅高出47.27%、20.33%。通过配对样本T检验,两种方法存在极显著正相关,表明采用体外模拟消化法提取食用菌粗黄酮含量,极显著高于超声波醇提法。

表1 模拟消化法与超声波醇提法提取8种食用菌粗黄酮含量比较Table1 Comparisons of crude flavonoids yield in 8 edible fungi extracted by simulated digestion and ultrasonic alcohol extraction
8种不同食用菌粗黄酮的含量差异也同样显著(P<0.01),两种方法提取液中粗黄酮含量最高均为黄牛肝,最小均为黑木耳。
2.2 两种方法萃取食用菌粗黄酮抗氧化活性比较
2.2.1 羟自由基清除能力的比较
8种食用菌粗黄酮对羟自由基的消除作用见图1,模拟消化法与超声波醇提法提取8种食用菌粗黄酮对羟自由基消除作用的90%最大效应浓度(concentration for 90% of maximal effect,EC90)比较见表 2。
由图1可见,相同浓度的粗黄酮溶液进行比较,模拟消化法提取的粗黄酮,其羟自由基清除能力强于超声波醇提法,羟自由基清除率随着粗黄酮浓度的增加而升高。由表2可见,8种食用菌粗黄酮羟自由基清除EC90比较,模拟消化法提取的粗黄酮清除羟自由基能力比超声波醇提法高出33.64% ~3 216.67%,按大小排序为:黑木耳>银耳>竹荪>黄牛肝>梨菇>香菇>红菇>姬松茸。
2.2.2 还原能力的比较
8种食用菌粗黄酮还原力的比较见图2,模拟消化法与超声波醇提法提取8种食用菌粗黄酮的还原力EC50比较见表3。
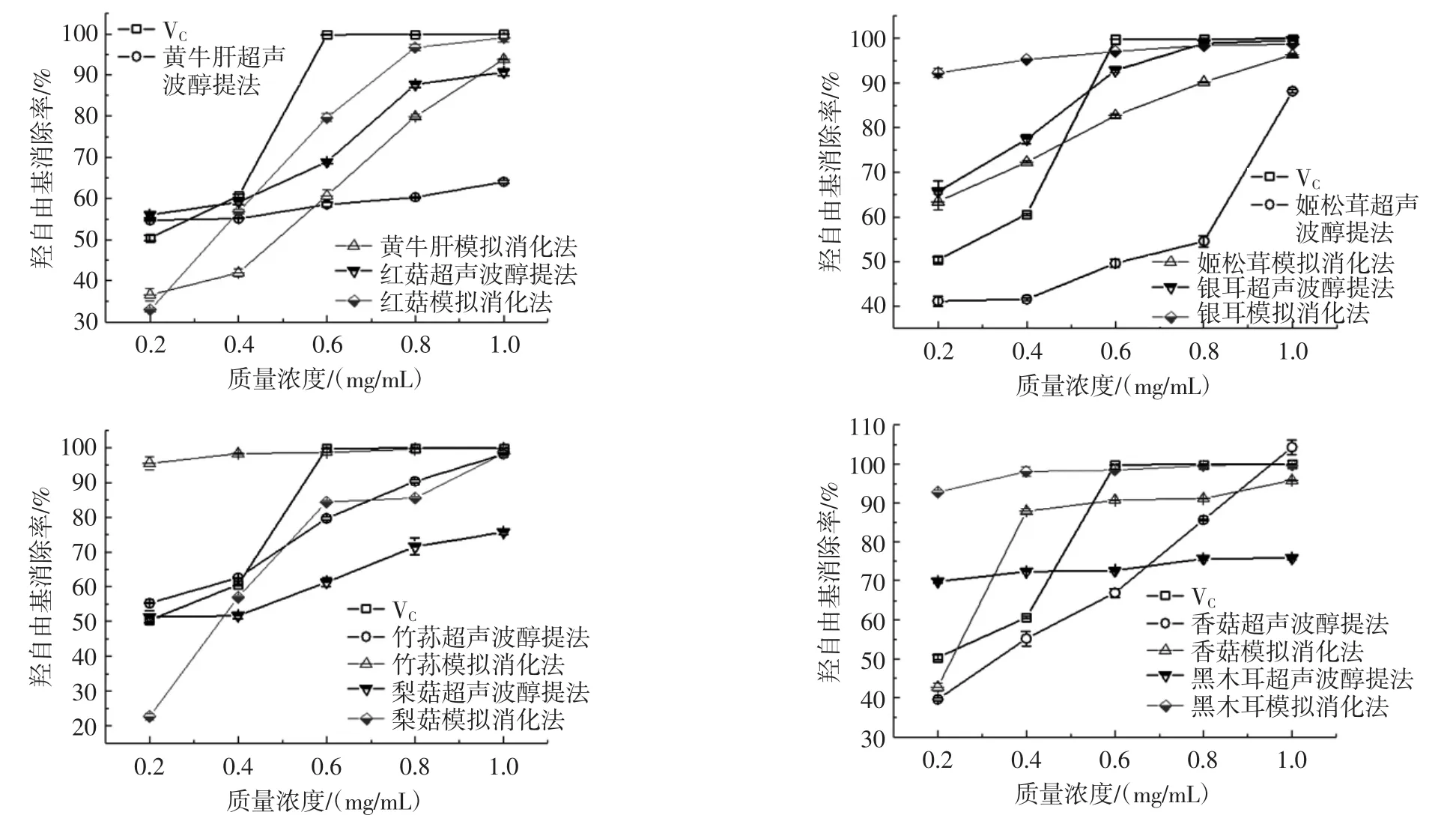
图1 8种食用菌粗黄酮对羟自由基的清除作用Fig.1 Scavenging activity to hydroxyl radical of crude flavonoids from 8 edible fungi
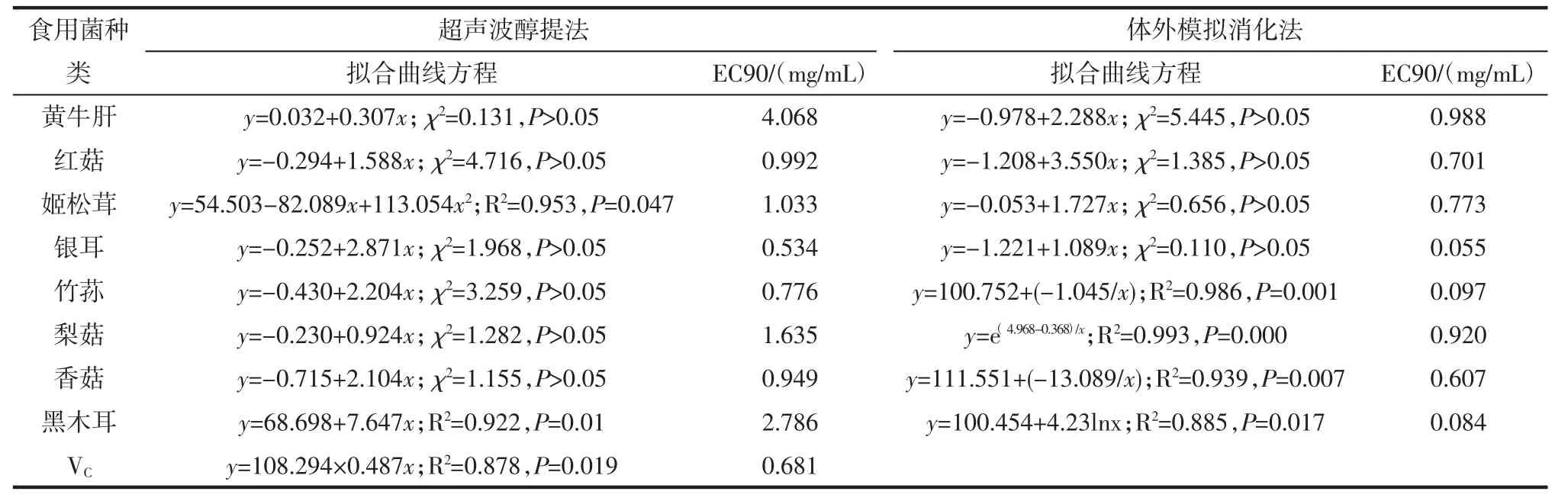
表2 模拟消化法与超声波醇提法提取8种食用菌粗黄酮对羟自由基清除作用的EC90比较Table 2 Comparisons of EC90 scavenging activity to hydroxyl radical of 8 crude flavonoids extracted from edible fungi by in simulated digestion and ultrasonic alcohol extraction
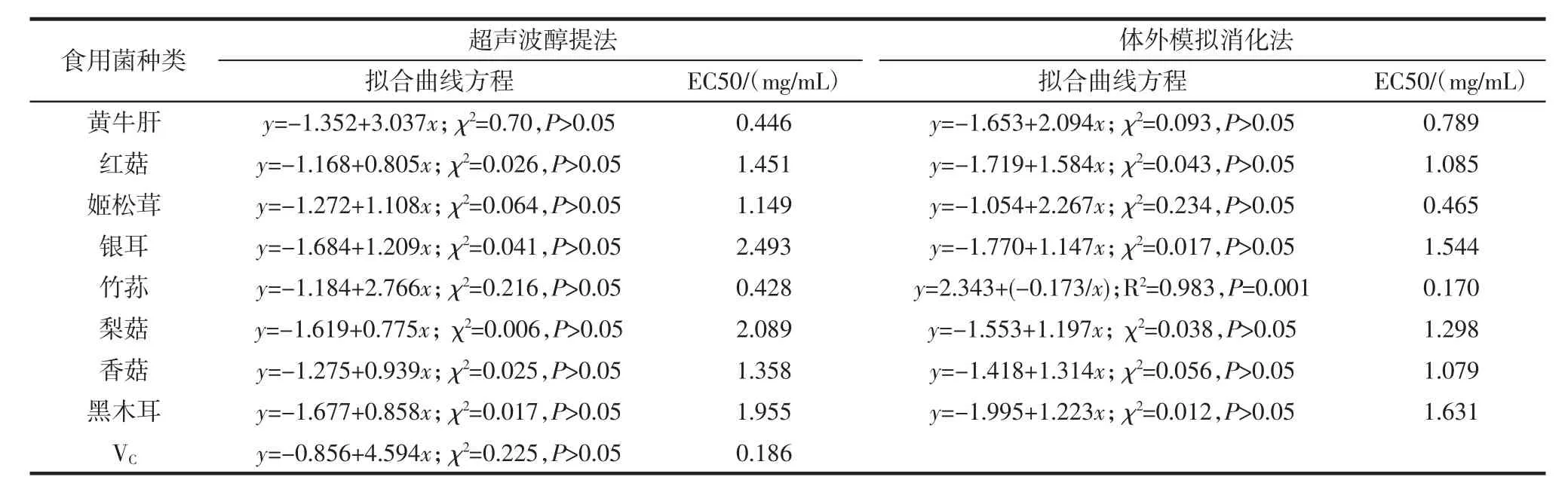
表3 模拟消化法与超声波醇提法提取8种食用菌粗黄酮的还原力EC50比较Table 3 Comparisons of reducing power EC50 of 8 crude flavonoids extracted from edible fungi by simulated digestion and ultrasonic alcohol extraction
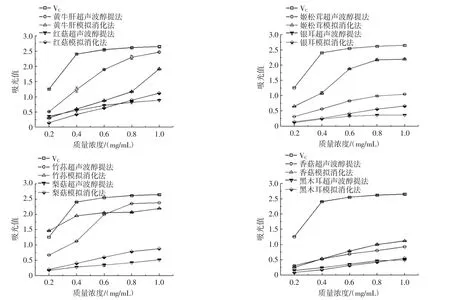
图2 8种食用菌粗黄酮还原力的比较Fig.2 Comparisons of the reducing power of crude flavonoids from 8 edible fungi
由图2可见,相同浓度的粗黄酮溶液进行比较,两种方法萃取的粗黄酮吸光值随着浓度的增加而升高,说明8种食用菌粗黄酮还原能力随着浓度增加而加强。由表3可见,体外模拟消化法提取8种食用菌粗黄酮还原力EC50与超声波醇提法比较,除了黄牛肝降低了43.47%,其余7种食用菌粗黄酮还原力EC50均高于超声波醇提法,增加幅度为19.87% ~151.76%,增加幅度最大的分别为姬松茸、银耳与红菇。按幅度大小排序为:竹荪>姬松茸>银耳>梨菇>红菇>香菇>黑木耳>黄牛肝,其中竹荪、姬松茸、银耳的粗黄酮还原力EC50增加幅度分别为151.76%、147.10%和61.46%。
3 讨论与结论
采用模拟消化法萃取8种食用菌子实体的粗黄酮,萃取液中粗黄酮的含量均显著高于超声波醇提法,增加幅度为20.3% ~509.6%。表明模拟消化过程中,在多种消化酶、胃酸、胆盐的作用下,能够更多释放食用菌子实体中黄酮类物质。主要原因可能是:1)在胃蛋白酶、胰蛋白酶的作用下,将结合或包围于黄酮外部的蛋白质水解为小分子多肽,使结合态黄酮转化为游离态,从细胞壁中分离释放,Li Qian等[15]和Tarko等[7]的研究中也得到了类似的结果;2)黄酮大部分以氢键和疏水键等非共价键与多糖(如纤维素、半纤维素)结合,胃酸属于强酸环境,破坏了氢键的稳定性,降低了分子之间的作用力[16],从而使黄酮物质释放;3)黄酮通常与多糖或有机酸连接,结合于细胞的不同组分中,在唾液淀粉酶、胰淀粉酶作用下断裂,促进黄酮物质释放;4)模拟消化过程可以降低食糜的粒径,有利于黄酮的释放;5)在胃液作用下,部分多聚类黄酮或寡聚类黄酮水解为类黄酮单体[17-18]。模拟消化法可以促进多酚的释放,从彦丽等[19]、赵旭等[20]和封易成等[21]的研究也得到了类似的结果。黄酮苷酸解为黄酮苷元见图3。
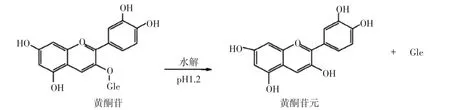
图3 黄酮苷酸解为黄酮苷元Fig.3 Flavonoid glycosides acid hydrolysis to flavonoid aglycones
模拟消化法萃取粗黄酮的抗氧化活性也显著高于超声波醇提法。将两种方法萃取获得的粗黄酮,配制成相同浓度梯度溶液进行抗氧化活性比较,模拟消化法自由基清除能力EC90高于超声波醇提法33.64% ~3 216.67%,还原力EC50高出19.87% ~151.76%。主要原因可能是:1)在胃酸作用下,黄酮苷类部分被酸解去糖基化,转变为游离态黄酮苷元或形成更小糖基的黄酮苷[22],具有更强的清除氧自由基能力,黄酮苷元效价是黄酮糖苷的7倍[23];2)部分黄酮糖苷的糖基为多糖,在唾液淀粉酶、胰淀粉酶作用下断裂,形成糖基更小而抗氧化更强的黄酮苷,这一结果在刘亚男、Baublis等的研究中也得到证实[24-26]。抗氧化活性大小顺序为黄酮苷元>黄酮糖苷>黄酮二糖苷>黄酮四糖苷。超声波醇提法采用80%乙醇溶剂,萃取物主要为黄酮苷类,没有发生类似生化反应;3)体外消化使黄酮物质存在形式发生改变,不同活性物质之间发生协同作用,使抗氧化活性增加[27];盛雪飞[28]研究6种黄酮单体的抗氧化协作效应,发现槲皮素和芦丁具有较高的抗氧化性,与其他黄酮单体组合时,具有协同增效作用;4)人工消化液和胆盐含有金属离子与黄酮的螯合反应,提高抗氧化活性。另外,萃取溶剂不同,提取的除黄酮之外的物质成分有所不同,模拟消化的是水提物,含有多糖和黄酮苷,而超声法的是醇提物,提取的醇溶物不含多糖和黄酮苷,两种不同的萃取溶剂也可能成为抗氧化活性不同的原因之一。
模拟消化法较真实地模拟了食物在人体内消化过程中的pH值和酶环境,一些抗氧化物质(如黄酮)在胃肠道可能会发生各种生化反应,影响其生物生理活性,传统的化学萃取法无法真实反映黄酮在消化道中的存在形式和抗氧化能力。因此,模拟消化法对食用菌黄酮及其抗氧化活性的评价更科学合理。但是,人体消化道是一个复杂体系,涉及诸多因素,如何进一步纯化食用菌黄酮化合物,更准确评价其活性功能,有待于深入研究。

