VDR基因多态性与儿童慢性乙型肝炎的临床相关性分析*
黄彩芝,张 聪,唐 莲,莫丽亚
湖南省儿童医院:1.检验中心;2.肝病中心,湖南长沙 410007
乙型肝炎病毒(HBV)感染仍然是全球性的重大公共卫生问题,每年约有一百万人死于HBV感染[1]。HBV感染后可导致慢性乙型肝炎(CHB)、肝纤维化、肝硬化及肝细胞癌,儿童感染HBV后更容易发展为慢性感染,其中新生儿乙型肝炎慢性化率为80%~90%、小于6岁儿童乙型肝炎慢性化率为25%~30%,而成人乙型肝炎慢性化率不超过5%[2]。人类感染HBV的转归与病毒本身、环境、宿主免疫状态和遗传易感性等多种因素有关。有研究表明,维生素D受体(VDR)基因单核苷酸多态性(SNPs)与HBV宿主遗传易感性,HBV感染后的免疫调节、治疗反应、疾病进程及临床结局等密切相关[3-6],但关于VDR基因SNPs与儿童CHB关系的相关报道较少。本研究通过观察CHB患儿VDR基因位点[BsmI(rs1544410)、ApaI(rs7975232)、TaqI(rs731236)、FokI(rs2228570)]的基因型和等位基因频率分布,初步探讨VDR基因SNPs与儿童CHB的遗传易感性、HBV基因型、肝脏病变严重程度及血清25羟维生素D[25(OH)D]水平的关系。
1 资料与方法
1.1一般资料 选取2016-2019年夏秋季节(每年5—10月)就诊于本院肝病中心的CHB患儿189例作为CHB组,其中男124例,女65例;年龄[61.00(37.50~97.50)]个月。纳入标准:(1)年龄为1个月至14岁;(2)CHB诊断符合中华医学会感染病学分会和肝病学分会制订的《慢性乙型肝炎防治指南(2019年版)》[7]诊断标准。排除标准:(1)合并其他肝脏疾病、感染性疾病、恶性肿瘤、自身免疫性疾病、内分泌疾病、血液系统疾病、先天性免疫功能异常等;(2)入院前4周内服用维生素D制剂或免疫调节剂。
采用组织病理活检的方法衡量肝脏炎症活动度和纤维化程度[8],根据肝脏病变严重程度将CHB患儿分为轻度组和中度组,根据HBV基因型将CHB患儿分为HBV B型组和HBV C型组。另选择同期在本院儿童保健所体检的健康儿童56例作为对照组,其中男36例,女20例;年龄[59.50(32.25~95.25)]个月。CHB组与对照组年龄(Z=0.648,P=0.517)与性别比较(χ2=0.033,P=0.855),差异均无统计学意义(P>0.05),具有可比性。本研究获得本院伦理委员会批准,所有入选儿童均征得监护人知情同意。
1.2方法
1.2.1标本采集和处理 采集CHB组和对照组儿童空腹静脉血3~4 mL,其中1 mL使用乙二胺四乙酸抗凝后用于DNA提取,2~3 mL未抗凝血分离血清用于HBV基因分型及25(OH)D水平检测。
1.2.2DNA提取 采用DNA提取试剂盒(南京诺唯赞生物科技有限公司)提取乙二胺四乙酸抗凝血液中的DNA,使用紫外分光光度计测定DNA浓度及纯度,置于-20 ℃保存备用。
1.2.3VDR基因SNPs检测 采用单碱基延伸技术通过多重PCR反应体系检测VDR基因位点BsmI(rs1544410)、ApaI(rs7975232)、TaqI(rs731236)、FokI(rs2228570)的多态性。PCR扩增仪为美国ABI公司提供的ABI Veriti DX扩增仪。BsmI位点的上游引物:TCT GAG GAA CTA GAT AAG CAG,下游引物:CAG GAA TGT TGA GCC CAG TT;ApaI位点的上游引物:GGA TAG AGA AGA AGG CAC AG,下游引物:CGG TCA GCA GTC ATA GAG G; TaqI位点的上游引物:GCT CCT GTG CCT TCT TCT C,下游引物:GAT GTA CGT CTG CAG TGT G;FokI位点的上游引物:GGT GGC ACC AAG GAT G,下游引物:CAA AGT CTC CAG GGT CAG G。PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共45个循环;72 ℃再延伸5 min。PCR产物纯化后行SNaPshot PCR扩增,扩增条件:96 ℃预变性10 s,96 ℃变性10 s,50 ℃退火5 s,60 ℃延伸30 s,25个循环;最后4 ℃恒温。SNaPshot PCR产物纯化后经毛细管电泳,利用美国ABI公司提供的3500Dx基因测序仪完成位点测序,分析软件为GeneMapper 5.0。
1.2.4HBV基因分型 采用实时荧光定量PCR的方法,由金域医学检验所完成CHB患儿的HBV基因分型。
1.2.5血清25(OH)D水平检测 采用化学发光法,仪器和试剂为美国西门子ADVIA Centaur XP全自动化学发光免疫分析仪及配套试剂。
1.3统计学处理 使用SPSS18.0软件对数据进行统计学分析。非正态分布的计量资料以中位数和四分位数[M(P25,P75)]表示,两组间比较采用Mann-WhitneyU非参数秩和检验,多组间比较采用Kruskal-WallisH非参数秩和检验;对照组进行Hardy-Weinberg遗传平衡检验。计数资料以例数和百分率表示,采用χ2检验对组间基因型及等位基因频率进行比较,以比值比(OR)和95%置信区间(CI)表示暴露于某个基因型或等位基因后发生CHB或感染某种HBV基因型或较严重肝脏病变的危险性。以P<0.05为差异有统计学意义。
2 结 果
2.1研究对象一般情况 CHB患儿中有139例进行了HBV基因分型,其中HBV B型组118例,HBV C型组21例;120例CHB患儿行B超引导下肝脏穿刺组织病理活检,经检查,肝脏炎症活动度情况为G1级53例、G2级25例、G3级42例;纤维化程度分别为S0期24例、S1期73例、S2期12例、S3期9例、S4期2例;其中78例患儿经组织病理活检诊断为轻度CHB(轻度组),42例患儿经组织病理活检诊断为中度CHB(中度组)。
2.2CHB组与对照组VDR基因位点基因型与等位基因频率分布 经Hardy-Weinberg遗传平衡检验,对照组儿童VDR基因 BsmI、ApaI、TaqI、FokI 4个位点基因型频率符合Hardy-Weinberg 遗传平衡定律(χ2=0.077、2.900、0.019、2.357,均P>0.05),表明标本选取具有群体代表性。
位于VDR基因ApaI位点的基因型在CHB组和对照组间的频率分布比较,差异有统计学意义(P<0.05),CHB组的AC基因型(43.90%)频率分布高于对照组(26.8%),提示与ApaI CC基因型比较,AC基因型可能增加儿童HBV感染的风险(OR=2.213,95%CI1.130~4.335)。而BsmI、TaqI和FokI 3个位点的基因型在CHB组和对照组中的频率分布比较,差异均无统计学意义(P>0.05)。VDR 基因BsmI、ApaI、TaqI、FokI 4个位点的等位基因在CHB组和对照组中的频率分布比较,差异均无统计学意义(P>0.05)。见表1。
2.3CHB患儿轻度组与中度组VDR基因位点基因型与等位基因频率分布 VDR基因 BsmI、ApaI、TaqI、FokI 4个位点的基因型和等位基因频率分布在轻度组和中度组CHB患儿中比较,差异均无统计学意义(P>0.05)。见表2。
2.4CHB患儿HBV B型组与HBV C型组VDR基因位点基因型与等位基因频率分布 HBV B型组与HBV C型组CHB患儿中,VDR基因BsmI、ApaI、TaqI、FokI 4个位点的基因型和等位基因频率分布比较,差异均无统计学意义(P>0.05)。见表3。
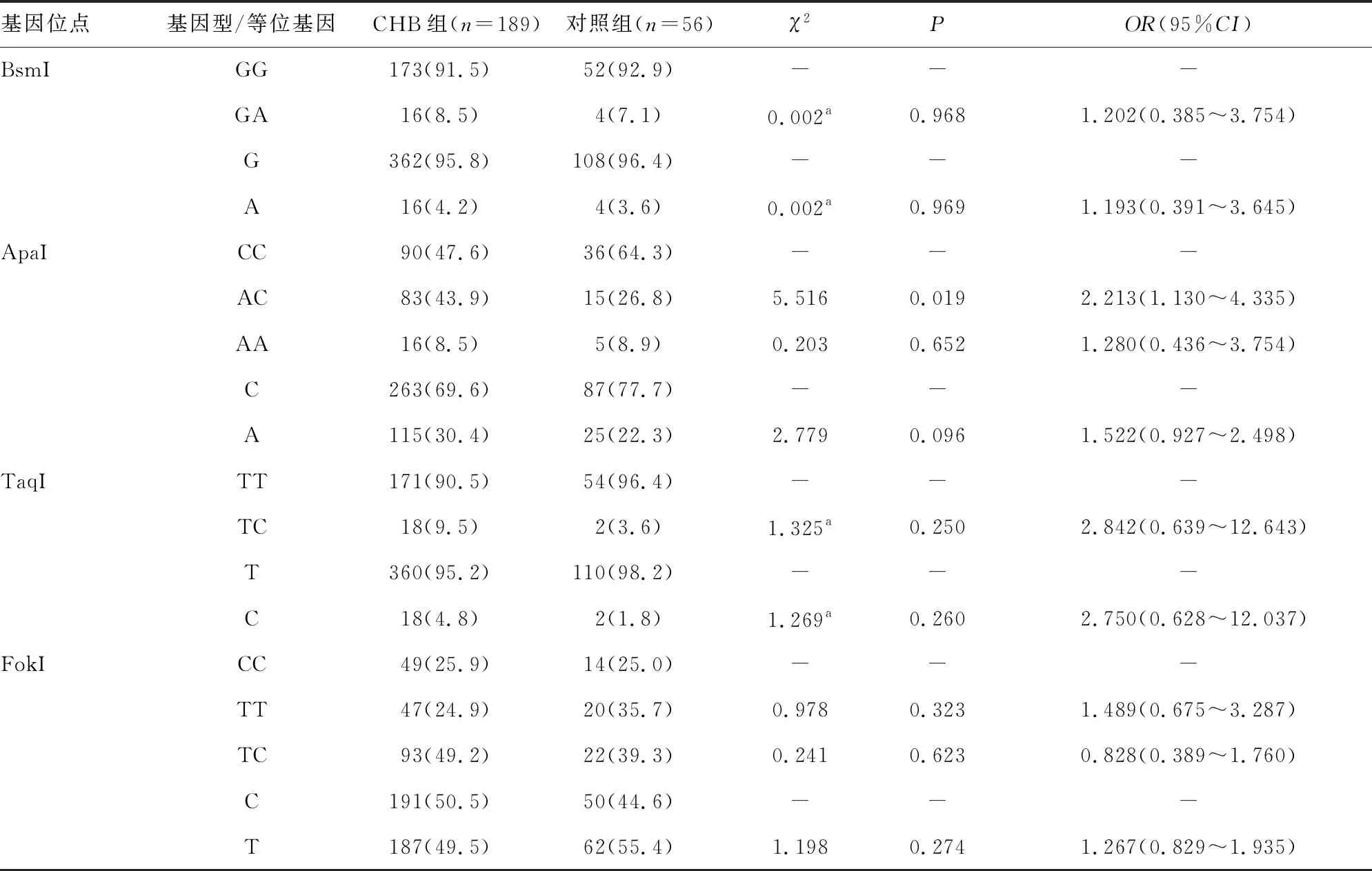
表1 CHB组与对照组VDR基因位点基因型与等位基因频率分布[n(%)]
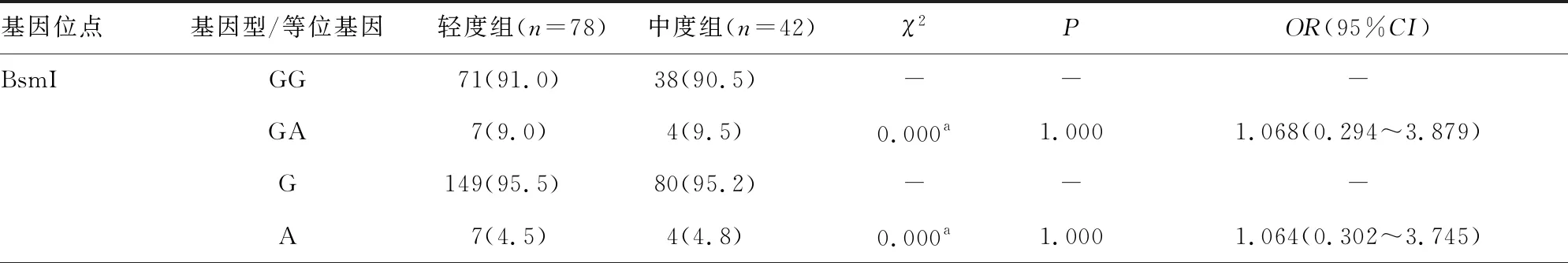
表2 CHB患儿轻度组与中度组VDR基因位点基因型与等位基因频率分布[n(%)]
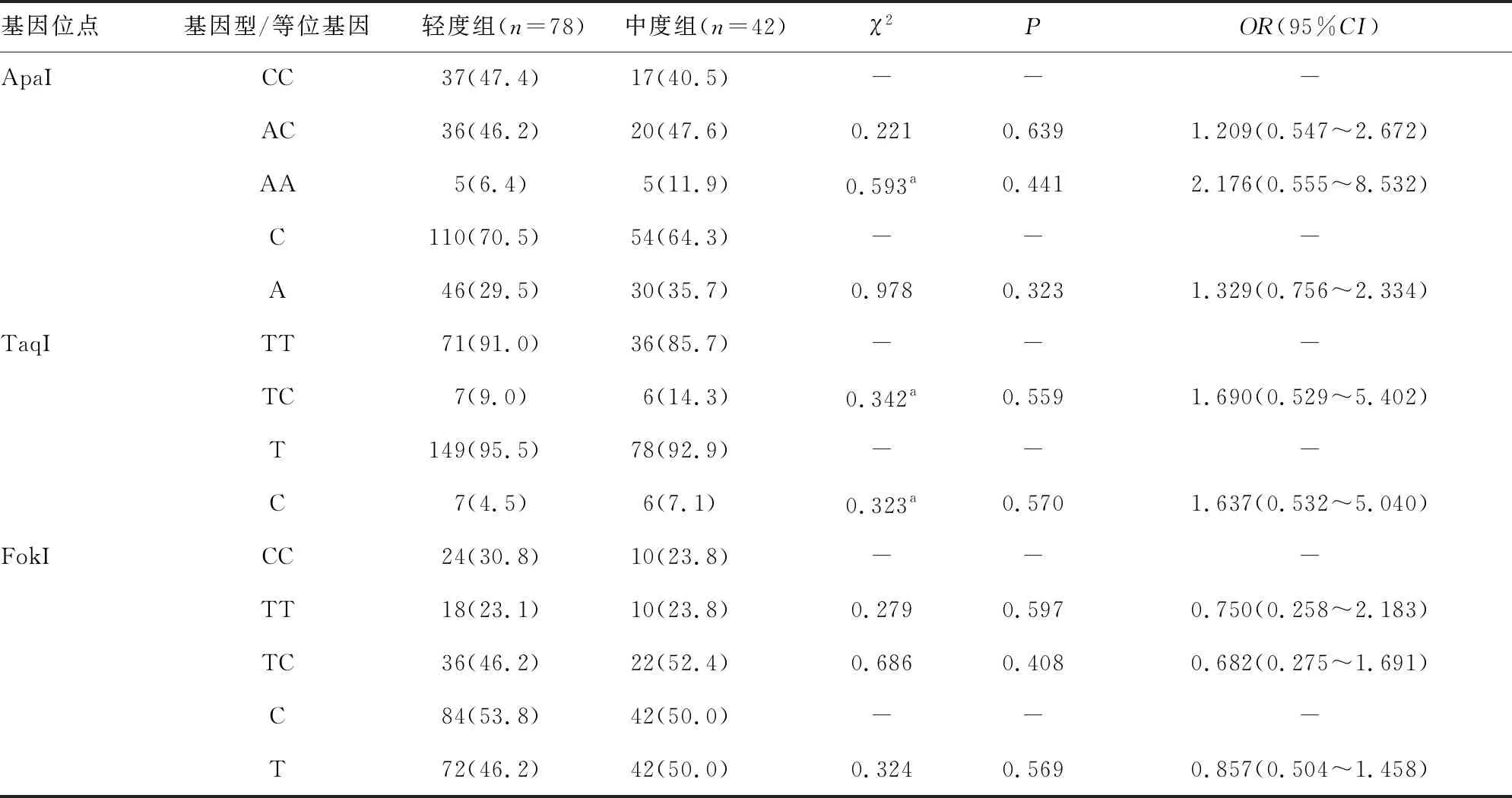
续表2 CHB患儿轻度组与中度组VDR基因位点基因型与等位基因频率分布[n(%)]
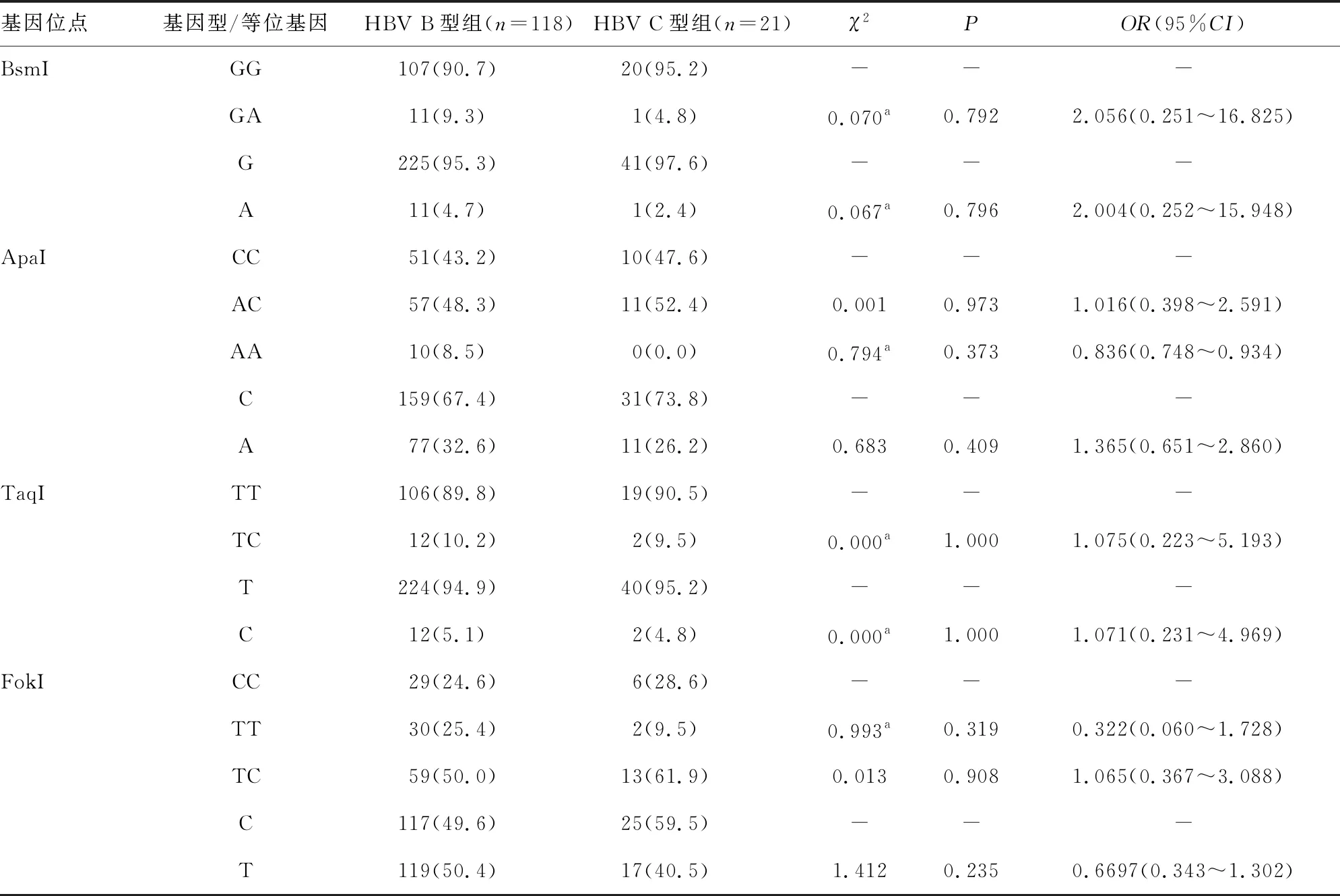
表3 HBV B型组与HBV C型组VDR基因位点基因型与等位基因频率分布[n(%)]
2.5CHB患儿VDR基因位点不同基因型间血清25(OH)D水平比较 CHB患儿VDR基因BsmI、ApaI、TaqI、FokI 4个位点不同基因型间血清25(OH)D水平比较,差异均无统计学意义(P>0.05)。见表4。

表4 CHB患儿VDR基因位点不同基因型血清25(OH)D水平比较[M(P25,P75)]
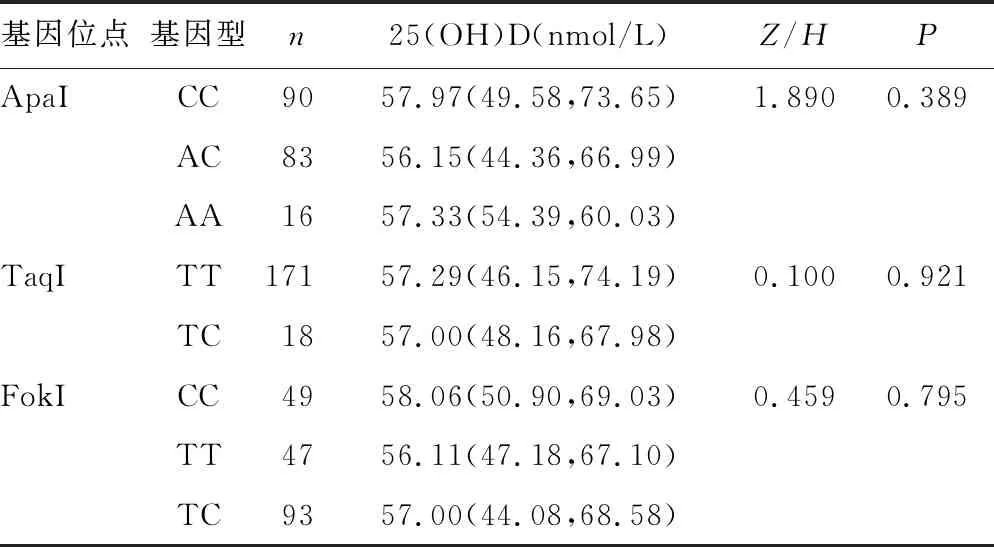
续表4 CHB患儿VDR基因位点不同基因型血清25(OH)D水平比较[M(P25,P75)]
3 讨 论
VDR属于类固醇激素/甲状腺激素受体超家族成员,是存在于多种细胞核和细胞膜上的可溶性蛋白,主要分布于心、脑、肾脏、肝脏、皮肤等多种组织器官中,以及巨噬细胞、单核细胞、T细胞、B细胞等各种免疫细胞中,此外在许多肿瘤细胞中也发现了VDR的表达。VDR基因定位于12号染色体长臂,含427个氨基酸残基,相对分子质量为50×103。VDR通过调节靶基因转录介导活性维生素D发挥生物学效应,从而调节机体的固有免疫与适应性免疫反应。研究表明活性维生素D-VDR信号通路参与了涉及人体生理功能的900多种基因的表达与调控[9],VDR基因多态性除了与钙磷代谢有关外,还与肿瘤、代谢性疾病、感染性疾病、自身免疫性疾病等多种疾病的病理生理机制密切相关[3,10-14]。目前已发现的VDR基因多态性主要集中在4个SNPs位点,分别为第8内含子的BsmI位点和ApaI位点、第9外显子的TaqI位点及第2外显子的FokI位点。
近年来VDR基因SNPs与CHB关系的研究日益受到重视,VDR SNPs可以改变其编码的VDR蛋白质的结构与生物学功能,HBV可能通过下调VDR的表达水平阻止活性维生素D对HBV转录与翻译的抑制作用[4],同时VDR与活性维生素D结合后可抑制1型辅助性T细胞的增殖与细胞因子的分泌,并激活2型辅助性T细胞的应答从而调节机体的免疫功能[15],而CHB患者HBV的清除主要依赖于以1型辅助性T细胞应答为主的细胞免疫反应,因此VDR基因的不同表达可能与HBV易感性及疾病进程有一定的相关性。有研究指出,携带VDR FokI基因型CC、CT及等位基因C的个体具有更高的HBV易感性,CT与TT基因型的CHB患者对聚乙二醇干扰素的治疗反应更强,FokI基因SNPs可作为HBV感染后预示肝细胞癌发生风险、评估疾病严重程度的分子标志物[3,5,16];TaqI TT基因型和T等位基因与无症状HBV感染有关[17-18];ApaI AA基因型与CHB患者高病毒载量和肝病严重程度相关[18];BsmI BB基因型与HBV感染转归有一定的联系[19]。而HE等[3]的Meta分析研究表明,BsmI、ApaI、TaqI位点的多态性与HBV易感性并无联系,HOAN等[6]的研究亦指出,VDR基因BsmI、ApaI、TaqI、FokI 4个位点的多态性均与HBV感染风险无关,但ApaI位点的多态性与HBV感染患者的临床结局和疾病进展相关。本研究中VDR基因BsmI、TaqI和FokI 3个位点的基因型和等位基因频率在CHB组和对照组、CHB轻度组和中度组中的比较,差异均无统计学意义(P>0.05),而ApaI位点的基因型频率分布在CHB组和对照组中的比较,差异有统计学意义(P<0.05),CHB组的AC基因型频率分布高于对照组,提示与ApaI CC基因型比较,携带AC基因型的儿童可能有更高的HBV感染风险(OR=2.213,95%CI1.130~4.335),但ApaI各基因型在不同严重程度CHB患儿中的频率分布比较,差异无统计学意义(P>0.05),表明VDR基因SNPs可能与CHB患儿肝脏病变严重程度无关。上述研究结果不一致的原因可能与种族差异、地域环境差异、受试人群生活方式特征,以及研究方法和样本选择的不同等有关。
HBV有多个基因型,我国以B基因型和C基因型为主[7],HBV基因型与疾病进展和干扰素治疗应答有关,HBV e抗原阳性者B基因型对干扰素-α治疗的应答率高于C基因型[20]。本研究中HBV B基因型和C基因型的CHB患儿VDR基因 BsmI、ApaI、TaqI、FokI 4个位点的基因型与等位基因频率分布比较,差异均无统计学意义(P>0.05),提示VDR基因SNPs可能与HBV B基因型或C基因型的易感性无关。另外本研究还发现,CHB患儿VDR基因 BsmI、ApaI、TaqI、FokI 4个位点不同基因型间的血清25(OH)D水平比较,差异均无统计学意义(P>0.05),表明VDR基因SNPs在调控25(OH)D生物学功能的同时,可能并不影响血清中的25(OH)D水平,与相关研究一致[6]。本研究中与病例组比较,对照组儿童样本量较小,存在一定的局限性,另外本次单中心研究未纳入组织病理活检诊断为重度CHB的患儿,可能导致研究结果不全面,有待进一步的多中心扩展研究与验证。
综上所述,本研究结果表明,VDR基因ApaI(rs7975232)位点多态性可能与儿童CHB易感性相关,携带AC基因型者发生HBV感染的危险性增高;未发现VDR基因位点(BsmI、ApaI、TaqI、FokI)多态性与CHB患儿肝脏病变严重程度、HBV基因型及血清25(OH)D水平的相关性。

