美国组织库及组织修复材料的发展近况
白玉龙 耿广平 陈维明 陈金发 梁晓雷 谢岩 夏岑灿
1中国人体健康科技促进会,北京100010;2河南医药健康技师学院医药经贸系,开封475000;3常州市亘从生物力学研究中心213164;4北京燕创生物医学工程研究院100010;5宁夏人体组织器官库,银川750004
0 引 言
2019年 9月 24 日至 9月 27 日,笔者与中国人体健康科技促进会秘书长夏岑灿、常州市亘从生物力学研究中心陈维明一行参加了美国组织库协会(The American Association of Tissue Banks,AATB)2019年年会。会议期间,分别与AATB 轮值主席Diana Buck、AATB 下属认证委员会、教育委员会、科学技术委员会和标准委员会成员以及美国大型非盈利性同种异体组织加工企业MTF Biologics 负责人就同种异体组织修复材料的监管模式、产品发展趋势和美国捐献事业等问题进行了交流与探讨。现结合公开报道数据将美国组织库及组织修复材料的发展近况作如下报道,以期为我国组织库事业和组织移植材料的发展带来一些值得探讨和思考的问题。
1 美国组织库及AATB
1.1 美国组织库的发展
组织库是以医学研究、教育和同种异体移植等为目的,接收人类遗体或组织并进行相应的加工处理、储存与运输,以供临床应用的机构[1-2]。组织库的诞生源于组织移植技术的发展,早在1869年瑞士医生Jacques-Louis Reverdin[3]首次进行了现代意义上的皮肤移植。之后 Pollock[4]、Ollier[5]和 Girdner[6]相继应用“尸体”皮肤进行了皮肤移植[7]。同种异体骨移植的首例报道则见于1881年苏格兰外科医生William Macewen[8]写给伦敦皇家学会的报告中。“移植和血管外科之父”、诺贝尔奖得主(1912年)Alexis Carrel[9]极大推动了器官和组织移植事业的发展,他曾说“如果能在人死后立即移植组织和器官,则不会发生组织死亡,身体的所有部分将继续存活。器官和组织被储备起来,可以随时提供给需要它们的外科医生。”
现代化的组织库的建立与军事医学密不可分。1949年,美军总结第二次世界大战时战、创伤救治的经验,在马里兰州成立了美国第一个组织库——美国海军组织库。采用深低温冷冻技术、冷冻干燥技术、化学处理及辐照灭菌等技术加工和保存同种异体组织修复材料,以备战时对组织移植尤其是骨和皮肤移植的需要[10-11]。随后美国组织库迎来了较快的发展,2001年全美登记注册的组织库有154 家,2019年这一数字则达到315 家。美国组织库种类丰富,从性质上可分为非盈利性组织库和盈利性组织库,组织库的功能包括组织采集、供体筛查、运输、加工处理、储存等一种或多种兼备,规模有大有小。其中发展较好、具有一定规模的非盈利性组织库有MTF Biologics、LifeNet Health、AlloSource 等,盈利性组织库则有 Regeneration Technologies, Inc.(RTI)、LifeCell、Osteotech 等。随着时代的变迁,组织库材料也由军用储备逐渐转为民用为主。
1.2 AATB
1975年,Sell 医生在华盛顿举办了一场关于组织库的研讨会,以此来纪念美国海军组织库成立25 周年。会上,其与邀请的全球的外科医生、科学家讨论了诸多话题。次年,AATB 成立[12]。
AATB 是一家专业的、非盈利性科学和教育组织,致力于通过促进和提高人体捐献组织的安全性、质量和可用性来改善和拯救生命。AATB 于1984年制订了第一版组织库标准(Standards for Tissue Banking),1986年提出了检查和认证计划(Inspection&Accreditation Program),1988年提出了组织库专家认证(Certification for Tissue Bank Specialists)。截至目前,AATB 会员包括 120 个组织库和2 000 多名个人会员。近年来,这些组织库从58 000 多名捐赠者获取了组织,并每年为美国近250 万例组织移植手术提供了330 多万例同种异体移植物[12]。美国绝大部分的组织移植材料均出自AATB 认证的组织库。
AATB 下设11 个委员会,包括:认证委员会(负责制定认证管理计划和审核认证材料等)、章程和道德委员会、教育委员会、科学技术委员会、标准委员会等。AATB 常年举办一些线上或线下的培训和学习计划,支持组织库专业人员和组织库技术的发展;同时每年会举办一次AATB年会,邀请行业内医生、组织库代表、企业代表、患者和捐献者家属参加进行交流。
2 组织库产品类型及应用情况
组织库产品种类丰富,几乎涵盖了人体各种组织缺损修复所需的材料,其中应用较早、规模较大的组织库产品为同种异体骨、皮肤和肌腱/韧带。早期的组织修复材料以深低温冷冻保存组织为主,如深低温冷冻骨、皮肤、血管等,随着技术的发展出现了冷冻干燥辐照骨、辐照皮肤、肌腱以及脱细胞真皮、脱细胞异体神经等产品[13-16](图1、表1)。为了尽可能保留组织材料的生物活性,提高临床治疗效果,目前已出现了新鲜的含有异体活细胞的组织移植材料。例如美国MTF Biologics 公司的Trinity Evolution 主要由松质骨及其中的骨细胞以及皮质骨组成;美国Zimmer Biomet 公司的DeNovo NT 则为天然的软骨组织,由含有活细胞的幼年透明软骨块组成,保存于培养液中;美国LifeNet 公司的TheraSkin 含有皮肤固有的活细胞和生物因子等,种类繁多,不一一列举。
3 美国组织库产品监管模式
1984年AATB 制定了第一版组织库标准,要求加入AATB 的会员遵循组织库标准进行供体筛选、取材、处理、保存和供给。在此之前,组织库大多为医院的附属单位,如院内骨库、皮库、血管库等,一般由使用组织材料的医生进行管理。这种管理模式往往会存在一些安全隐患,如移植后发生微生物感染以及传染性疾病[人类免疫缺陷病毒(human immunodeficiency virus,HIV)、肝炎等]传播[17-19]。
1993年美国食品药品监督管理局(Food and Drug Administration,FDA)颁布了一项临时性规定,要求进行特定的传染病检测(HIV、乙型肝炎、丙型肝炎等)、捐赠者筛选和保留完整的记录,以防止HIV 和肝炎通过组织移植材料进行传播。次年,美国疾控中心发布了预防HIV 通过人体组织和器官移植传播的指南(Guidelines for Preventing Transmission of Human Immunodeficiency Virus Through Transplantation of Human Tissue and Organs)。指南中提出彻底的供体筛查是避免HIV 通过移植物传播的最有效途径,应检测捐赠者的HIV-1/2 抗体以及HIV-1 p24抗原。此外,还应对同种异体组织进行额外的病毒灭活处理以进一步降低病毒传播的风险,并推荐采用巴氏灭菌法、辐照法对组织材料进行病毒灭活。

图1 美国MTF Biologics 公司的同种异体组织移植产品(源自MTF Biologics 官网)
为了进一步保护接受组织移植患者的安全,避免HIV、乙型肝炎病毒和丙型肝炎病毒的传播,美国FDA 于1997年7月29 日颁布了最终规则,即美国联邦法典第21 篇第1270 部分(21 CFR 1270)。进一步对1993年的临时性规定进行了说明和修正[20],同时也为人体细胞、组织以及基于细胞和组织的产品(human cell,tissue,and cellular and tissue-based products,HCT/Ps)监管提供了一个框架。目前,美国FDA 已发布了3 项关于HCT/Ps 的监管条例,分别关于注册登记和产品清单(2001年颁布,2004年实施)、供体合格规定(2004年颁布,2005年实施)以及现行人类细胞、组织操作管理规范(2004年颁布,2005年实施),上述法规构成了21 CFR 1271。可见从2005年起美国FDA 已通过正式出台法规对HCT/Ps 进行科学系统的监管,要求组织库及产品应在美国FDA 注册,应对供体进行必要的筛选和血清学筛查,同时应建立良好的操作规范,保证组织材料质量的同时也为公众健康提供保障。
美国对于同种异体组织、HCT/Ps 的监管以美国FDA 监管与行业协会自律(AATB)的形式并存。HCT/Ps 的监管具体按照《公共卫生服务法》(The Public Health Service Act)的第 361 章和第 351 章进行。其中按第361 章管理的HCT/Ps 产品应符合以下标准:①最低限度处理,即对于结构组织,其改造、修补或替换过程不能改变组织的原有相关特征;对于细胞或非结构组织,该过程不能改变细胞或组织的相关生物学特征。②仅供同源使用。③除了加入水、晶体或灭菌剂、防腐剂不会引起HCT/Ps新的临床安全性问题外,其制造过程不涉及任何其他物质与细胞或组织的结合。④HCT/Ps 不具有全身效应,且其原有功能不依赖于活细胞的新陈代谢活动。示例产品如骨(包括脱钙骨)、肌腱、韧带、软骨、皮肤、心包膜、硬脑膜、静脉、动脉、羊膜等。这些产品所能引起的临床安全性、有效性问题有限,仅需按美国FDA 的要求登记,无需上市前审批,一般也无需提交临床试验资料。其他不符合第361 章规定标准要求的HCT/Ps 则需依照第351 章的规定,按药品、器械或生物制品进行注册监管。示例产品如经过培养的软骨细胞、经过培养的神经细胞、基因治疗产品以及复合其他成分或活性因子的组织材料等。
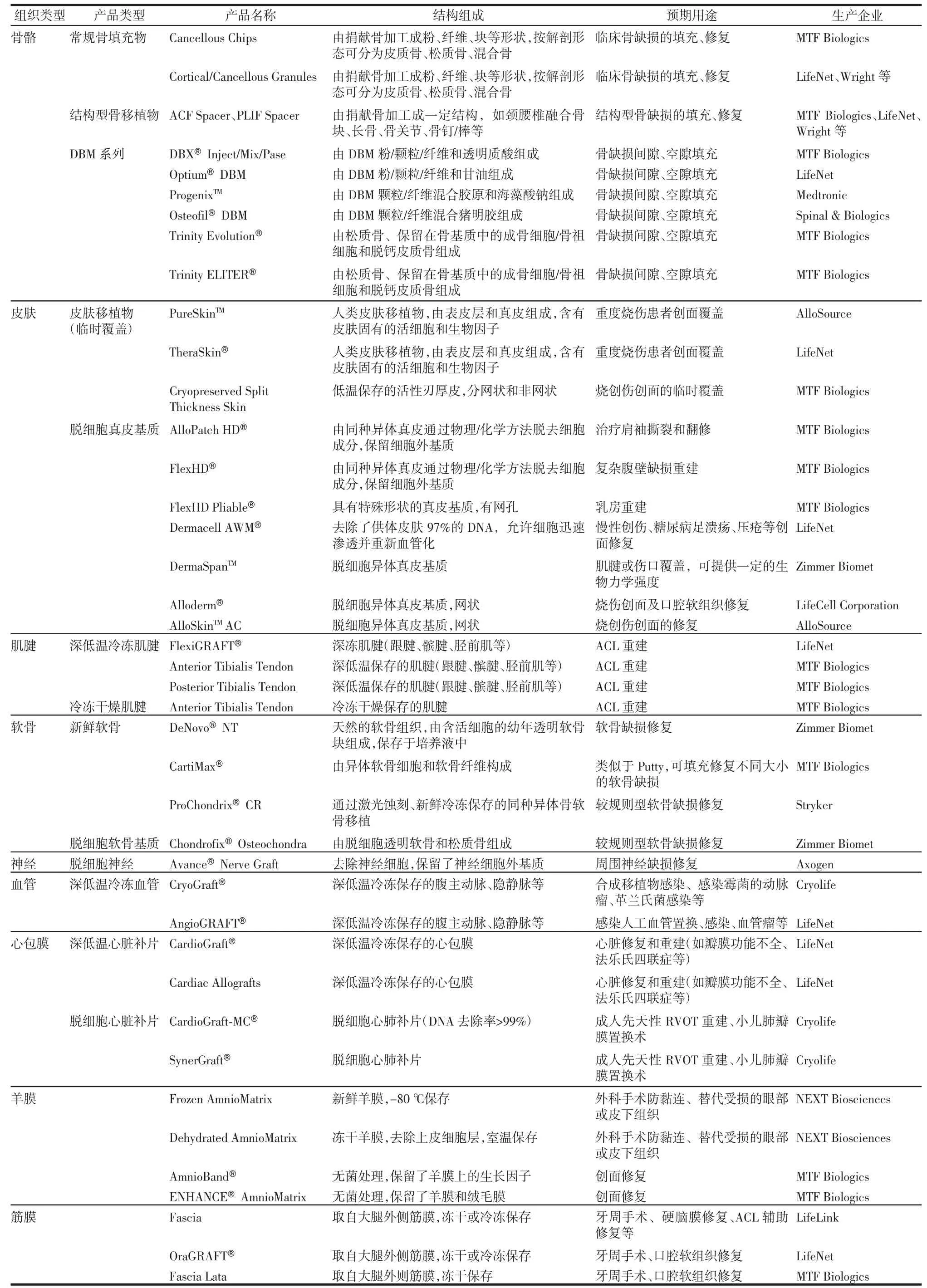
表1 美国同种异体组织移植产品
4 美国同种异体组织捐献模式
早在1968年美国制定了《统一遗体捐献法》(Uniform Anatomical Gift Act)。因认识到器官捐献的经验和法规在全国范围内应保持一致,美国各州相继通过了州法律,并于1971年获得所有州通过并实施[21]。之后于1987年和2006年对《统一遗体捐献法》进行过两次修订。
1968年制定的《统一遗体捐献法》共分为7 部分内容,阐述了对捐献的规定。其中定义了捐献者和死者,捐献者是指同意捐赠自己身体或有权捐赠他人身体的人(通常是近亲),而死者是捐献器官、组织或身体的人。同时解释了谁可以同意捐献。若捐献者是活着的成年人,则其本人可以同意捐献;若捐献者已死亡,则其近亲(若为成年人)有权对死者的遗体进行捐赠。该法还规定了合格的遗体接收人,包括医院、医学院、大学、用于研究和教育目的的储存单位以及将接受移植器官/组织的个人;并详细说明了赠与的合法用途具体取决于受赠人,如捐献给医学院的遗体必须用于研究或医疗领域的改进,而捐献给个人或机构的必须用于个人的医疗救治或组织移植。在对捐献者死亡判定时,依据《统一死亡判定法案》(Uniform Determination of Death Act,1981)进行,以下两条择一均可判定为死亡[22]:①循环和呼吸功能不可逆地停止。②包括脑干在内的整个大脑的所有功能不可逆地停止。
2006年修订《统一遗体捐献法》的主要目的在于通过最大程度的捐献器官来解决器官严重短缺的问题,并纠正或明确在捐献实施过程中出现的一些问题。修订版法案中重申,若捐赠人填写了志愿捐献书或已登记捐献,则无需理由和必要再获得其家人的许可。同时,修订版法案明确了若个人在生前未签署捐献书或登记捐献,即假定此人有捐赠器官的意图。修订版法案认为,每个人均有权在死亡或接近死亡时捐献自己的器官,若本人不愿意捐献则必须以签名书面形式明确记录下来。此外,修订版法案不再规定捐献人必须年满18 岁,未成年人可通过其他法律如申请驾照成为捐献者。修订版法案中第14 条要求医院将即将死亡或在医院内死亡的任何人通知予器官获取组织,以增加器官获取和移植的机会[23]。
美国的捐献登记工作做得十分成功,每个州均有器官获取组织负责捐献宣传、推广、登记等工作。在过去10年美国捐献数量每年均在增长,截至2018年1月,已注册捐赠人数超过1.42 亿,占全美成年人口的54%以上[24-25]。这与美国医疗卫生部门、从事组织移植材料接收、运输、制造、检测和供给的单位及从业人员的宣传教育,以及民众对捐献的认可有很大关系。
5 结语与展望
不同于器官移植的迫切性,组织移植旨在修复人体受损组织,引导组织再生,提高患者的治愈率和生活质量,故其受关注度不及器官移植。但不可否认的是,同种异体组织移植材料的临床疗效仅次于自体组织修复材料,且能减少自体移植患者因组织供区带来的二次损伤,其在临床治疗上具有其他人工合成材料无可比拟的优越性[26]。
我国于2000年首次发布了《医疗器械监督管理条例》(中华人民共和国国务院令第276 号),由国家药品监督管理局主管医疗器械注册、生产、使用等方面内容。对照医疗器械分类目录,同种异体组织材料按第三类医疗器械进行监管,生产企业应根据YY/T 0287-2003《医疗器械质量管理体系用于法规的要求》建立质量管理体系。2003—2005年陆续有4 家企业获得了同种异体骨产品注册证书。2009年12月30 日,国家食品药品监督管理局发布了医药行业标准YY/T 0513《同种异体骨修复材料》系列标准,第一部分为骨组织库基本要求,第二部分为深低温冷冻骨和冷冻干燥骨,第三部分为脱矿骨。分别对骨组织库的运行管理以及骨移植产品的技术指标和检测方法进行了规范,旨在促进行业健康发展,保证同种异体骨产品的安全性和有效性。随着行业的持续发展,除骨之外,越来越多的其他同种异体组织修复材料也陆续被批准应用于临床。因此2020年对该标准进行了修订,其中第一部分由“骨组织库基本要求”改为“组织库基本要求”,所涉及的材料也不仅限于同种异体骨,还包括软骨、肌腱、皮肤、神经等组织。目前,国内从事同种异体组织生产的企业已近20 家,获批上市的同种异体组织材料除了骨之外,还包括皮肤、肌腱、神经等。
按照目前的监管要求,同种异体组织修复材料属于第三类最高风险级别产品监管,该类产品从研发立项到上市许可,需经过漫长的检测、临床试验等过程,未能体现材料本身的优越性,极大限制了其发展和使用。另一方面,国内对于同种异体组织移植材料的监管和国人对于组织捐献的认可还有待进一步提高。2006年卫生部发布了《人体器官移植技术临床应用管理暂行规定》,以加强对中国器官移植技术的管理。2007年3月21 日,国务院第171次常务会议通过了《人体器官移植条例》,其中第二条规定“在中华人民共和国境内从事人体器官移植,适用本条例”但“从事人体细胞和角膜、骨髓等人体组织移植,不适用本条例。”这就使得组织移植材料的捐献“无法可依”。在实际运行过程中,为了保证珍贵的组织材料能够回馈社会,救治病患,组织移植材料亦完全参考《人体器官移植条例》进行管理,需签署捐献书,并绝对禁止任何形式的买卖行为。
一名器官、眼睛和组织的捐献者,至少可挽救或治疗75 名患者[20]。为了提高珍贵组织材料的利用率,避免珍贵组织材料被焚烧和浪费,可参考美国的相关经验并结合中国国情制定一些监管措施。例如,采用“最低限度处理”标准,对于符合最低限度处理的同种异体组织移植材料,可以免于进行临床试验和注册申报,直接向国家药品监督管理局进行备案,但要求生产企业的质量管理体系应符合ISO13485或YY/T 0287 的要求。国家药品监督管理局可定期对生产企业的供体筛选、生产过程、检验过程等进行抽查。对于不满足最低限度处理标准的同种异体移植材料则应按照器械或生物制品进行注册申报。同时要加强行业自律,积极发挥行业协会的作用。中国人体健康科技促进会于1992年11月在国家民政部登记成立,是全国性、行业性、非营利性社会组织,主要从事健康科技的研究及推广应用工作。协会成立有医用组织库中心,在全国范围内积极倡导人体医用组织捐献,引导会员优化接收储运、转化应用等环节,服务教学培训、科研转化、临床应用等人体健康科技需要。同时,协会也在汇集卫生监管部门、食品药品监管部门、医疗机构等制定符合中国实际的“组织库标准”,在材料获取、筛选、处理、保存、供给等各个阶段制定科学的质量管理规范,保障组织材料的安全性和有效性,并对协会会员建立组织库给予帮助,对全国各地组织库进行认证工作。
相信通过监管部门、行业协会和从业单位的多方宣传和努力,中国的组织捐献和移植事业将迎来较快的发展,健康科技事业得以长足进步,为全世界的组织移植事业带来积极影响。
利益冲突所有作者均声明不存在利益冲突

