大花金挖耳培养细胞总黄酮提取工艺及抑菌活性研究
李玉平,龚 宁
1.西北农林科技大学生命科学学院,陕西 杨凌712100
2.青海大学新农村发展研究院,青海 西宁810016
3.西北农林科技大学陕西省生物农药工程技术研究中心,陕西 杨凌712100
4.西北农林科技大学化学与药学院,陕西 杨凌712100
大花金挖耳Carpesium macrocephalumFranch.et Sav.细胞培养物总黄酮提取工艺及其胞内物抑菌活性研究在农业生产和医疗保健中具有重要的意义。大花金挖耳系菊科(Compositae)天名精属多年生草本植物[1]。国内外学者从该植物中分离鉴定得到黄酮类、萜类、香豆素等化合物近百种[2,3],该植物具有抗肿瘤、杀虫等医用功效[3,4],随着植物源农药研究的兴起[5-8],大花金挖耳的抑菌、除草和杀虫等活性[9-11]得到了初步研究。笔者前期研究了大花金挖耳细胞培养黄酮[12]等农药活性物质的培养条件。目前,有关其细胞培养物总黄酮提取工艺及细胞培养物抑菌活性尚无报道。基于超声波辅助提取技术具有提取速度快、不改变生物活性物质、工艺可行等优点[13-15],本文研究了不同干燥方式、溶剂、粉碎度和固液比等因素对大花金挖耳细胞培养物总黄酮提取的影响,进而采用超声波联合摇床振荡提取得到总黄酮的提取工艺,并初步测试了细胞培养物对供试8 种病原真菌的抑菌活性,为大花金挖耳细胞培养抑菌活性物质的提取奠定了基础。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 供试菌种 番茄灰霉病菌(Botrytis cinerea)、番茄早疫病菌(Alternaria solani)、辣椒疫霉病菌(Phytophthora capsici)、南瓜枯萎病菌(Fusarium bulbigenum)、西瓜枯萎病菌(Fusarium oxysporiumf.sp.niveum)、苹果炭疽病菌(Glomerella cingulata)、小麦纹枯病菌(Rhizoctonia cerealis)、烟草赤星病菌(Alternaria longipes)。供试菌种由西北农林科技大学无公害农药研究服务中心提供。
1.1.2 试剂 芦丁标准品(质量分数≥95%,中国药品生物制品检定所);萘乙酸(NAA)、6-苄氨基嘌呤(6-BA)(美国Sigma 公司);B5 和N T 培养基中添加的蔗糖、肌醇、盐酸硫胺素(VB1)、盐酸吡哆醇以及各种无机盐试剂均为分析纯;丙酮、乙醇、氯仿、石油醚均为分析纯。
1.1.3 仪器与设备MCFD5508 型冷冻干燥机(美国SIM 公司);CR22G 高速冷冻离心机(HITACHI);JY92-2D 超声波细胞粉碎机(宁波新芝生物科技股份有限公司);ES-315Tomy High-pressure steam sterilizer(Tomy KOGYO CO.LTD.Nerima Tokyo.Japan);BP-190S 电子天平(Sartorius 公司);PHS-25型酸度计(上海雷磁仪器厂);ZRD-5030 全自动鼓风干燥箱(上海智诚分析仪器制造有限公司);HZT2 双层振荡器(哈尔滨市东联电子技术开发有限公司);UV1102 紫外/可见分光光度计(上海天美科学仪器有限公司)。
1.2 试验方法
1.2.1 悬浮细胞培养方法 大花金挖耳悬浮细胞系[12]培养于NT+1.0 mg/L NAA+0.2 mg/L 6-BA+蔗糖40 g/L 中。培养条件为:pH 5.8(灭菌前)、摇床转速120 r/min、温度25±2℃、光照强度1500~2000 Ix、光照12 h/d,收集培养20 d 的褐化细胞作为供试材料。
1.2.2 大花金挖耳培养细胞的胞内外黄酮含量的比较 在NT+1.0 mg/L NAA 0.2 mg/L 6-BA 液体培养基中(培养条件同上),接鲜重细胞40 g/L 于其中,培养20 d 后,分别收集培养细胞和过滤液,细胞在烘箱中60 ℃烘(12 h)至恒重,滤液经5000 r/min 离心10 min 后,取上清液风干,将烘干的细胞和风干的滤液分别粉碎过60 目筛,丙酮振荡提取四次,每次24 h,合并提取液,减压浓缩,用30%乙醇定容,测定提取液中黄酮含量(mg/mL),计算样品(细胞培养物)中黄酮含量(%)[12]。
1.2.3 干燥方式、溶剂、粉碎度、固液比和提取次数对细胞培养物中总黄酮提取效果的影响 试验设计如下:①收集悬浮培养20 d 的褐化细胞,抽滤后称取鲜重细胞10 份,5 份60 ℃下烘至恒重,另5 份在-40 ℃下真空冷冻(10 Pa 条件下干燥12 h)至恒重,将烘干和冻干的细胞分别粉碎过60 目筛,丙酮振荡提取;②取适量烘干粉碎的细胞,以l:10 固液比(g/mL)分别加入丙酮、乙醇、氯仿、石油醚:丙酮体积比(7.5:1)、石油醚:氯仿体积比(1:1)等5 种溶剂振荡提取;③取适量烘干粉碎的细胞,分别对过20、40、60 目筛的等量样品丙酮振荡提取;④对过60 目筛的粉碎样品,设计固液比(g/mL)分别为1:5、1:10、1:15、1:20,丙酮振荡提取。“①、②”中设计的试验均提取四次,每次24 h,合并提取液,减压浓缩,用30%乙醇定容,测定总黄酮得率,考察干燥方式和溶剂对培养细胞黄酮提取效果的影响;“③、④”中设计的试验分别提取1、2、3、4 次,每次24 h,分别合并提取液,减压浓缩,用30%乙醇定容,测定总黄酮得率,考察粉碎粒度、固液比和提取次数对培养细胞黄酮提取效果(黄酮得率)的影响。黄酮得率(%)=X×V/N×M×10-1,式中X为提取液中总黄酮含量(mg/mL),V为提取液定容体积(mL),N为提取前样品质量(g),M为稀释倍数。
1.2.4 超声波联合摇床振荡提取细胞培养物总黄酮的正交试验 收集悬浮培养20 d 的褐化细胞,烘干粉碎,过60 目筛,分别称取样品12 份,每份10 g,用丙酮做溶剂,固液比1:10,按表1 正交L9(34)试验设计进行提取。先摇床振荡(A 因素)分别提取6、12、18 h,过滤,分别收集滤液,得到第一次提取液;再采用超声波提取滤渣(丙酮做溶剂,固液比1:10),超声时间(B 因素)分别为10、30、60 min,超声功率(C 因素)分别为200、400、600 W,按表1 试验设计第二次提取,得到第二次提取液,分别合并各处理的第1、2 次提取液,减压浓缩,30%乙醇定容,测定总黄酮得率。考察超声波联合摇床振荡提取对大花金挖耳细胞培养物中总黄酮提取效果的影响。

表1 超声波辅助提取正交实验设计Table 1 Orthogonal design of ultrasonic-assisted extraction experiment
1.2.5 验证试验 在以上试验的基础上,收集悬浮培养20 d 的褐化细胞,烘干粉碎过60 目筛,以丙酮做溶剂,固液比1:10,摇床振荡提取3 次,每次24 h,为对照(CK)。超声波(600 W)提取60 min 后,收集第一次提取液,滤渣以摇床振荡提取第二次(丙酮做溶剂,固液比1:10),提取时间设为:6、12、18、24 h,验证超声波联合摇床振荡提取细胞培养物总黄酮的正交试验结果。
1.2.6 大花金挖耳细胞培养物抑制菌丝生长试验 收集悬浮培养20 d 的褐化细胞,烘干粉碎过60 目筛,乙醇提取,减压浓缩成浸膏,取适量丙酮溶解(超声波促溶),定容至50 mg/mL。采用菌丝生长速率法[16]测定供试药液对供试病原菌菌丝生长的抑制作用,用丙酮处理作对照。用十字交叉法测量供试真菌菌落生长直径,取其平均值。根据公式(1)和(2)计算菌丝生长抑制率:

1.3 数据分析
以上试验重复3 次,使用DPS 数据处理系统进行毒力回归方程计算,并对总黄酮含量等所得试验数据进行单因素方差邓肯式分析(P=0.05)。
2 结果与分析
2.1 大花金挖耳培养细胞胞内外黄酮含量变化
从图1 可以看出,大花金挖耳悬浮培养细胞内的黄酮含量为1.22%、发酵液黄酮含量为0.13%,胞内黄酮含量显著高于胞外(发酵液),胞内黄酮含量是胞外的21.22 倍(P<0.05)。

图1 胞内外黄酮含量比较Fig.1 Comparison of extracellular and intracellular flavonoids content
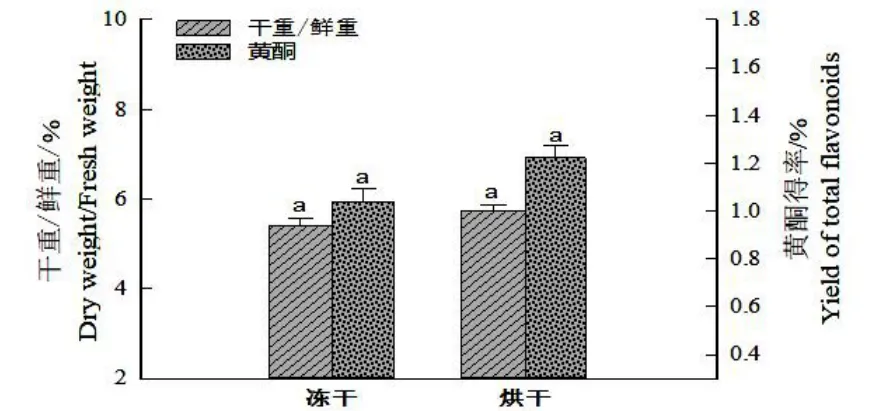
图2 不同干燥方法对干鲜重比和细胞培养物总黄酮的提取效果Fig.2 Effects of different drying methods on rate of DW/FW and extracting total flavonoids from cultural materials
2.2 干燥方式对培养细胞黄酮提取的影响
如图2 所示,真空冷冻和烘干方法对大花金挖耳悬浮培养细胞的干重/鲜重比分别5.41%、5.75%;真空冷冻和烘干方法对细胞总黄酮的得率分别达到1.04%、1.22%,烘干较冻干所得的干重/鲜重比及总黄酮得率稍高,但均不显著(P<0.05)。
2.3 不同溶剂对培养细胞黄酮提取的影响
图3 表明,丙酮(I)、无水乙醇(Ⅱ)、氯仿(Ⅲ)、石油醚:丙酮(Ⅳ)、石油醚:氯仿(V)等5 种不同溶剂对悬浮培养细胞总黄酮的提取效果显著不同。以无水乙醇、丙酮提取效果最为显著,细胞总黄酮得率为1.22%,是其他溶剂提取细胞培养物得率的1.59~2.01 倍(P<0.05)。
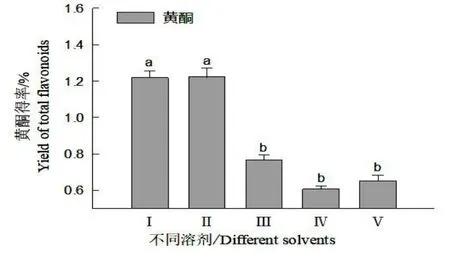
图3 不同溶剂对细胞培养物总黄酮的提取效果Fig.3 Effects of different solvents on extraction of total flavonoids from cultural materials

图4 样品粒度对细胞培养物总黄酮的提取效果Fig.4 Effects of sample powder size on extraction of total flavonoids from cultural materials
2.4 粉碎粒度对培养细胞黄酮提取的影响
由图4 可知,在摇床振荡提取次数一定的条件下,随样品粉碎度的增加,培养物总黄酮的得率逐渐增大,与没有粉碎的细胞培养物相比,过20~60 目的细胞培养物的总黄酮得率高;在样品粉碎粒度一定的情况下,随摇床振荡总提取次数的增加,黄酮得率逐渐增加,摇床振荡提取3~4 次、样品粒度40~60 目时对培养物黄酮提取较为适宜。

图5 固液比对细胞培养物总黄酮的提取效果Fig.5 Effects of solid-to-liquid ratio on extraction of total flavonoids from cultural materials
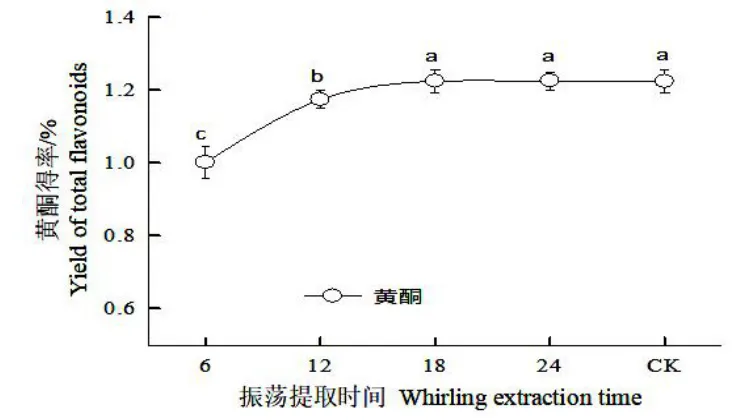
图6 超声波联合振荡对细胞培养物总黄酮的提取效果Fig.6 Effects of ultrasonic combined whirling on extraction of total flavonoids from cultural materials
2.5 固液比对培养细胞黄酮提取的影响
由图5 可知,在摇床振荡提取次数一定的条件下,随固液比从1:5 到1:20 的递变,培养物总黄酮得率逐渐增大,1:10、1:15、1:20 固液比对细胞培养物的得率比较接近;在样品固液比一定的情况下,随摇床振荡总提取次数的增加,黄酮得率不断增加,当固液比1:10~1:15,摇床振荡提取3~4 次,黄酮得率增加到最高值1.22%。
2.6 超声波联合振荡提取对细胞培养物总黄酮提取的正交试验效果

表2 试验方案及分析结果Table 2 The plan and results of the test
表2、3 表明:摇床振荡提取时间、超声提取时间和超声波功率都对大花金挖耳细胞培养物中总黄酮的提取产生了显著的影响。正交试验发现摇床振荡时间(A)、超声波提取时间(B)和超声波功率(C)三因素对细胞培养物提取效果有明显差异,依次为A>B>C,最佳组合是A3B3C3,即摇床振荡提取18 h 后,滤渣在超声波功率600 W 时,再超声提取60 min,效果最好。

表3 方差分析表Table 3 The table of variance analysis
2.7 超声波联合摇床振荡提取细胞黄酮正交试验的验证
从“2.6”可知,正交试验的最佳组合并未出现在正交试验组中,需要进行验证,验证试验(图6)表明,超声波(600 W、60 min)提取后的滤渣再经摇床振荡提取,合并超声波提取液和摇床振荡提取液,检测发现,随摇床振荡提取时间的延长,总黄酮得率显著增大,摇床提取18~24 h 时,总黄酮得率最高达1.22%,并保持稳定,与对照达到同样效果。可见超声提取(功率600 W、60 min)1次后,再摇床振荡提取(18 h)1 次,即可完成胞内黄酮的提取。
2.8 大花金挖耳细胞培养物对8 种病原真菌的抑菌效果
表4 可见,大花金挖耳悬浮培养细胞的乙醇提取物对供试8 种供试病原菌生长均有不同程度的抑制作用,但对不同病原菌抑制效果存在较大差别。在药液浓度50 mg/mL 时,抑制率达到50%以上的供试病原菌有辣椒疫霉病菌、苹果炭疽病菌和小麦纹枯病菌等3 种病原真菌。
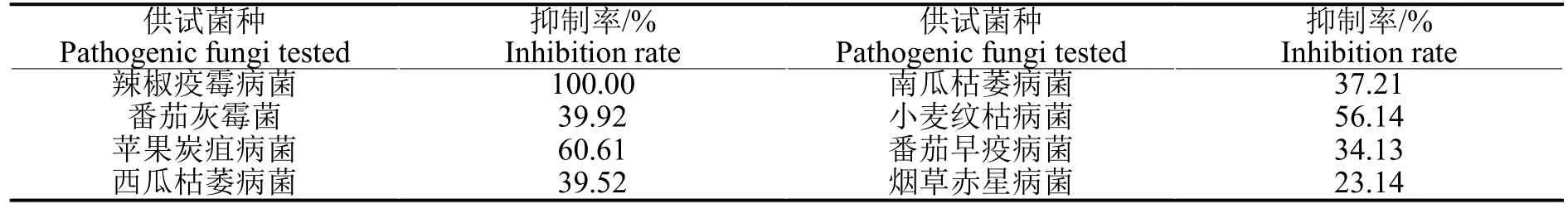
表4 大花金挖耳细胞提取物对8 种病原菌菌丝生长的抑制作用(3 d)Table 4 Inhibition rate of ethanol extracts from C.macrocephalum cell cultures against fungal mycelial growth of eight pathogenic fungi(3 d)
3 讨论
植物中黄酮类化合物的合成主要在细胞质中合成,在不同的膜系统间进行转运,并最后贮存于液泡中[17]。本研究通过对培养细胞及其培养液(发酵液)黄酮含量的检测,发现大花金挖耳细胞生物合成的黄酮主要集中在细胞中,培养液中只有微量黄酮,可能与培养细胞后期衰亡破碎有关,造成少量黄酮类化合物进入培养液。
研究表明高温条件下长时间干燥处理会使黄酮含量减少,但短时间的高温处理对黄酮含量影响较小[18]。本研究采取-40 ℃真空冷冻和60 ℃烘干两种方法对收集的褐化细胞进行处理,发现烘干较真空冷冻干燥对细胞总黄酮的得率及干重/鲜重比有不显著的提高。这与烘干所用的温度高、干燥快,能有效抑制相关酶的活性,减少其作用时间,使得总黄酮得率较冻干处理的高有关,这与郭泽美等[18]干燥处理葡萄皮及赵宇慧等[19]干燥处理枸杞粉的结果相似。
研究中发现丙酮、无水乙醇、氯仿、石油醚:丙酮、石油醚:氯仿等5 种不同溶剂对培养细胞总黄酮的得率不同。以无水乙醇、丙酮提取效果最为显著,本试验后期选择了提取培养物活性物质时,提出杂质较少的丙酮作为溶剂。另外,本试验发现,当固液比大到一定程度时,有效成分已经基本释出完全,再增大固液比,杂质增加,浓缩工作量加大,造成回收溶剂的浪费,因此固液比应控制在1:10~1:15 左右。
传统的振荡提取方法[20]是通过振荡的方式使萃取剂与被提取的物质反复接触,最终被萃取物溶解到萃取剂中,再进行纯化和浓缩处理,获得目标物。振荡提取步骤较简单,成本低,缺点是耗时。超声波提取[21]可以破坏植物细胞壁,加速有效成分的溶解和提取,具有提取均匀、时间短、简单易行等优点,不过高频超声波长时间提取也可能破坏物质结构,杂质相对较多。本研究采用摇床振荡联合超声波提取大花金挖耳细胞培养物活性成分,方法简单,成本低,耗时短,溶剂用量少,该提取工艺为具有抗炎、抗氧化、抗癌、杀菌等广泛活性作用的黄酮提取提供了新的选择。
菊科植物的黄酮类、内酯类、萜类等化合物均有抑菌活性[22,23]。本研究中大花金挖耳悬浮培养细胞的粗提物对供试的8 种病原菌表现出了不同的抑菌作用,当供试药液浓度为50 mg/mL 时,供试病原菌菌丝生长抑制率达到50%以上的有辣椒疫霉病菌、苹果炭疽病菌和小麦纹枯病菌等3 种病原菌,这说明:供试菌种菌丝生长抑制率与大花金挖耳细胞培养物中生物合成的黄酮等活性物质密切有关,且供试菌种对药液的敏感性不同。其中辣椒疫霉病菌属于鞭毛菌亚门的卵菌,其他分属于子囊菌亚门、担子菌亚门和半知菌亚门的真菌[24],鉴于植物病害中最多的是真菌病害,且近3 万种之多[25],下一步研究需以辣椒疫霉病菌、苹果炭疽病菌和小麦纹枯病菌等作为细胞培养活性物质分离纯化的活性追踪菌种,进一步分离纯化大花金挖耳细胞培养物活性物质,探明其抑菌机理,为大规模细胞培养抑菌活性物质奠定了基础。
4 结论
大花金挖耳悬浮细胞生物合成的黄酮类化合物主要集中胞内。在室温下,细胞悬浮培养活性物质的最佳提取条件是:以丙酮为溶剂、样品粒度40~60 目、固液比1:10~1:15(g/mL),超声辅助提取(功率600 W、60 min)1 次后,再接摇床振荡提取(18 h)1 次,总黄酮得率可达1.22%,该方法操作简单、节省溶剂、环保、耗时短。大花金挖耳细胞培养物具有抑菌活性,本研究为大花金挖耳细胞培养抑菌活性物质的提取分离提供了实验数据。

