山西省仔猪黄白痢大肠杆菌耐药性研究
冯晓东 刘风波 连亮亮


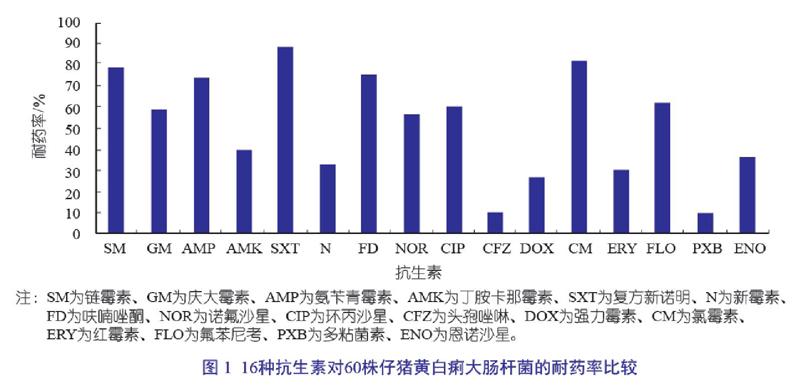
摘 要:采用Kirby-Bauer法,以分离自山西省10家规模化猪场的60株仔猪黄白痢大肠杆菌分离株为材料,开展对兽医临床上常用的16种抗生素的耐药性监测。结果表明,60株病原性大肠杆菌分离株对抗生素已普遍具有耐药性,其中对复方新诺明(88.3%)、氯霉素(81.7%)、链霉素(78.3%)、呋喃唑酮(75.0%)和氨苄青霉素(73.3%)等的耐药性很强,对环丙沙星及诺氟沙星的耐药性也较高,其耐药率分别为60.0%和56.7%。
关键词:仔猪黄白痢;大肠杆菌;耐药率;药敏试验
中图分类号:S852.61 文献标志码:A 文章编号:1001-0769(2021)06-0026-05
仔猪黄白痢为新生仔猪常见的大肠杆菌病,会严重危害养猪生产,并会造成巨大的经济损失。对于本病的防治,猪场除了加强饲养管理和卫生消毒措施,以及用自家流行菌株免疫母猪,唯有多选用敏感药物进行治疗;然而,大肠杆菌具有众多的血清型,各地流行菌株的血清型各不相同。随着抗生素的大量使用,大肠杆菌的耐药性菌株也不断出现。为了摸清山西省各地仔猪黄白痢流行病原菌株,指导猪场临床用药,本研究对省内各地猪场的新生仔猪黄白痢病例进行了病原分离、鉴定和耐药性监测。
1 试验材料与方法
1.1 试验材料
1.1.1 病料
因发生仔猪黄白痢,山西省10家规模化猪场仔猪病死60例,在仔猪死后24 h内,采集病变的组织或器官样本,采集过程中要尽可能避免样本被污染。
1.1.2 质控菌株
大肠埃希菌ATCC25922购于中国兽药监察所。
1.1.3 主要仪器设备
试验所用仪器设备有比浊管、试管、培养皿、接种环、酒精灯、恒温培养箱、冰箱、打孔器、真空抽气机、干燥器、测量尺、电子天平、超净工作台。
1.1.4 标准比浊管的制备
取10支比浊管,给第1支比浊管装入0.048 mol/L(即浓度为1.175%)氯化钡 0.5 mL,加0.18 mol/L(即浓度为1%)硫酸溶液99.5 mL,充分搅匀,随后的9支浊管依次类推,浓度逐渐升高。选管径与接种菌液相同的试管,每支分装10 mL,密闭,在室温下置于暗处保存,其浊度为0.5麦氏比混标准(Mcfarland standard),相当于108 CFU/mL的含菌量。使用前应充分摇匀[1]。
1.1.5 接种菌液的制备
称取营养琼脂4.5 g溶于100 mL蒸馏水中,加热溶解,然后放入高压锅高压灭菌 20 min。待冷却至50 ℃~60 ℃之后取出,在超净工作台内将溶液倾倒入经过灭菌的平皿中,待其冷却凝固后取病料接种菌种。接种完毕后置于37 ℃恒温箱中培养24 h备用。
用灭菌的接种环挑取琼脂平板上形态相同的4~5个菌落,接种于3 mL~5 mL水解酪蛋白(mueller-hinton,M-H)肉汤中,在35 ℃下培养6 h,随后用灭菌生理盐水稀释培养液,使其浓度相当于标准比浊管[2]。
1.1.6 培养基的制备
制备普通营养肉汤、普通营养琼脂、葡萄糖蛋白胨、M-H培养基(K-B试验专用)琼脂。
1.1.7试验药物
氨苄青霉素(ampcillin,Amp)、氯霉素(chloramphenicol,CM)、红霉素(eryhromyci,Ery)、庆大霉素(gentamicin,GM)、丁胺卡那霉素(amikacin,Amk)、链霉素(gtreptomyces,SM)、复方新诺明(gulfamethoxazole,Sxt)、新霉素(neomin,N)、呋喃唑酮(furazolidone,Fd)、諾氟沙星(norfloxacin,Nor)、环丙沙星(ciprofloxacin,CIP)、头孢唑啉(cefazolin,Cfz)、强力霉素(doxcycline,Dox)、氟苯尼考(florfenicol,FLO)、多粘菌素(polymyxin,PXB)和恩诺沙星(enoxacin,ENO)共16种药物纯粉。
1.1.8药敏纸片的制备
制备好的干燥药敏纸片分装在密封小瓶内,放在干燥器中低温保存备用。
1.2 试验方法
1.2.1病原菌的分离培养
挑选单个菌落,经染色镜检证明不含杂菌,此时用接种环挑选单个菌落,移植于各种琼脂斜面培养,所得的培养物即为纯培养物,培养后胶塞密封,置-4O ℃冰箱中保存备用。
1.2.2 镜检
将待检菌株做成菌液涂片,用革兰染色法染色,选取在显微镜视野中显示为红色或粉红色的两端钝圆、两端浓染的中等大小的革兰阴性杆菌菌株进行生化鉴定。
1.2.3 菌株的生化鉴定
按常规方法进行三糖铁试验、吲哚试验、甲基红验、二乙酰试验、糖发酵试验、柠檬酸盐利用试验。
1.2.4 致病性试验
取120只体重18 g~22 g的健康小白鼠。挑取普通琼脂斜面上纯培养的菌落,接种于营养肉汤培养基中。随机选取60只小白鼠作为试验组,腹腔注射肉汤培养物0.1 mL/只;剩下的60只小白鼠作为对照组,腹腔注射肉汤0.1 mL/只,24 h~48 h内观察小鼠的死亡情况,取死亡或发病的小白鼠肝脏抹片,革兰染色、镜检,并取病料接种于麦康凯琼脂观察结果。
1.3 药敏试验
本药敏试验采用纸片琼脂扩散法。
2 试验结果
2.1 分离培养
在普通琼脂平皿板上长出表面光滑、湿润、半透明、灰白色、圆形微凸起、中等大的菌落,直径2 mm~3 mm。在血液琼脂平板上长出菌落较大、边缘整齐并有隆起的灰白色菌落,多数不溶血。在麦康凯琼脂平板上生长出圆形、光滑、隆起、大小均一的红色菌落(中央颜色稍深);普通肉汤呈均匀一致混浊状。
2.2 细菌形态学观察
病死仔猪的组织培养物涂片染色镜检,均可见两端钝圆,多数散在排列,偶尔有2~3个连在一起的革兰阴性短杆菌。
2.3 动物致病力试验结果
在试验组60只小白鼠中,42只在24 h内死亡,16只在30 h死亡,另外2只发病;对照组小白鼠不发病。发病及死亡小白鼠的心血抹片经革兰染色镜检为革兰阴性中等小杆菌,将该心血接种于麦康凯琼脂培养基上均为红色菌落。
2.4 生化鉴定结果
60株菌均能在三糖铁培养基上产酸产气,使培养基变黄,均不产生硫化氢,均能发酵葡萄糖、乳糖、麦芽糖、甘露醇。甲基红(methyl red,M-R)试验、吲哚试验为阳性。均不能利用柠檬酸盐,伏-波试验(voges-proskauer,V-P)试验阴性。根据生化特性,表明分离的菌为大肠杆菌(表1)。
2.5 药敏试验结果
2.5.1 60株仔猪黄白痢大肠杆菌分离株对16种抗生素的耐药情况
仔猪黄白痢大肠杆菌产生耐药性严重的抗生素依次为SXT、CM、SM、FD、AMP、FLO、CIP、GM、NOR、AMK、ENO、N、ERY、DOX、CFZ、PXB,其中耐药率大于或等于50%的 9种抗生素,分别为SXT、CM、SM、FD、AMP、FLO、CIP、GM和NO;耐药率小于30%的抗生素有3种,分别为DOX、CFZ、PXB;结果见表2和图1。
2.5.2 60株仔猪黄白痢大肠杆菌分离株对16种抗生素的多重耐药情况
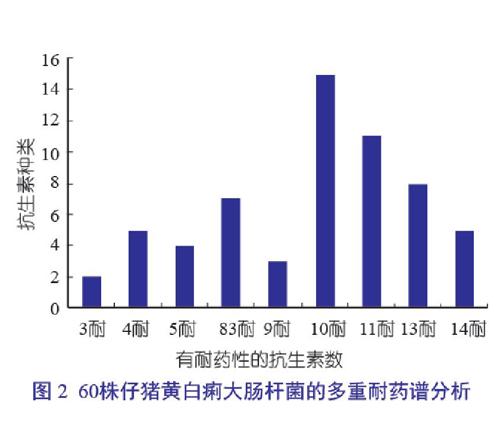
在60株仔猪黄白痢大肠杆菌分离株中,没有不耐药和仅耐1种、2种抗生素的分离菌株,对3种、4种、5种、8种、9种、10种、11种、13种和14种抗生素有耐药性的大肠杆菌分离株分别为2株、5株、4株、7株、3株、15株、11株、8株和5株,结果见图2。
2.5.3 60株仔猪黄白痢大肠杆菌分离株的耐药谱
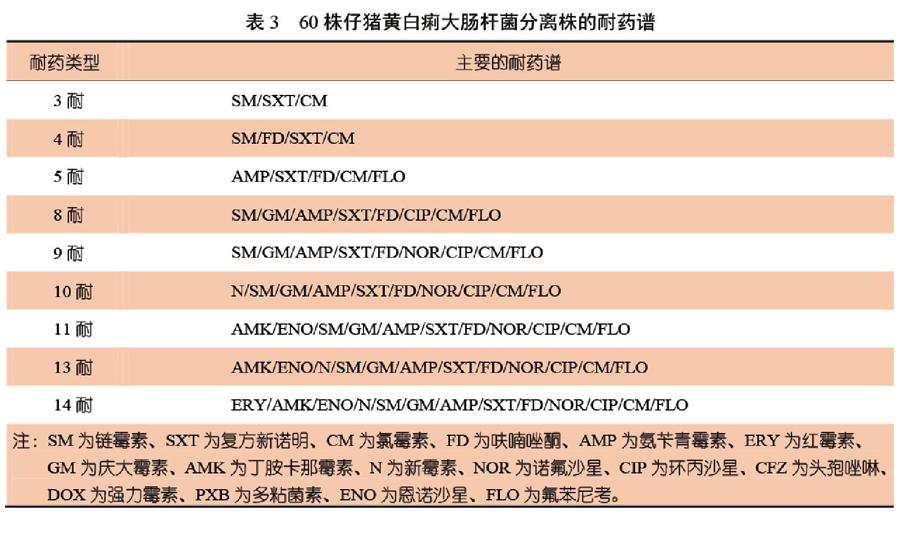
60株仔猪黄白痢大肠杆菌分离株有45种耐药谱。4株分离株的耐药谱完全相同,大多数分离株都具有不同的耐药谱。主要的耐药谱见表3。
3 分析与讨论
3.1 60株仔猪黄白痢大肠杆菌分离株药敏试验及耐药谱分析
采用Kirby-Bauer法,60株仔猪黄白痢大肠杆菌分离株的药敏试验结果(图1)表明,在16种抗生素中,抑菌作用最强的是兽医临床上尚未使用或应用较少的头孢唑啉和多粘菌素,敏感菌株分别占90.0%(54/60)、90.0%(54/60);其次为强力霉素、红霉素、新霉素和恩诺沙星,敏感菌株分别占73.3%(44/60)、70.0%(42/60)、68.3%(41/60)和63.3%(38/60);而复方新诺明、氯霉素、链霉素、呋喃唑酮和氨苄青霉素等药物则表现出很高的耐药性,耐药率分别为88.3%、81.7%、78.3%、75.0%和73.3%;环丙沙星及诺氟沙星的耐药率也很高,分别为60.0%和56.7%。这与国内外有关文献大体吻合。马红霞等报道,大肠杆菌对氧氟沙星、诺氟沙星、环丙沙星、氯霉素、庆大霉素、卡那霉素、呋喃妥因同时耐药的菌株已达半数;RolandLanz等報道猪(腹泻、水肿病)大肠杆菌分离株对庆大霉素、链霉素、壮观霉素、四环素、呋喃妥因的耐药性多见,对恩诺沙星的耐药率较高。
3.2关于抗菌药物的使用方法
抗菌药物的选择应考虑采取联合用药、交叉用药、轮换用药的方式,一方面可以充分发挥抗菌药物之间的协同作用,增加疗效:另一方面可以避免细菌长期与某一种药物接触,增加耐药性的产生概率。
建议停用已普遍产生耐药性和临床上已明显无效的药物,选用目前应用较少和经药敏试验证明对仔猪黄白痢大肠杆菌敏感的先锋霉素、多粘菌素、壮观霉素等药物。敏感药物的选择空间十分狭小,而研发新药又需要大量的人力、物力和财力,并且还有研制周期长、风险大等问题[3],因此,开展联合应用抗菌药物的研究,充分发挥抗菌药物之间的协同作用,显得十分必要和迫切。
4 结论
随着抗生素在养猪生产中不断使用,耐药性菌株不断涌现,且出现的菌株多为对多种甚至是14种抗生素有耐药性,这些结果与杜银中、朱力军及马红霞等报道的基本一致。如果在生产中仍不加控制地使用抗生素,随着时间的推移,大肠杆菌的耐药率必将大幅度上升,多重耐药菌株将迅增,耐药谱增宽[4],猪病的防治将面临严峻的挑战。因此,广大养猪生产者应严格遵守禁抗令,给动物生产营造一个科学的用药环境。
参考文献
[1] 熊焰,李德生,张和民,等. 大肠杆菌的药敏试验[J]. 中国兽医科技,1999,29(3):35-36.
[2] 石岩,梅世昌. 医学动物实验实用手册[M]. 北京:中国农业出版社,2002.
[3] 王秀茹. 预防医学微生物及检验技术(第二版)[M]. 北京:人民卫生出版社,2002.
[4] 任家琰,马海利. 动物病原微生物学[M]. 北京:中国农业科技出版社,2001.

