高效液相色谱法测定猪排泄物中帕托珠利
聂晶晶,王文湘,华成云,梁立杰,黄显会
(华南农业大学 兽医学院/广东省兽药研制与安全评价重点实验室,广东 广州 510642)
猪球虫病多发于7~14日龄的仔猪,主要是由猪艾美耳球虫Eimeria和猪等孢球虫Isosparasuis感染引起[1]。目前防治猪球虫病的药物不多,包括地克珠利和妥曲珠利等三嗪类广谱抗球虫药物。帕托珠利(Ponazuril)为妥曲珠利的主要代谢物[2],同时是妥曲珠利在动物体内发挥药效的重要活性成分,在球虫的各个发育阶段都具有良好的驱虫效果,且在安全性和疗效等方面均优于妥曲珠利[3],但尚未被批准用于食品动物球虫病的防治,是研发中的新兽药。帕托珠利安全、低毒、高效抗虫的特点[4]使其应用于防治食品动物球虫病的前景广阔,未来有望成为新一代的猪球虫病防治药物。
欧盟的相关报告[5-6]指出,妥曲珠利及其主要代谢物帕托珠利在猪、大鼠等动物体内主要通过粪便排出体外。针对帕托珠利检测方法和应用高效液相色谱(HPLC)技术检测猪排泄物中帕托珠利的研究相对较少。目前,测定帕托珠利的方法主要有HPLC法和液相色谱−串联质谱(Liquid chromatographytandem mass spectrometry,LC-MS/MS)法 2 种[7-8]。有报道用HPLC法检测猪血浆中的帕托珠利[9],但猪血浆与猪排泄物的基质差异较大,同样的提取方法满足不了猪排泄物中帕托珠利的检测要求。本研究通过对样品前处理方法及HPLC分析条件的优化,建立了一种简单、灵敏、重复性好的测定猪排泄物中帕托珠利的方法,并对其进行了方法学评价,以期为后续研究帕托珠利在仔猪体内的排出提供资料。
1 材料与方法
1.1 仪器与试剂
DGU-20A5R高效液相色谱仪(日本岛津公司),Multifuge X1R 高速冷冻型离心机 (美国Thermo公司),AG204电子分析天平(瑞士Mettler Toledo公司),TWD-12水浴氮吹仪(杭州奥盛仪器有限公司)。
帕托珠利原料药:w为100.5%,批号180501A,湖北龙翔药业科技股份有限公司;帕托珠利混悬液:ρ为 50 g/L,批号 20 180 501,湖北龙翔药业科技股份有限公司;Waters Oasis 亲水−亲油平衡(Hydrophile-lipophile balance,HLB)固相萃取柱:60 mg/3 mL,美国 Waters公司;乙腈、甲醇均为色谱纯;冰乙酸、二氯甲烷、磷酸二氢钾等均为国产分析纯。
1.2 主要溶液配制
帕托珠利标准储备液 (1 000 μg/mL):精密称取帕托珠利的原料药50.00 mg,置于50 mL棕色容量瓶中,用甲醇溶解并定容至刻度线,摇匀即得,4 ℃条件下避光保存。
帕托珠利标准工作液:准确吸取0.10 mL帕托珠利标准储备溶液,依次用甲醇稀释成质量浓度为0.2、0.5、1.0、2.0、2.5、5.0、10.0、20.0、25.0、50.0、100.0、200.0、250.0、500.0 μg/mL 的帕托珠利系列标准工作液,现配现用。
0.005 mol/L磷酸二氢钾溶液:准确称取0.68 g磷酸二氢钾,用超纯水溶解并定容至1 000 mL,调pH 至 5.00±0.05,过 0.22 μm 的水系滤膜后,超声待用。
1.3 色谱条件
色谱柱:Kinetex EVO C18(250 mm×4.6 mm,5 μm);流动相:A 相为 0.005 mol/L 磷酸二氢钾溶液(pH为5.00±0.05),B相为乙腈,尿液与粪便样品采取不同的流动相比例,分别为V(A)∶V(B)=55∶45 和V(A)∶V(B)=56∶44;流速:1 mL/min;定量检测波长:255 nm;柱温:35 ℃;进样量:30 μL。
1.4 猪排泄物的釆集及测定
1.4.1 试验动物和样品采集 3头健康的鲁莱纯系仔猪置于代谢笼内单独饲养,2周龄左右,平均体质量为(2.83±0.32) kg。试验开始前观察动物饮食、行为和体态特征等,临床表现为健康。
3头健康仔猪根据体质量给药,按20 mg/kg剂量灌服50 g/L帕托珠利混悬液,分别在给药前和给药后 0.5、1.0、1.5、2.5 和 3.5 d 通过代谢笼收集猪粪便和尿液,往后每隔24 h采样1次,采至给药后第50.5 天,记录每次采样的粪便质量及尿液体积,取部分于−20 ℃冰箱保存,待测。给药前收集的空白样品用于帕托珠利检测的方法学研究。
1.4.2 尿液样品的前处理 准确移取 1 mL 尿液样品置于 15 mL 离心管中,加入 2 mL 0.2%(φ)乙酸酸化乙腈,涡旋混匀 3 min,离心 10 min(10 000 r/min、4 ℃);收集上清液并加入 5 mL 二氯甲烷,涡旋混匀 3 min,离心 10 min(7 000 r/min、4 ℃);取下层液体于45 ℃条件下用氮气吹干,以1 mL甲醇−水(1∶1,V/V)复溶,过 0.22 μm 滤膜,供 HPLC 测定。
1.4.3 粪便样品的前处理 准确称取 1 g 粪便样品置于 50 mL 离心管中,加入 10 mL 乙腈涡旋 3 min,以 300 r/min 振荡 20 min,离心 15 min(10 000 r/min、4 ℃);移取上清液 2 mL 并加 7 mL 水,备用。HLB固相萃取柱预先依次用3 mL甲醇和3 mL水活化后,取备用液上柱,用3 mL水和3 mL乙腈−水 (3∶7,V/V)淋洗后,用 3 mL 乙腈洗脱;收集洗脱液于45 ℃条件下用氮气吹干,以1 mL甲醇−水(1∶1,V/V)复溶,过 0.22 μm 滤膜,供 HPLC 测定。
1.5 定量方法的确立
1.5.1 方法的特异性、检测限和定量限 取不同猪只的空白尿液和空白粪便样品,分别按“1.4.2”和“1.4.3”方法处理并按“1.3”色谱条件进行测定,比较空白尿液及空白粪便样品中的内源性化合物对目标药物帕托珠利的检测是否存在干扰。
采用空白尿液及空白粪便样品添加低浓度标准溶液,分别按“1.4.2”和“1.4.3”方法处理后,按“1.3”色谱条件进行检测,以信噪比≥3确定检测限 (Limit of detection),以信噪比≥10 确定定量限 (Limit of quantification)。
1.5.2 标准曲线的建立 取 0.9 mL 空白尿液和1 g 空白粪便各 6 份,分别置于 15 mL 和 50 mL 离心管中,依次加入100 μL帕托珠利系列标准工作液,使得尿液样品中帕托珠利的质量浓度分别为0.05、0.10、0.20、1.00、2.00、5.00 μg/mL;粪便样品中帕托珠利的质量分数分别为0.25、2.50、5.00、25.00、50.00、100.00 μg/g。分别按照“1.4.2”和“1.4.3”方法处理并按“1.3”色谱条件进行测定,以测得的帕托珠利色谱峰面积(A)为横坐标、药物浓度(C)为纵坐标,绘制标准曲线,求得线性回归方程和决定系数(R2)。
1.5.3 回收率与精密度 采用相应基质标准溶液单点校正法计算回收率,在尿液和粪便里分别制得低、中、高3个水平的添加样品,分别按照“1.4.2”和“1.4.3”方法处理并按“1.3”色谱条件进行加标回收试验,做准确度分析。连续制备和考察3个不同分析批次,以相对标准偏差(Relative standard deviation,RSD)评价方法的批内与批间精密度。尿液及粪便样品的回收率与精密度试验添加剂量及配制方法如下:取0.9 mL空白尿液和1 g空白粪便,分别加入100 μL不同质量浓度的帕托珠利标准工作液(0.5、10.0、50.0 μg/mL)和(2.5、250.0、1 000.0 μg/mL),分别制得低(0.05 μg/mL)、中(1.00 μg/mL)和高(5.00 μg/mL)3 个水平的尿液添加样品和低(0.25 μg/g)、中(25.00 μg/g)和高(100.00 μg/g)3 个水平的粪便添加样品。
1.5.4 冷冻放置稳定性试验 参照“1.5.3”尿液及粪便样品的回收率与精密度试验添加剂量及配制方法,分别制得低 (0.05 μg/mL)、中 (1.00 μg/mL)和高(5.00 μg/mL)3个质量浓度水平的尿液添加样品和低 (0.25 μg/g)、中 (25.00 μg/g)和高(100.00 μg/g)3个质量分数水平的粪便添加样品。每个处理设15个平行样品,置于−20 ℃条件下,分别于0、30、60 d后分3次取样,每个处理每次取5个平行样品,分别按照“1.4.2”和“1.4.3”方法处理,按“1.3”色谱条件进行测定,考察在−20 ℃保存条件下尿液和粪便样品中帕托珠利的稳定性。
1.5.5 实际样品测定 为评估本研究方法的适用性,利用本研究方法检测了3头仔猪内服帕托珠利后各个时间段的粪便和尿液样品中帕托珠利的平均排出量。在给药后的 0~50.5 d,1.5 d 前每隔 0.5 d,1.5 d后每隔1 d收集1次3头仔猪的粪便和尿液样品,检测帕托珠利在各个时间段样品中的含量。根据各时间段粪便和尿液的总质量及总体积求出各个时间段粪便和尿液中帕托珠利的平均排出量。平均排出量用平均值±标准差表示。
2 结果与分析
2.1 方法的特异性、检测限和定量限
2.1.1 特异性 在优化的色谱条件下,色谱峰形较佳,分离完全,色谱图中目标化合物的保留时间处无杂质干扰(图1),表明该方法的特异性较好。如图1所示,粪便和尿液样品中帕托珠利的保留时间分别为 12.367 和 11.441 min。
2.1.2 检测限和定量限 尿液样品中帕托珠利的检测限为 0.02 μg/mL,定量限为 0.05 μg/mL;粪便样品中帕托珠利的检测限为0.10 μg/g,定量限为0.25 μg/g。
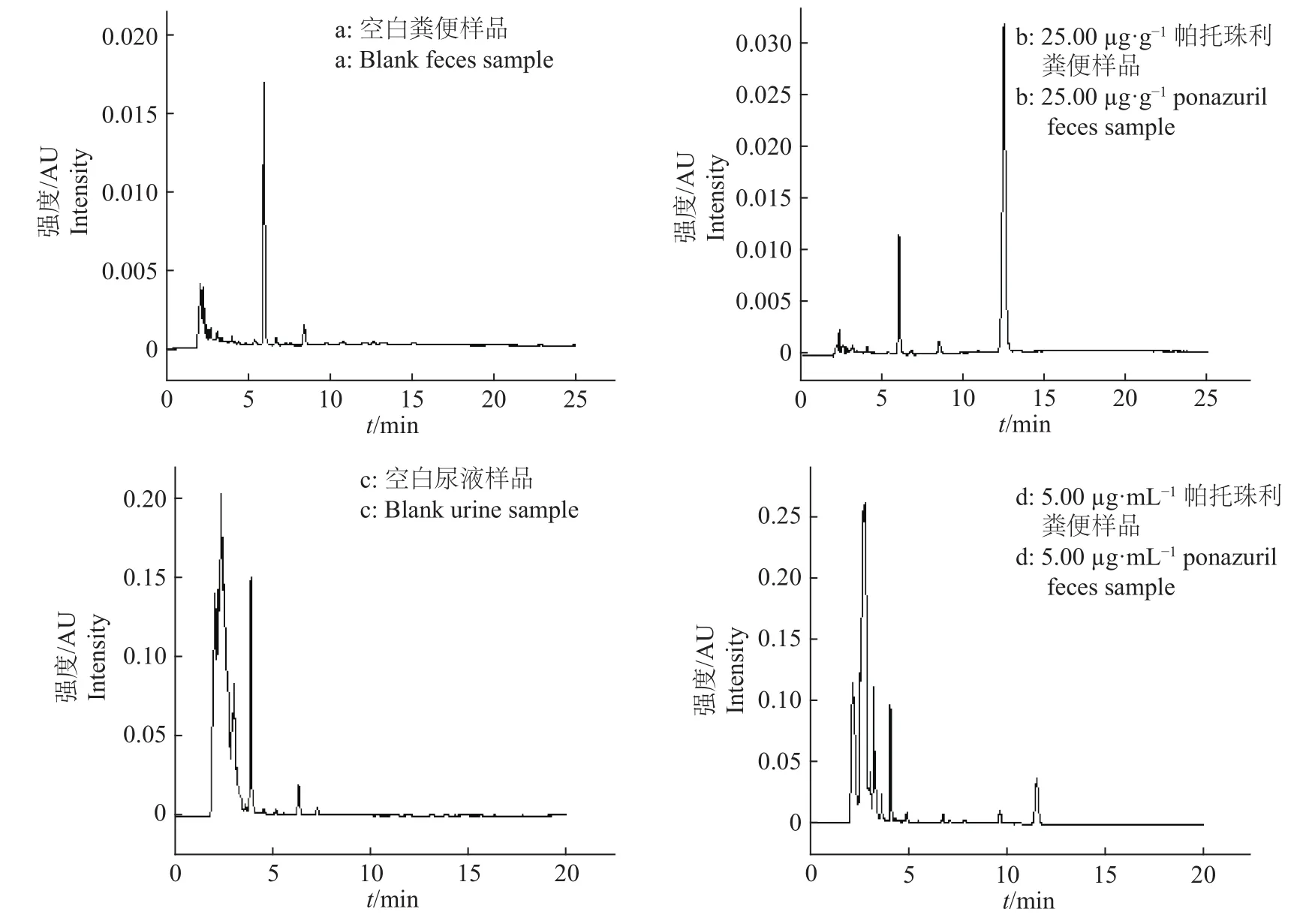
图 1 不同样品的高效液相色谱图Fig.1 High performance liquid chromatograms of different samples
2.2 标准曲线
尿液样品中帕托珠利在0.05~5.00 μg/mL范围内线性关系良好,线性回归方程为C=1.284 3×10−5A−0.005 4,R2为 0.999 8;粪便样品中帕托珠利在0.25~100.00 μg/g范围内线性关系良好,线性回归方程为C=1.288 9×10−5A−0.023 1,R2为 0.999 5。
2.3 回收率与精密度
帕托珠利在尿液和粪便样品中的添加回收率及RSD见表1和表2。由表1可见,帕托珠利在尿液低 (0.05 μg/mL)、中 (1.00 μg/mL)和高(5.00 μg/mL)质量浓度样品中的平均回收率分别为 93.49%~97.56%、98.26%~98.78%和97.43%~99.16%,批内和批间的RSD均低于8%。由表2可见,帕托珠利在粪便低(0.25 μg/g)、中(25.00 μg/g)和高 (100.00 μg/g)质量分数样品中的平均回收率分别为89.55%~95.88%、91.95%~94.00%和93.87%~95.24%,批内和批间的RSD均低于4%。说明该方法重复性较好,通用性较强,可满足猪尿液及粪便样品中帕托珠利含量检测的要求。
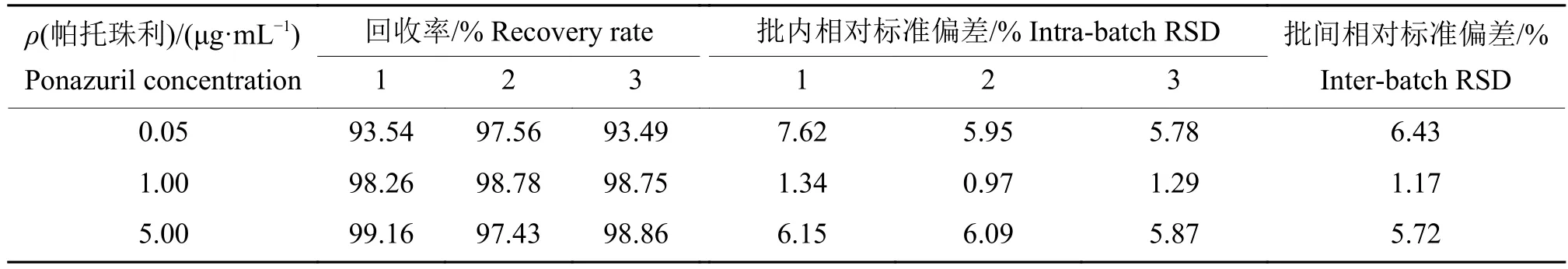
表 1 帕托珠利在尿液中的回收率与相对标准偏差(RSD)Table 1 Recovery rates and relative standard deviations (RSDs) of ponazuril in urine sample n = 3
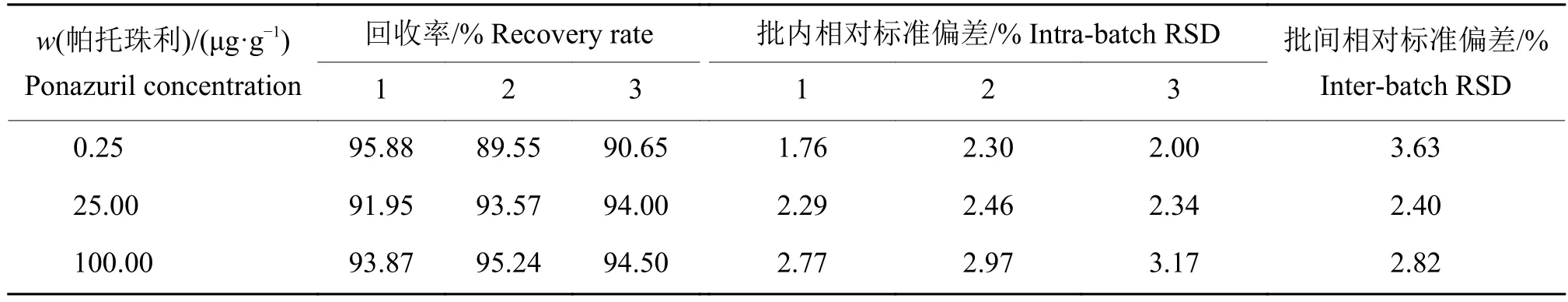
表 2 帕托珠利在粪便样品中的回收率与相对标准偏差Table 2 Recovery rates and relative standard deviations (RSDs) of ponazuril in feces samples n = 3
2.4 冷冻放置稳定性试验
表3和表4的结果表明,尿液和粪便样品中的帕托珠利在0、30和60 d的冷冻放置下含量变化较稳定,试验后帕托珠利的实际含量与试验前的起始含量差别不大,表明在−20 ℃的保存条件下尿液和粪便样品中帕托珠利的稳定性较好,尿液和粪便样品中帕托珠利含量的RSD分别为0.85%~6.93%和1.59%~7.66%。

表 3 尿液样品中帕托珠利的冷冻放置稳定性试验结果Table 3 Result of cryopreservation stability experiment of ponazuril in urine sample n = 5

表 4 粪便样品中帕托珠利的冷冻放置稳定性试验结果Table 4 Result of cryopreservation stability experiment of ponazuril in feces sample n = 5
2.5 实际样品测定
从表5可以看出,猪内服帕托珠利后,粪便中帕托珠利的排出高峰在给药后1.0~1.5 d,平均排出量为11.14 mg,在给药后40.5 d基本排出完毕;尿液中帕托珠利的排出高峰在给药后0.5~1.0 d,平均排出量为0.033 mg,在给药后12.5 d基本排出完毕。由此可见,本方法适用于猪排泄物中帕托珠利的含量检测。

表 5 不同时间段粪便和尿液中帕托珠利的平均排出量1)Table 5 Average elimination amounts of ponazuril in feces and urine samples at different time intervals
3 讨论与结论
3.1 色谱条件优化
三嗪类药物的分析测定多采用毛细管电泳法[10]、HPLC−紫外检测法以及 LC/MS 法[11-12]。本试验采用的HPLC−光电二极管阵列(Photo-diode array,PDA)检测法相比于毛细电泳法和LC/MS法,具有更简便、稳定以及应用范围广的特点。流动相的选择参考相关文献[4, 13-14],水相多采用磷酸盐缓冲溶液以及不同配比的磷酸、甲酸或乙酸水溶液,有机相则为乙腈或甲醇。对比发现乙腈对目标化合物的洗脱能力比甲醇更强且黏度较小,在相同的流速下柱效更高,柱压更低。采用磷酸二氢钾缓冲溶液与0.1%(φ)甲酸水溶液分别作为水相,对比发现以磷酸二氢钾缓冲溶液为流动相时色谱峰更为尖锐且对称。另外,采用相同流动相比例检测猪粪便和尿液中的帕托珠利时,粪便样品色谱图中目标药物的保留时间处有杂质峰干扰,优化流动相比例发现检测尿液和粪便样品中帕托珠利的磷酸二氢钾溶液和乙腈比例分别为(55∶45,V/V)和(56∶44,V/V)时,保留时间适中,干扰性杂质峰与主峰分离完全。
3.2 样品前处理方法优化
3.2.1 提取条件 帕托珠利属于弱极性物质,易溶于乙酸乙酯、乙腈、二氯甲烷等有机溶剂,略溶于甲醇,几乎不溶于水[15]。本试验分别考察了甲醇、乙酸乙酯、乙腈作为提取溶剂,发现乙腈能更有效地沉淀蛋白。帕托珠利的酸度系数(pKa)约为7.4[16],属于弱酸性物质,理论上用酸化有机试剂提取弱酸性药物的效果优于有机试剂的提取效果。本试验分别考察了甲酸和乙酸酸化乙腈作为提取溶剂,结果显示两者的提取效果均较好,但考虑到甲酸挥发性较强,且吸入危害较大,因此最终选用0.2%(φ)乙酸酸化乙腈为提取溶剂。另外,猪尿液中的水溶性物质较多,而二氯甲烷不溶于水但能与乙腈互溶,试验中利用二氯甲烷进行第2次提取后发现二氯甲烷能在充分提取尿液中帕托珠利的同时很好地去除干扰性杂质。
由于猪粪便和尿液中的基质差异较大,同样的提取方法满足不了粪便样品的检测要求,而固相萃取 (Solid phase extraction,SPE)相对于液−液萃取(Liquid-liquid extraction,LLE)具有净化效果好、重现性好等优点[17-19]。本试验利用SPE法有效净化提取了粪便样品中的药物。另外,试验对比研究了乙酸乙酯、乙腈等提取溶剂,发现乙酸乙酯和乙腈提取效率均较高,但乙酸乙酯的脂溶性太强,复溶后溶液黏度较大且浑浊,难以过柱,影响后续净化,而乙腈能有效沉淀蛋白,亦能与水互溶,能为后续利用SPE法净化样品提供方便。
3.2.2 净化条件 据查阅的文献资料 [20-22]及帕托珠利的理化性质,分别选用了混合型阴离子交换(Mixed anion exchange,MAX)和 HLB 小柱作为净化柱,对比发现MAX小柱过柱程序较复杂,样品前处理时间较长,而HLB小柱的过柱方式较简便,具有双亲性共聚物填料,小柱干涸亦不影响净化结果,能够使目标化合物的重复性较好,回收率较高[23]。考虑到淋洗液中乙腈与水的比例对回收率及净化效果的影响,本研究分别考察了乙腈−水(1∶9、2∶8、3∶7、4∶6,V/V)作为淋洗液,每个比例各 5 个平行样品,对比发现乙腈体积占比为10%时回收率为88.52%,RSD为3.24%;乙腈体积占比为20%时,回收率为89.93%,RSD为4.09%;乙腈体积占比为30%时,回收率为92.27%,RSD为2.52%;乙腈体积占比为40%时,回收率为34.66%,RSD为3.56%。净化效果则随着乙腈体积占比的增加略有差异,乙腈体积占比低于30%时,杂质峰较多且响应值较高,高于30%时回收率则会降低,因此最终选用乙腈−水(3∶7,V/V)作为淋洗液。
3.3 结论
本文建立了一种简单易操作、灵敏度高、精密度和重复性好的适用于检测猪排泄物中帕托珠利含量的HPLC法。粪便及尿液样品中帕托珠利的提取回收率均大于89.50%,批间和批内RSD均小于8%,同时在冷冻放置稳定性试验中帕托珠利的稳定性较好。该方法符合生物样品定量分析指导原则的要求,可用于帕托珠利在猪排泄物中的含量测定及在猪体内的排出研究。

