海链藻定向培养对凡纳滨对虾生长、存活及养殖水质的影响
曾国权, 黄 晨, 蒋霞敏, 张朋龙, 彭瑞冰, 陈 琛
海链藻定向培养对凡纳滨对虾生长、存活及养殖水质的影响
曾国权1,3, 黄 晨2, 蒋霞敏2, 张朋龙2, 彭瑞冰2*, 陈 琛1,3
(1.浙江省海洋水产养殖研究所, 浙江 温州 325005; 2.宁波大学 海洋学院, 浙江 宁波 315832; 3.浙江省近岸水域生物资源开发与保护重点实验室,浙江 温州 325005)
旨在探究定向培藻在凡纳滨对虾养殖中应用效果. 选取体长0.545cm的凡纳滨对虾84万尾, 随机分为2组(每组3个重复, 每个室内水泥池(30m2)14万尾), 对照组水体不添加藻, 试验组水体中添加海链藻(藻浓度维持2×104~5×104cell·mL-1), 试验周期25d. 结果表明: 定向培藻对凡纳滨对虾生长、存活及养殖水质影响显著(<0.05), 其中, 对虾体长、体质量成活率和饵料系数均为海链藻组显著大于对照组(<0.05); 养殖水体的pH日差值和、NO3--N、NH4+-N、PO43--P和养殖水体中弧菌数量均为海链藻组显著小于对照组(<0.05). 由此可见, 在凡纳滨对虾养殖过程中, 养殖池中添加定向培海链藻有利于维持养殖池水体的水质稳定, 减少水体的氮磷含量和抑制弧菌的生长, 同时也有利于凡纳滨对虾的健康生长.
定向培藻; 海链藻; 凡纳滨对虾; 生长率; 弧菌
凡纳滨对虾()具有生长速度快, 对饲料蛋白要求低, 出肉率高, 适盐范围广, 耐高温, 抗病力强等优点[1-2]. 近年来我国沿海一带掀起了凡纳滨对虾的养殖热潮, 特别是大棚养殖一年可以养2~3茬, 错开了常规养殖模式的上市高峰期, 实现反季节销售, 养虾经济效益大大提高[3]. 但近年凡纳滨对虾养殖成功率不佳, 主要问题是苗种质量和水质污染[4-5]. 养殖水质的优劣很大程度上会直接决定养殖的成功与否, 而苗种质量也是养殖成功的关键[6]. 目前大多数养殖户为提高养殖成活率, 放养前都先进行标苗, 在水泥池进行20~30d强化培养, 淘汰运输中损伤或劣质的虾苗, 标粗虾苗, 以保证养殖苗种质量和数量[7].
如何缩短养殖周期和提高对虾成活率是目前养殖户迫切需要解决的问题. 近年来国内学者开展了相关研究[8], 彭张明等[9]发现养殖密度和水质盐度均对凡纳滨对虾生长速率有显著性影响, 标苗阶段养殖的最适密度是7×104~8×104尾·m-3, 盐度低于10会显著降低凡纳滨对虾的生长速率; 陈倩伶等[10]探明不同微藻对生物絮团和对虾生长有显著影响; 陈标等[11]发现在标苗养殖阶段投放微藻可显著提高对虾的成活率. 而关于定向培藻对凡纳滨对虾养殖过程影响的研究还处于经验积累型阶段. 为进一步探究微藻定向培养在凡纳滨对虾养殖中应用效果及机理, 我们通过前期研究发现海链藻()具藻相稳定、不易老化和倒藻、去除氮磷效果佳等优点; 虽然海链藻可作为定向培藻的藻株, 但具体在凡纳滨对虾养殖中的应用效果还需要进一步研究验证. 本文通过定向培藻(海链藻)和不断添加藻液以控制养殖水中藻密度, 定期检测养殖水体的水质参数、弧菌数量、对虾生长率和存活率等相关参数, 以期为海链藻定向培养在凡纳滨对虾养殖中的应用提供理论依据.
1 材料与方法
1.1 试验材料
试验于2019年3~4月在浙江海洋水产养殖研究所(永兴基地)进行, 凡纳滨对虾虾苗为购于海南如意来水产养殖有限公司的旺意精选苗, 虾平均体长0.545cm, 平均体质量0.00287g, 实验海链藻藻种均来自于宁波大学藻种室, 实验药品均为分析纯, 培养用水为温州湾海域天然海水, 经沙滤、暗沉淀、脱脂棉过滤、烧开, 最后晾凉后使用.
1.2 试验方法
1.2.1 微藻培养方法
一级培养: 培养容器为5000mL三角烧瓶; 培养条件: 温度(22±0.5)℃, 盐度(20±2), 自然光照和日光灯(70W), 不充气. 培养用水采用烧开消毒.
二级培养: 培养容器为塑料白桶(50L)和1000L橡胶白桶, 置于玻璃钢大棚下培养; 培养条件: 温度(25±5)℃, 盐度(20±2), 自然光照, 充气, 封闭. 培养用水采用漂白粉(含有效氯≥28%)消毒, 用量34g·m-3, 消毒12h以上, 再用洁象牌漂白片消毒, 用量50片·m-3, 消毒12h, 再添加硫代硫酸钠(50g·m-3), 曝气2h后用.
三级培养: 培养池为5m×6m×1.6m的水泥池,温度(25±5)℃, 盐度(20±2), 自然光照, 充气. 培养用水采用加漂白粉(含有效氯≥28%)消毒, 用量67 g·m-3, 消毒12h以上, 再添加硫代硫酸钠(33g·m-3), 曝气2h后用.
1.2.2 标苗方法
5m×6m×1.6m的水泥池, 养殖水位1.2~1.4m, 设置海链藻和对照组各三平行, 各池投放虾苗密度3853尾·m-2, 放虾苗前2d, 在水泥池中放漂白粉消毒水30t, 水温21.8~25.4℃, 盐度18.1~19.2.
海链藻组: 放虾苗前2d, 在水体中添加藻培养液(添加量为0.1L·m-3), 接种海链藻(藻密度为1.0×104cell·mL-1). 隔1~5d换水, 换水量为10cm. 隔1~5d加藻液, 藻液添加量视养殖水体藻密度而定, 养殖水体藻密度维持在2×104~5×104cell·mL-1. 养殖用水和添加水都采用漂白粉消毒水, 处理方法同1.2.1章节三级培养用水.
对照组: 不再加藻, 换水量和频率同海链藻组.
标苗养殖时间25d, 每天投喂00#和0#正大对虾配合饲料, 投喂量为虾体质量的10%~15%, 每日分4次投喂. 每天上午测定水温、pH值、溶氧值和盐度, 换水前测定藻密度, 隔3d测定硝酸盐、亚硝酸盐、氨氮、正磷酸盐, 隔7d测定虾体长和体质量, 实验结束后测定虾体质量、成活率和虾总体质量.
1.3 测量方法
1.3.1 水质测量方法[11]
温度、盐度、pH和溶氧采用多参数水质检测仪(WTW Multi 3620/3630 IDS)测定; 硝酸盐采用锌镉还原法(GB 12763.4-2007)测定; 亚硝酸盐采用重氮-偶氮法(GB 7493-1987)测定; 氨氮采用纳氏比色法(HJ 535-2009)测定; 正磷酸盐采用磷钼蓝分光光度法(HJ 593-2010)测定.
pH日差值和计算公式:
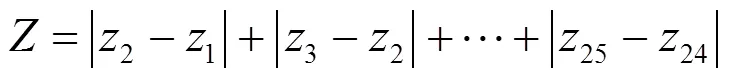
式中:1~25为第1至第25天的pH.
溶氧日差值和计算公式:
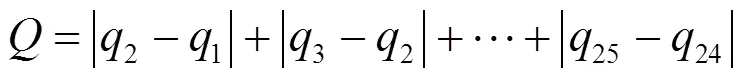
式中:1~25为第1至第25天的溶氧.
1.3.2 微藻计数方法
采用五点采样法采取表层水样1000mL加15mL鲁格氏液固定, 固定2~3h后水样经沉淀浓缩至50mL观察, 采用血球计数板法计数.
1.3.3 弧菌计数方法[11]
采用五点取样法取1000mL水样, 根据弧菌数稀释1~100倍, 吸取0.1mL稀释液滴至TCBS培养基上, 用酒精灯杀菌冷却后的涂布棒将稀释液均匀, 在封闭培养箱30℃下培养24h后计数菌落个数.
1.3.4 对虾生长测量方法
对虾体长测量方法: 采用四点取样法, 捞网捞取50尾左右的凡纳滨对虾, 先使用圆规从眼柄基部到尾节末端量取, 再将圆规从直尺上量取, 最后取平均值.
对虾体质量测定量法: 采用四点取样法, 取100尾左右的凡纳滨对虾虾苗, 捞网甩3次水后用天平测定, 取平均值.
1.3.5 对虾存活率计算方法[11]
试验结束后, 将对虾全池捞取、称量、计数, 虾总体质量和存活率按下式计算:
虾总体质量=各池虾体质量×95%含水率,
式中:为各池虾体质量, g;为平均虾体质量, g;为投放虾苗数, 尾;为每池实验中消耗虾数, 尾.
1.3.6 饵料系数的测定和计算方法[11]
每天记录投饵量, 饵料系数按下式计算:
式中:为每池总投饵量, g;为投放虾苗总体质量, g.
1.4 数据处理
试验数据以平均值±标准差形式表示, 采用SPSS 19.0统计软件进行数据的正态性和方差齐性检验, 再进行单因素方差分析(One-way ANOVA), 用Duncan氏法进行多重比较, 分析组间差异显著性程度(=0.05).
2 结果
2.1 定向培藻对凡纳滨对虾生长的影响
从图1可见, 试验结束后定向培藻组凡纳滨对虾的体长显著高于对照组(<0.05), 相比对照组增加了5.59%, 且定向培藻组对虾的体长与对照组的差距随养殖时间增加而增大.
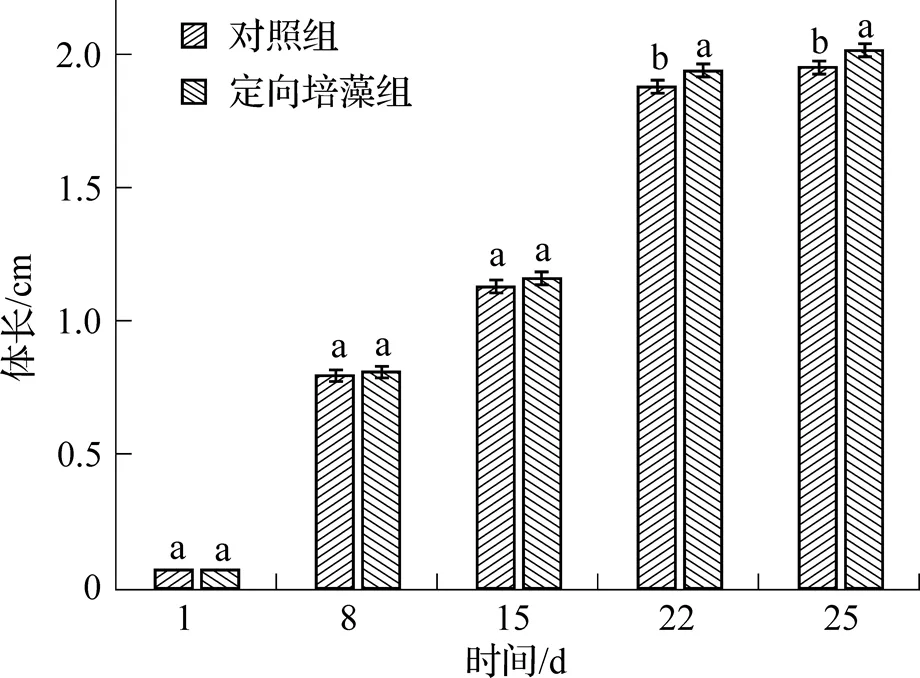
图1 定向培藻对凡纳滨对虾体长的影响
从图2可见, 试验结束后(25d), 定向培藻组凡纳滨对虾的体质量显著高于对照组(<0.05), 相比对照组增加了9.89%, 且随着养殖时间增加, 定向培藻组对虾的体质量与对照组的差距明显增大.
2.2 定向培藻对凡纳滨对虾存活率的影响
从图3可见, 试验结束后, 定向培藻组凡纳滨对虾的存活率显著高于对照组(<0.05), 海链藻组存活率为96.64%, 对照组存活率仅为60.52%, 海链藻组的存活率相比对照组增加了59.68%.

图2 定向培藻对凡纳滨对虾虾苗体质量的影响

图3 定向培藻对凡纳滨对虾虾苗存活率的影响
2.3 定向培藻对凡纳滨对虾饵料系数的影响
从图4可见, 试验结束后, 定向培藻组凡纳滨对虾的饵料系数显著低于对照组(<0.05), 定向培藻组的饵料系数相比对照组减少了8.76%.
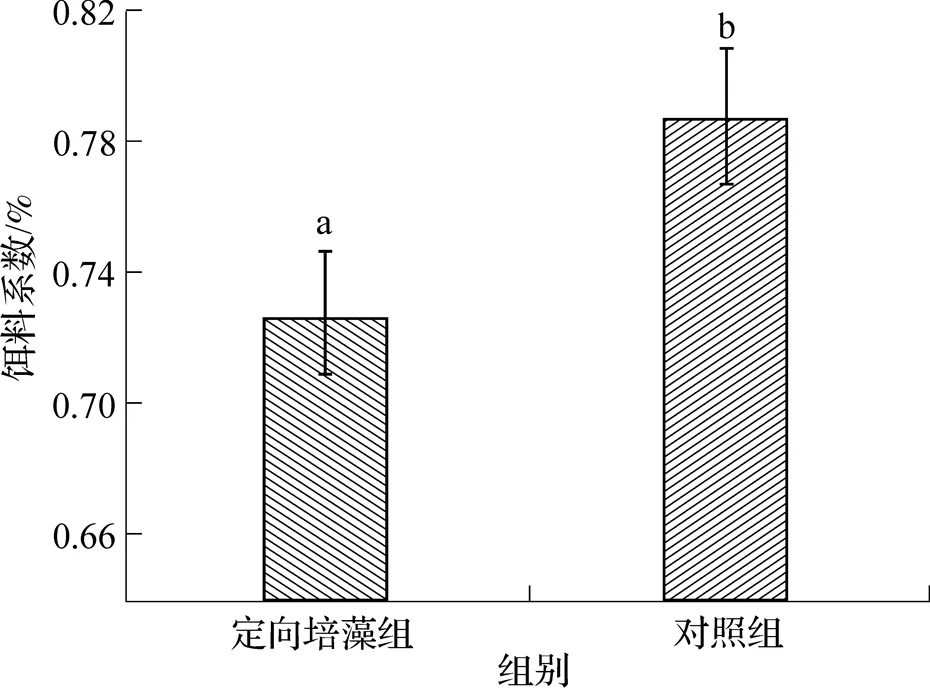
图4 定向培藻对凡纳滨对虾虾苗饵料系数的影响
2.4 定向培藻对养殖水体水质指标的影响
从图5可见, 在试验周期中呈现出定向培藻组和对照组水体溶氧含量随养殖时间增加而减少的趋势, 定向培藻组与对照组水体溶氧含量差异无明显的规律性, 但除第5~9天,第13天和第23天外, 定向培藻组水体溶氧量均高于对照组, 其中在第1~3天、第11天、第15~21天和第25天定向培藻组水体溶氧量显著高于对照组, 其他时间没有显著差异.
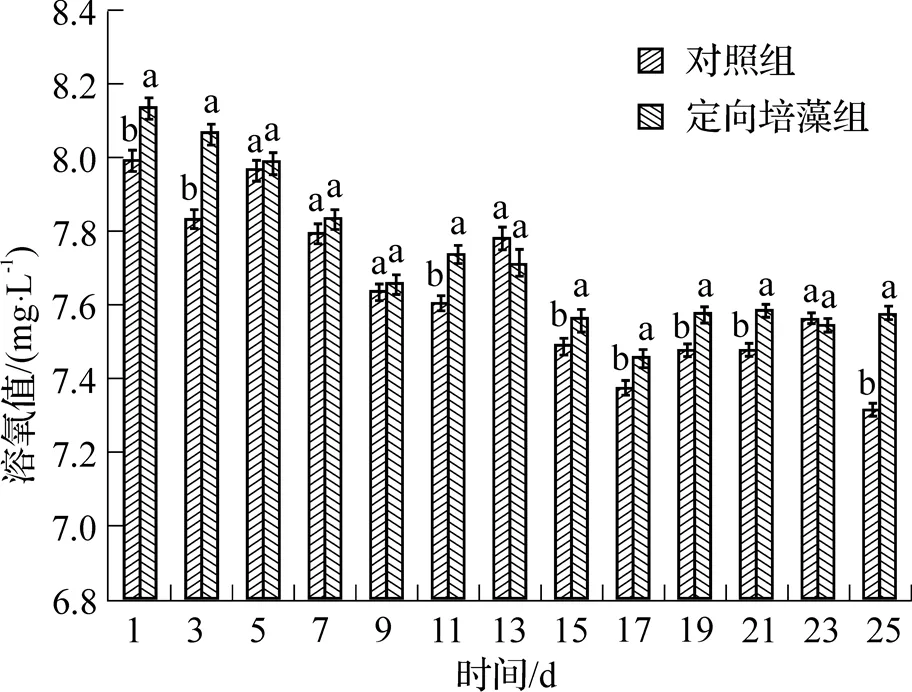
图5 定向培藻对养殖水体溶氧的影响
图6可见, 定向培藻组水体pH日差值和与对照组存在显著性差异(<0.05). 定向培藻组(1.67)显著低于对照组(2.49)(<0.05). 但定向培藻组与对照组水体溶氧日差值和无显著性差异(>0.05), 海链藻组溶氧日差值和为2.24, 对照组溶氧日差值和为2.23.
从定向培藻对养殖水体水质指标的影响数据可以看出(表1), 试验周期中定向培藻组的水体NO3--N含量低于对照组, 其中, 1~19d定向培藻组与对照组存在显著性差异(<0.05), 定向培养藻组水体中NO3--N平均质量浓度为0.872mg·L-1, 对照组水体平均值为1.529mg·L-1; 而在22~25d, 两组之间差异不显著(>0.05). 试验周期中定向培藻组的水体NO2--N含量显著低于对照组(>0.05), 定向培藻组的NO2--N质量浓度为0~0.019mg·L-1, 平均值为0.013mg·L-1; 对照组的NO2--N质量浓度为0.001~0.023mg·L-1, 平均值为0.016mg·L-1. 在试验周期0~16d, 定向培藻组的水体NH4+-N含量显著低于对照组, 而在19~25d定向培藻组的水体NH4+-N含量低于对照组, 但差异不显著(>0.05), 定向培藻组的NH4+-N质量浓度为0.022~0.309 mg·L-1, 平均值为0.169mg·L-1; 对照组的NH4+-N质量浓度为0.022~0.314mg·L-1, 平均值为0.206 mg·L-1. 试验周期中, 定向培藻组水体中PO43--P的质量浓度为0.131~0.488mg·L-1, 平均值为0.283 mg·L-1; 对照组的PO43--P质量浓度为0.177~0.587 mg·L-1, 平均值为0.352mg·L-1, 除了在第1天和第16天外, 其他时间内定向培藻组水体的含量显著低于与对照组(<0.05).

图6 定向培藻对养殖水体pH和溶氧日差值和的影响
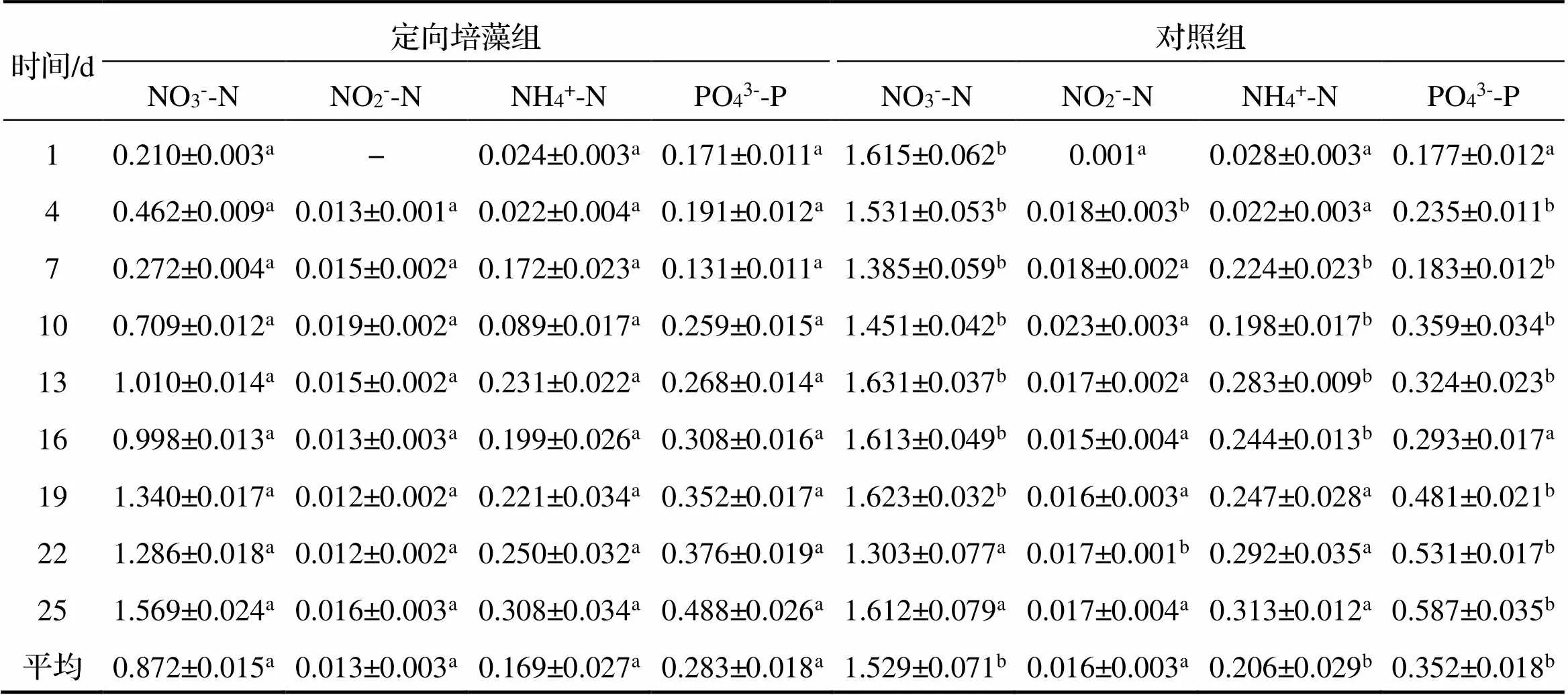
表1 定向培藻对养殖水体水质指标的影响 mg·L-1
2.5 定向培藻对养殖水体弧菌密度的影响
从图7可见, 定向培藻组的弧菌密度显著低于对照组(<0.05). 在第11天, 定向培藻组的弧菌密度为96cfu·mL-1, 对照组为176cfu·mL-1; 在第21天, 定向培藻组的弧菌密度为388cfu·mL-1, 而对照组为838 cfu·mL-1.

图7 定向培藻对标苗水体弧菌密度的影响
2 讨论
定向培藻是指根据不同的环境条件和养殖对象的需要, 在养殖水体中引入易培养且对养殖对象有益的藻种, 使其成为水体中优势种, 并长期在水中稳定[12]. 已有研究表明, 有益微藻在凡纳滨对虾养殖中具有重要作用, 不但可以降低水中细菌数量和增强抗病能力[13-14], 遏制弧菌生长和去除水中的氨氮[15], 还可提高虾类的摄食性和增强虾的活力, 大大提高抗病力[16-17], 增加虾的生长速率和提高存活率[18]. 本研究结果显示, 通过在养殖池中定向培养海链藻有利于提高凡纳滨对虾标苗养殖阶段中的摄食兴趣、运动活力、生长率和成活率, 降低饵料系数, 也进一步证明了定向培养有益微藻将有利于凡纳滨对虾的健康生长和保持养殖水体良好的水质条件. 黄翔鹄等[12]在广东地区通过在养殖池定向培养卵囊藻, 结果表明显著提高了对虾养殖的成功率. 本研究筛选出海链藻和黄翔鹄等发现的卵囊藻均具有藻稳定性、不易老化倒藻和促进对虾健康生长的优点. 但在实践应用过程中, 发现卵囊藻在浙江南部地区养殖池培养过程中生长缓慢, 难以形成优势种, 可能与卵囊藻适宜生长的环境条件有关; 而海链藻是在浙江地区虾塘中进行分离, 相对于卵囊藻, 海链藻更适应浙江地区对虾养殖池的生长环境, 更容易在养殖池中形成优势种, 且藻相稳定性更好.
同时藻类对稳定养殖水质起着十分重要的作用. 藻类能够吸收CO2, 释放O2, 降低NO2--N和NH4+-N等, 稳定pH值, 调节水质[19-20]. NO2--N和NH4+-N是对虾养殖过程中重要水质污染因素, 主要由对虾残饵、排泄物及死虾等有机物分解产生[21]. 当养殖水体中的NO2--N进入对虾血淋巴后, 能够使得氧合血蓝蛋白转化为脱氧血蓝蛋白, 以至于降低血淋巴对氧的亲和性和机体的输氧能力, 对机体产生毒害作用[22]. 溶氧的高低会影响对虾摄食的兴趣, 在溶氧不足情况下, 会影响虾的蜕壳和活动[23], 但高浓度的溶氧又会遏制部分有害菌类的生长[24]. 在养虾和标苗时如何降低水质污染因素, 有效抑制有害藻和菌的滋生, 进一步改善水质, 这已引起学者极大关注[25], Ferreira等[22]发现添加生物絮凝剂可以快速清除水中的NO2--N和NH4+-N含量; Nguyen等[26]发现在凡纳滨对虾育苗期, 投放不同密度的藻能明显提高溶氧和降低氨氮含量; Tzachi等[27]和Mohammad等[28]研究在育苗池中添加糖蜜, 发现可以提高硅藻等有益藻的数量, 改善水质. 本研究发现在凡纳滨对虾标苗养殖池中, 定向培养海链藻可明显降低水中NO3--N、NH4+-N和PO43--P浓度, 增加溶氧, 保持pH值相对稳定. 而这些水体指标的改善, 将有利地保持水体良好与稳定水质环境, 给凡纳滨对虾生长创造良好的生长环境, 减少环境变化的应激反应, 有利于提高凡纳滨对虾的生长率, 减少死亡率.
由于海洋细菌与微藻间存在着密切关系[29-30], 因此海洋弧菌引起的虾病对海水养殖业发展会造成重大威胁. 有研究表明[31-32], 藻菌之间存在拮抗关系, 微藻能够产生抑制细菌生长的抗素物质. 本研究发现, 在养殖池定向培养海链藻后, 养殖池中弧菌数量显著低于没有定向培养藻类的养殖池, 证明养殖水体中海链藻生长可以抑制水体弧菌的生长. 这也是解析了定向培藻有利于凡纳滨对虾成活率的原因, 即海链藻生长抑制养殖水体弧菌的生长, 减少病害的发生, 减少凡纳滨对虾的死亡率. 同时本研究发现随着养殖时间的推移, 养殖池中对虾的生长, 粪便和残饵的大量积累, 造成弧菌数量节节攀升的现象, 尽管海链藻有利于抑制一部分弧菌的滋生, 但也不能完全抑制弧菌的生长. 因此在凡纳滨对虾苗种养殖过程中, 需要保持合理的养殖密度. 由此可见, 在凡纳滨对虾养殖过程中利用定向培藻技术和保持合理养殖密度, 将有利于提高凡纳滨对虾养殖成功率, 降低养殖周期.
[1] 王兴强, 马甡, 董双林. 凡纳滨对虾生物学及养殖生态学研究进展[J]. 海洋湖沼通报, 2004(4):94-100.
[2] 赵永军, 刘延鑫, 徐文彦. 南美白对虾淡水养殖常见细菌性病害及防制技术[J]. 郑州牧业工程高等专科学校学报, 2006, 26(1):37-38.
[3] 周志强, 黄蔚江, 陈挺. 海水池塘大棚第二茬养殖南美白对虾关键技术研究与示范[J]. 科学养鱼, 2019(2):57- 58.
[4] 陈亨, 陈琛, 於俊琦, 等. 不同环境胁迫因子耦合对凡纳滨对虾生长与摄食的影响[J]. 上海海洋大学学报, 2018, 27(2):168-174.
[5] 张汉华, 李卓佳, 郭志勋, 等. 有益微生物对海水养虾池浮游生物生态特征的影响研究[J]. 南方水产, 2005, 1(2):7-14.
[6] 廖栩峥, 陈金荣, 秦海鹏, 等. 凡纳滨对虾室外生物絮团养殖池水体理化因子和细菌的变化[J]. 水产养殖, 2020, 41(1):22-27; 33.
[7] 李举鹏, 周影, 王彩蕴, 等. 南美白对虾标粗生产试验[J]. 水产养殖, 2019, 40(7):1-5.
[8] 李绪岭, 赵金成, 马勇. 南美白对虾车间标苗与盐碱池塘养成有机结合技术[J]. 河北渔业, 2019(2):14-15; 24.
[9] 彭张明, 黄明, 樵江华, 等. 养殖密度和盐度对南美白对虾标粗过程生长性状的影响[J]. 水产科技情报, 2019, 46(3):154-159.
[10] 陈倩伶, 赵永贞, 张瑞杰, 等. 不同微藻饵料对生物絮团育苗系统水质和凡纳滨对虾虾苗生长的影响[J]. 水产科技情报, 2018, 45(2):108-113.
[11] 陈标, 雷小婷, 卓瑞群, 等. 两种微藻对凡纳滨对虾幼体成活率的影响[J]. 生态科学, 2017, 36(6):78-82.
[12] 黄翔鹄, 李长玲, 刘楚吾, 等. 两种微藻改善虾池环境增强凡纳滨对虾抗病力的研究[J]. 水生生物学报, 2002, 26(4):342-347.
[13] Widanarni, Yuniasari D, Sukenda, et al. Nursery culture performance ofwith probiotics addition and different C/N Ratio under laboratory condition[J]. HAYATI Journal of Biosciences, 2010, 17(3):115-119.
[14] 祁真, 杨京平. 几种微生物制剂和微藻在水产养殖中的应用[J]. 水生生物学报, 2004, 28(1):85-89.
[15] Ponce-Palafox J T, Pavia Á A, López D G M, et al. Response surface analysis of temperature-salinity interaction effects on water quality, growth and survival of shrimppostlarvae raised in biofloc intensive nursery production[J]. Aquaculture, 2019, 503: 312-321.
[16] 衣萌萌, 于赫男, 林小涛, 等. 密度胁迫下凡纳滨对虾的行为与生理变化[J]. 暨南大学学报(自然科学与医学版), 2012, 33(1):81-86; 110.
[17] Valle B C S, Dantas E M, Silva J F X, et al. Replacement of fishmeal by fish protein hydrolysate and biofloc in the diets ofpostlarvae[J]. Aquaculture Nutrition, 2015, 21(1):14-17.
[18] Panigrahi A, Saranya C, Ambiganandam K, et al. Evaluation of biofloc generation protocols to adopt high density nursery rearing offor better growth performances, protective responses and immuno modulation in biofloc based technology[J]. Aquaculture, 2020, 522:735095.
[19] Tierney T W, Fleckenstein L J, Ray A J. The effects of density and artificial substrate on intensive shrimpnursery production[J]. Aquacultural Engineering, 2020, 89:102063.
[20] 李卓佳, 李奕雯, 曹煜成, 等. 对虾养殖环境中浮游微藻、细菌及水质的关系[J]. 广东海洋大学学报, 2009, 29(4):95-98.
[21] 张艳敏, 王江涛, 谭丽菊. 海水中藻菌共培养体系对碳氮磷的吸收转化[J]. 生态学报, 2017, 37(14):4843-4851.
[22] Ferreira G S, Silva V F, Martins M A, et al. Strategies for ammonium and nitrite control innursery systems with bioflocs[J]. Aquacultural Engineering, 2020, 88:102040.
[23] 张嘉晨, 曹伏君, 刘建勇, 等. 凡纳滨对虾()生长和耐低溶氧性状的遗传参数估计和遗传获得评估[J]. 海洋与湖沼, 2016, 47(4):869-875.
[24] 陈亮亮, 董宏标, 李卓佳, 等. 生物絮团技术在对虾养殖中的应用及展望[J]. 海洋科学, 2014, 38(8):103-108.
[25] 王大鹏, 何安尤, 谢达祥, 等. 凡纳滨对虾养殖池塘pH值、碱度、硬度和CO2浓度作用机理与调控[J]. 江苏农业科学, 2013, 41(5):352-353.
[26] Nguyen T N A, Bui N T A, Lam M L, et al. Integrating different densities of white leg shrimpand red seaweedin the nursery phase: Effects on water quality and shrimp performance[J]. Journal of Applied Phycology, 2019, 31 (5):3223-3234.
[27] Tzachi M S, Susmita P, Mike S, et al. Use of molasses as carbon source in limited discharge nursery and grow-out systems for[J]. Aquacultural Engineering, 2007, 36(2):184-191.
[28] Mohammad H K, Mir M S, Morteza A, et al. Nursery performance of Pacific white shrimp (Boone, 1931) cultivated in a biofloc system: The effect of adding different carbon sources[J]. Aquaculture Research, 2017, 48(4):64-72.
[29] 林伟, 陈驭, 刘秀云, 等. 饵料微藻培育系统抗弧菌作用机理[J]. 海洋与湖沼, 2000, 31(4):398-403.
[30] Wright C J, Burns L H, Jack A A, et al. Microbial interactions in building of communities[J]. Molecular Oral Microbiology, 2013, 28(2):83-101.
[31] Chayaburakul K, Nash G, Pratanpipat P, et al. Multiple pathogens found in growth-retarded black tiger shrimpcultivated in Thailand[J]. Diseases of Aquatic Organisms, 2004, 60(2):89-96.
[32] 郑莲, 黄翔鹄, 刘楚吾, 等. 两种微藻对凡纳滨对虾养殖环境中细菌数量变化的影响[J]. 台湾海峡, 2005, 24 (2):178-182.
Effects of directional cultivation ofon growth and survival ofand water quality
ZENG Guoquan1,3, HUANG Chen2, JIANG Xiamin2, ZHANG Penglong2, PENG Ruibing2*, CHEN Chen1,3
( 1.Zhejiang Ocean Aquaculture Research Institute, Wenzhou 325005, China; 2.College of Marine Science, Ningbo University, Ningbo 315832, China; 3.Zhejiang Key Laboratory of Exploitation and Preservation of Coastal Bio-resoure, Wenzhou 325005, China )
The purpose of the study was to explore the application effect of microalgae in the culture of. In order to explore the role of directional cultured algae in juvenile, a single-factor test was carried out in indoor cement ponds to examine its effects (group: 2×104~5×104cell·mL-1and control group: without extra microalgae). The effects on juvenile growth, survival rate, feed coefficient, water quality andquantities were evaluated during a period of 25 days. The results showed that the directional cultivation of microalgae had a significant effect on the juvenile growth, survival rate and water quality of the culture pond (<0.05). Upon the completion of the breeding, the body length, body mass, the survival rate of shrimp and the feed coefficient of thegroup were all significantly greater than those of the control group (<0.05). Similarly, the water qualities were also significantly different between two treatments. The sum of the daily pH variation, the NO3--N concentration, NH4+-N concentration, PO43--P concentration, and the amount of totaldensity in the aquaculture water of thegroup were all significantly less than those of the control group (<0.05). The study showed that directional cultivation ofduring thebreeding period was beneficial to maintain the stability of water quality, reduce the content of nitrogen and phosphorus, inhibit the growth of, and improve the healthy growth of.
directional cultivation of microalgae;;; growth;
S966.1
A
1001-5132(2021)01-0001-07
2020−08−08.
宁波大学学报(理工版)网址: http://journallg.nbu.edu.cn/
浙江省重大科技专项(2019C02083); 温州市重大专项(2018ZS002); 宁波市科技项目(202002N3044).
曾国权(1969-), 男, 浙江温州人, 研究员, 主要研究方向: 水产生态健康养殖. E-mail: zeng9988@126.com
彭瑞冰(1988-), 男, 广西平南人, 讲师, 主要研究方向: 水产动物增养殖. E-mail: yuxian966@163.com
(责任编辑 章践立)

